水貂阿留申病毒不同密度表位肽的串聯表達研究
秦飛燕,孫 杰,馬凡舒,張 蕾,閆喜軍
(1.中國農業科學院特產研究所 特種經濟動物分子生物學國家重點實驗室 農業部經濟動物疫病重點實驗室,吉林 長春 130122 ; 2. 河南省農業科學院動物免疫學重點實驗室 農業部動物免疫學重點實驗室 河南省動物免疫學重點實驗室,河南 鄭州 450002)
水貂阿留申病(Aleutian disease,AD)是由細小病毒科(Parvoviridae)阿留申病毒屬(Amdoparvovirus)的水貂阿留申病毒(Aleutian disease virus,ADV)感染引起,是一種世界范圍內流行的慢性傳染病[1-2]。水貂發病的癥狀與病毒和動物的自身情況相關[3]。不同的病毒毒株,動物的不同基因型和年齡表現的癥狀不同[4]。AD臨床表現多樣,經典的AD癥狀在成年水貂表現為自身免疫綜合征,患病水貂高γ-球蛋白血癥、腎小球腎炎、動脈血管炎,水貂繁殖能力大大下降,幼貂常發生急性間質性肺炎[5-6]。該病通過直接接觸、間接接觸以及垂直途徑均可傳播[3]。因此,ADV感染的貂廠難以凈化,給世界各地水貂養殖場帶來巨大的經濟損失。
VP2蛋白作為病毒粒子的主要衣殼蛋白,是病毒主要的抗原表位區,攜帶ADV主要B淋巴細胞抗原表位,是ADV基因功能疫苗和診斷制品研發的重點[7]。通過基因工程技術將抗原表位肽進行串聯,既提高了表位密度,又減少了無關干擾序列的影響[8]。目前,表位串聯技術已經廣泛應用于診斷抗原、免疫原的制備。本研究將ADV VP2蛋白抗原表位肽的編碼序列反復串聯,并在原核系統中誘導表達,然后通過Western Blot和對流免疫電泳(Convective immunoelectrophoresis,CIEP)鑒定重組蛋白抗原性,采用ELISA對重組蛋白的抗原性分析比較,以優選出可以作為檢測抗原的重組蛋白。
1 材料
1.1 菌種、質粒 感受態細胞E.coliBL21(DE3),購自北京全式金生物技術有限公司;質粒pET-30a(+)和標準陰陽性血清,均由經濟動物疫病防控研究室保存。
1.2 主要試劑及儀器 T4 DNA連接酶,購自TaKaRa公司;Protein Marker、限制性內切酶XhoⅠ和EcoRⅠ,均購自Thermo公司;CIEP商業抗原,購自特研生物公司;辣根過氧化物酶標記山羊抗雪貂抗體(IgG/HRP),購自KPL公司;His-Tagged Protein Purification Kit,購自康為世紀生物技術有限公司;蛋白電泳儀,購自Bio-Rad公司;SpectraMax190光吸收酶標儀,購自Molecular Devices公司;DYCP-38B型對流免疫電泳儀,購自北京六一儀器廠。
2 方法
2.1 不同表位密度串聯體的設計與抗原性預測 基于前期工作基礎,我們選取了ADV-DL株VP2的一段表位肽P(415~433aa,氨基酸序列為SNYYSDHEIEQHTAKQPKL)為基礎,分別將2、4、6、8段表位肽P用柔性Linker(GGGGS)串聯連接,并在基因序列首尾分別添加限制性內切酶XhoⅠ和EcoRⅠ的酶切位點,由生工生物工程(上海)股份有限公司合成。并采用DNASTAR軟件中的Protean對多表位串聯體進行抗原性分析。
2.2 不同表位密度重組表達質粒的構建 用限制性內切酶XhoⅠ和EcoRⅠ 雙酶切pET-30a(+),使用DNA純化回收試劑盒回收5 422 bp的載體片段。通過T4 DNA連接酶將串聯表位基因定向連接到pET-30a(+)多克隆位點,構建含有不同數量表位肽的4個重組質粒;然后轉化至E.coliBL21(DE3),于37 ℃震蕩培養12 h后,涂布于卡那霉素抗性瓊脂平板繼續培養12 h;挑取單菌落培養后,提取質粒DNA進行雙酶切鑒定,將陽性克隆送至生工生物工程(上海)股份有限公司測序驗證,將測序正確的重組質粒命名為pET-P2、pET-P4、pET-P6和pET-P8。
2.3 不同表位密度重組蛋白的表達與純化 將測序正確的陽性克隆菌種分別接種于4支裝有5 mL新鮮LB培養基(含50 mg/L卡那霉素)的試管中,于37 ℃培養至OD600值達到0.4~0.6時,加入IPTG(終濃度為1 mmol/L),37 ℃誘導4 h。
誘導結束后,收集菌液,4 ℃、10 000 r/min離心5 min,棄上清。用預冷的PBS(pH值7.4)重懸菌體,在冰浴條件下超聲破碎(功率300 w,工作5 s,間歇5 s,30次),然后4 ℃、12 000 r/min離心15 min,收集上清,經0.22 μm的濾器過濾,純化策略參考康為世紀公司His-Tagged Protein Purification Kit說明書進行,將Ni-Agarose Resin填料混勻后加入層析柱,室溫靜置10 min,待凝膠與溶液分層后,把底部的出液孔打開,讓乙醇通過重力作用緩慢流出;向裝填好的柱中加入5倍體積的去離子水將乙醇沖洗干凈后,再用8倍柱體積的Binding Buffer平衡柱子;取過濾后的上清負載上柱,流速為10倍柱體積/h,收集流穿液;使用15倍柱體積的Binding Buffer沖洗柱子,洗去雜蛋白。使用適量Elution Buffer洗脫并收集目的蛋白。通過BCA法測定蛋白濃度。
2.4 不同表位密度重組蛋白的抗原性鑒定
2.4.1 Western Blot鑒定抗原性 將純化后的蛋白經SDS-PAGE分析,電轉印至NC膜上,用含5% 脫脂乳的PBST封閉2 h,用PBST洗滌3次,10 min/次;抗ADV標準陽性血清(1∶200)37 ℃孵育1 h,用PBST洗滌5次,10 min/次;山羊抗雪貂IgG/HRP(1∶4 000)37 ℃孵育1 h,用PBST洗滌5次,10 min/次;TMB顯色。
2.4.2 CIEP鑒定抗原性 制備含1%瓊脂糖的巴比妥緩沖液(巴比妥1.84 g,巴比妥鈉 10.3 g,溶于1 L水中,調節pH值至8.6),煮沸至瓊脂糖充分溶解后,取20 mL該溶液平均覆蓋于6 cm×6 cm玻璃板上,厚度應達到2~3 mm。待凝膠凝固后,用毛細管在凝膠表面打孔并挑去孔內瓊脂塊,小孔應成對排布,間隔1 cm左右。
將CIEP商業抗原、各重組蛋白抗原和抗ADV標準陰、陽性血清分別加到瓊脂板上相應的孔中,將已加樣品的瓊脂板置于電泳槽內,兩端用巴比妥緩沖液浸泡后的3層棉布搭橋,抗原接負極,抗體接正極。將設備置于90 V電壓下電泳45 min,結束后由2個經驗豐富的操作人員觀察瓊脂板上抗原和抗體間的沉淀線。
2.5 不同表位密度重組蛋白的抗原性比較 將純化的重組抗原蛋白PP4、PP6和PP8分別均以質量濃度5、2.5、1 μg/ mL包被96孔酶標板,分別以1∶100稀釋的抗ADV標準陰、陽性血清為一抗,山羊抗雪貂IgG/HRP(1∶4 000)為二抗,其余步驟按常規ELISA進行,最后讀取OD450值,計算P/N值。比較不同重組抗原的抗原性。
3 結果
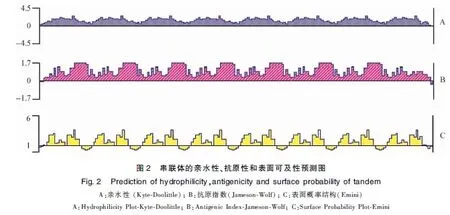
3.1 串聯體的親水性、抗原性和表面可及性預測結果 以8個表位肽串聯為例,用Linker依次串聯連接(具體DNA序列見圖1),采用DNASTAR軟件中的Protean對多表位串聯體進行親水性、抗原性和表面可及性分析,見中插彩版圖2。結果顯示,多表位串聯體各自表位的親水性基本沒變;串聯體仍具有原來各自的表位特征,也沒有新的抗原表位產生,且Linker所在位置抗原性很低。由此可以推測該設計結果中串聯體各表位具有獨立的抗原性。

圖1 8個表位肽串聯體的DNA序列Fig.1 DNA sequence of 8 epitope peptide concatenates注:加粗部分是酶切位點序列,框內部分是Linker序列Note:The bold part is the sequence of restriction sites,and the part in the box is the Linker sequence
3.2 重組質粒的酶切鑒定 將4個重組質粒pET-2、4、6、8經限制性內切酶XhoⅠ和EcoR Ⅰ雙酶切鑒定,瓊脂糖凝膠電泳可見約1 159、1 303、1 447 bp和1 591 bp大小的DNA片段(見圖3)。測序結果顯示,片段大小與預期大小相符且讀碼框正確。
3.3 重組蛋白的抗原性鑒定 SDS-PAGE結果顯示,重組蛋白PP2未能成功表達。Western Blot結果顯示,成功表達的3個重組蛋白大小符合預期,且均能夠被抗ADV陽性血清所識別(見圖4),同時這些重組蛋白不與抗ADV陰性血清反應。另外,CIEP結果顯示,在商業抗原和3個重組蛋白與抗ADV陽性血清間均產生了肉眼可見的沉淀線,與抗ADV陰性血清間均未形成沉淀線。結果表明,3個重組蛋白均能與抗ADV陽性血清發生特異性反應,具有一定的抗原性。
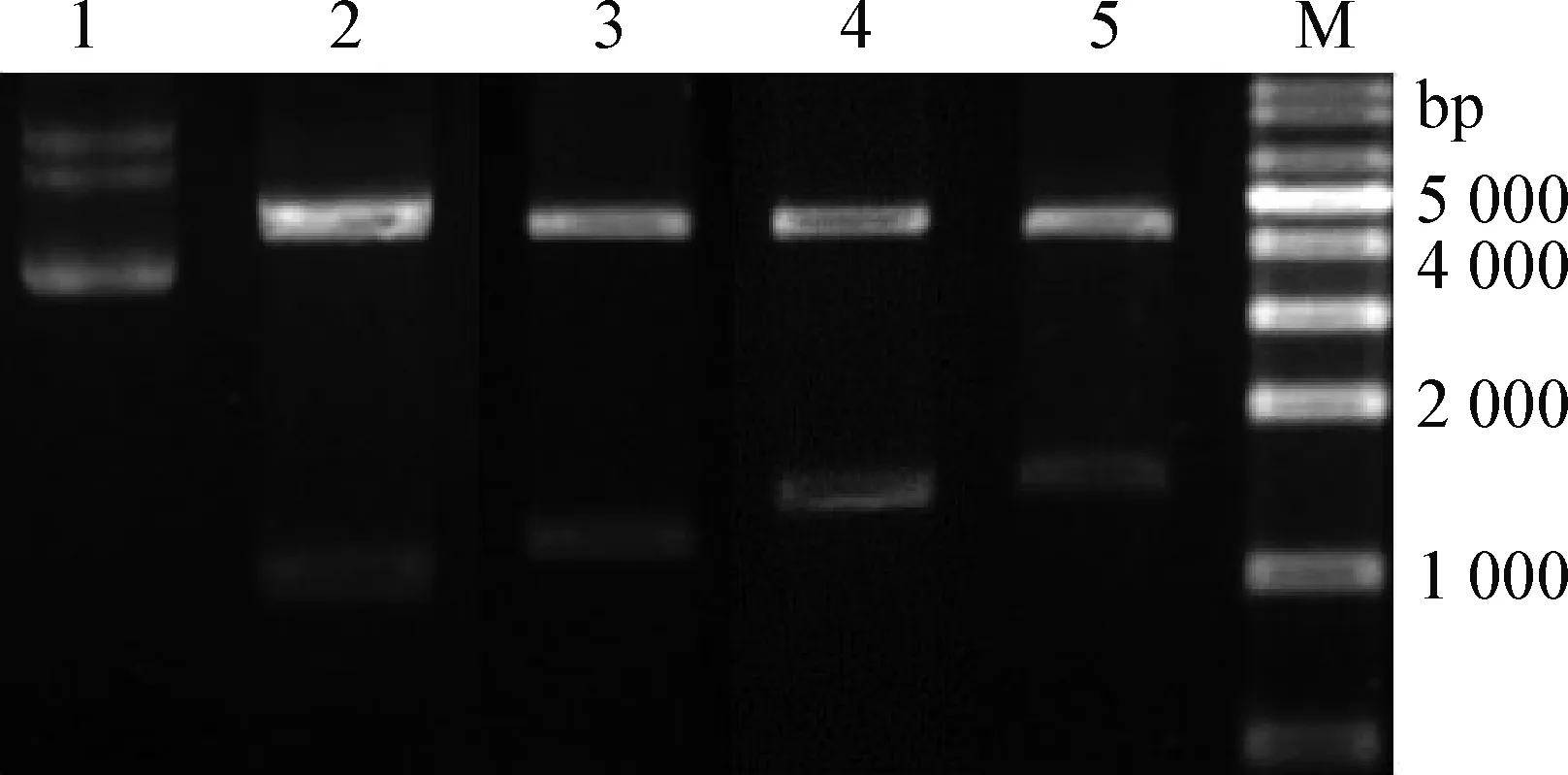
圖3 重組質粒的雙酶切鑒定Fig.3 Identification of recombinant plasmids by double enzyme digestionM:DL-10 000; 1:pET-30a(+)質粒對照; 2:pET-P2;3:pET-P4; 4:pET-P6; 5:pET-P8M:DL-10 000; 1:pET-30a(+)plasmid control;2:pET-P2; 3:pET-P4; 4:pET-P6; 5:pET-P8
3.4 重組蛋白抗原性的ELISA分析 采用ELISA方法鑒定純化后的重組蛋白PP4、PP6和PP8的抗原性,結果顯示,3個重組蛋白與ADV陽性血清反應OD450值均在2.0左右,呈現陽性;與陰性血清反應的OD450值均在0.1左右,呈現陰性。圖5為在3種不同質量濃度下3個重組蛋白的檢測結果P/N值。在3個重組蛋白中PP8的P/N值最高,PP6次之,PP4最低。結果表明,重組蛋白PP8的抗原性最強。
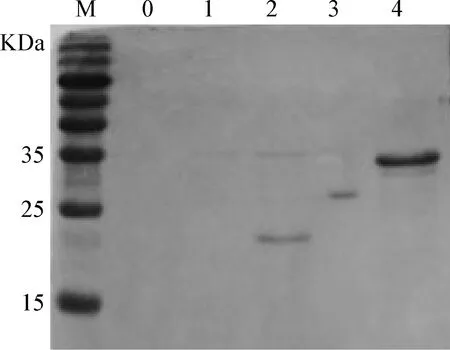
圖4 重組蛋白的Western Blot分析Fig.4 Identification of the recombinant protein by Western BlotM:蛋白分子質量標準; 0:空載體對照; 1:PP2; 2:PP4; 3:PP6; 4:PP8M:Protein Marker; 0:Vector control; 1:PP2; 2:PP4; 3:PP6; 4:PP8
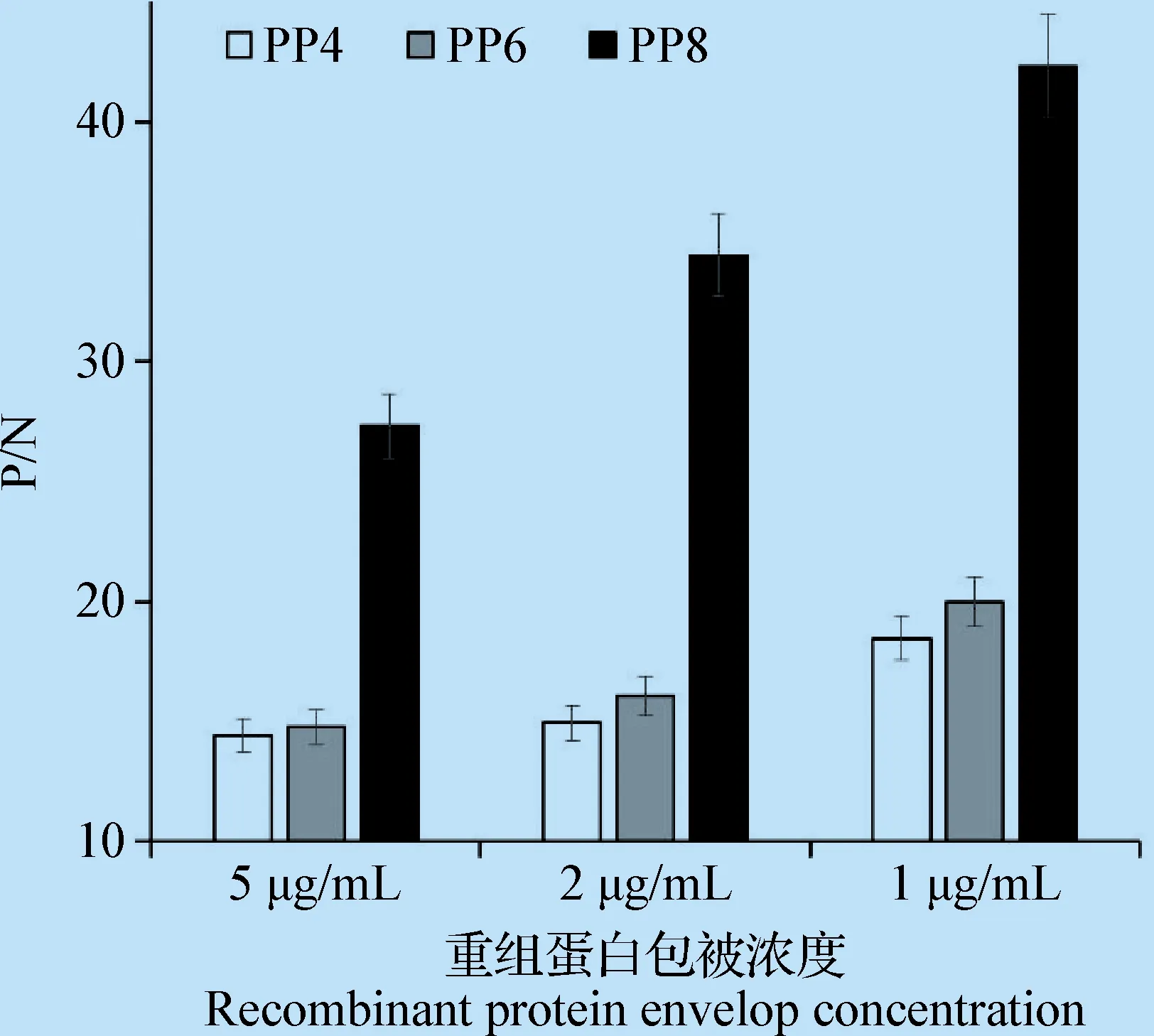
圖5 ELISA比較不同抗原表位密度重組蛋白的抗原性Fig.5 Antigenicity comparison of the different multi-copy antigenic epitopes P by ELISA
4 討論
現代免疫學認為,有效的免疫保護來源于一組表位的合理組合與搭配,表位抗原是目前診斷研究的一個熱點[9]。綜合文獻發現,通過不斷串聯的方式提高表位密度,會導致串聯基因的片段變大,可能會影響大腸桿菌的異源表達,降低重組蛋白的表達量,甚至不表達[10]。有研究報道,在牛病毒性腹瀉病病毒(BVDV)的研究中,將BVDV的雙表位基因進行串聯,原核表達獲得含有2、6、10、12個和14個 表位肽的5種重組蛋白,其中含有12個表位肽的重組蛋白的表達量和抗原性有別其他重組蛋白[8]。因此也并非抗原表位密度越高抗原性就越高。在ADV診斷抗原的研究中也有關于多表位串聯的成功嘗試[11],本研究試圖以不同抗原表位密度的重組蛋白抗原性的差異作為抗原研究的一個新的切入點,對ADV多表位串聯診斷抗原進行初步探究。
串聯的抗原表位之間一般會采用連接肽進行連接以改善重組蛋白的折疊和活性[12]。早期的研究一般采用甘氨酸(G)和絲氨酸(S)聯合應用于表位的Linker,只是單純地考慮氨基酸的剛柔性以及避免連接的2個肽或蛋白域的相互作用[13]。目前,最常用的柔性連接肽就是由Huston等人提出的(GGGGS)n(n≤6)序列,通過調整重復數n來優化連接肽的長度,使得功能域適當分開或保持域間的作用,這幾乎已經成為一種“通用連接肽”[14]。在本研究中應用了GGGGS作為Linker,具有良好的柔性,從而保證了各表位之間相互獨立。但是并沒有嘗試其他長度的組合。其他類型的Linker對串聯表位重組蛋白的表達量或者抗原性是否存在影響,值得進一步研究。
ADV的VP2蛋白是其主要抗原決定簇的載體,在AD的診斷上具有較高的價值[15]。Bloom通過將VP2分成9段進行原核表達,發現位于290~525位氨基酸之間的3個抗原表位具有穩定的免疫原性[3],基于此,本研究以415~433位的表位肽為基礎,設計了2、4、6、8段表位肽重復串聯的串聯體,預測結果表明,均無新表位產生及表位漂移,能最大限度的保有串聯體各表位的抗原性。經大腸桿菌系統誘導表達,結果3個串聯體均以可溶性形式獲得了高效表達,且重組蛋白PP8的表達量最高,經Ni-NTA親和層析柱純化后獲得了純度高達95%的重組蛋白,而PP2未能成功表達,可能是由于短肽太小,難以表達。Western Blot和CIEP均證明重組蛋白串聯體可被ADV抗體特異性識別,具有良好的抗原性;經ELISA分析比較各重組蛋白的抗原性,表明重組蛋白PP8的抗原性最強。雖然我們在PP4、PP6和PP8的抗原性比較分析中發現,表位密度越大抗原性越強,但本研究最多只串聯了8段表位肽,更多表位肽的串聯是否會進一步提高抗原性,還有待深入研究。
因此,本研究以不同密度抗原表位串聯表達,分析比較其抗原性,在建立ADV感染的血清學檢測方法中具有重要意義,也為多表位疫苗的研究提供了科學依據。