臍帶脫細胞支架培養鼠肝前體樣細胞功能研究
景宏舒 彭媛 王振宇 李偉建 袁天杰 張洪丹 鄢和新 翟博
肝臟組織工程,是一個跨學科的綜合領域,涉及工程學、物理科學和生命科學等學科,旨在體外構建出有功能的肝臟[1]。肝臟細胞、支架材料以及細胞生長因子并稱為肝臟組織工程的三大基本組成要素[2]。組織脫細胞技術是運用物理和化學方法,最大限度去除細胞成分,降低免疫原性,更好地保留細胞外基質成分的一項工程技術[3,4]。
材料與方法
一、材料與試劑
C57BL/6雄性小鼠購自上海南方模式生物科技有限公司。新鮮臍帶取自上海交通大學醫學院附屬瑞金醫院婦產科孕產婦,血清病毒指標陰性,已簽署相關知情同意書。
TEM基于HepX Basal,補充成分N2和B27購自源培生物科技股份有限公司,FBS購自以色列BI公司,HGF、EGF、FGF 、A83-01、CHIR-99021和Y-27632均購自美國TargetMol公司,1% 丙酮酸鈉溶液、Nac、Vc均購自上海陶速生物科技有限公司。KCI、SDS、TritonX-100、三溴乙醇粉末、EGTA粉末、BSA粉末均購自美國Sigma-Aldrich公司,Percoll溶液購自上海索寶生物科技有限公司,Ⅳ型膠原酶購自美國worthington公司。細胞膜紅色熒光探針購自上海碧云天生物技術有限公司。
二、實驗方法
(一)臍帶脫細胞工藝處理 新鮮臍帶組織置于無菌TissueMateTM組織運輸液內,冰上保存并運輸。取出臍帶,用無菌PBS溶液洗凈血污。切成長度3 cm的小段,沿長軸剖開,小心剔除2根臍動脈和1根臍靜脈。依次浸沒在10 mM TBS低滲溶液、含1 M KCl和1 %(v/v)TritonX-100高滲溶液、0.03 %(w/v)SDS溶液、50 mM TBS等滲溶液內,每個處理階段需震蕩作用12~24 h,最后用純化水反復沖洗,冷凍干燥24 h后制備臍帶脫細胞支架材料,25kGy低溫輻照滅菌,4 ℃長期保存。
(二)小鼠原代肝細胞分離 麻醉雄性C57BL/6小鼠,400 mg/kg劑量腹腔注射2 %三溴乙醇溶液(阿拉丁),開腹充分暴露肝臟。將留置針從門靜脈遠心端穿刺,向肝臟方向依次灌注使用0.02% EGTA溶液和0.02% Ⅳ型膠原酶灌注液,肉眼觀察肝臟逐漸變軟時,停止灌注。剪下肝臟,放在內盛TEM的培養皿內,用1 mL注射器推桿鈍性碾磨肝臟,直至觀察無明顯塊狀組織,制得細胞懸液。用70 μm濾網濾棄組織碎片,低速離心,用等體積Percoll溶液純化得到小鼠原代肝細胞。
(三)肝前體樣細胞2D培養和標記 分離得到的原代肝細胞,用轉化與擴增培養基(Transition and Expansion Media, TEM)接種均勻培養。培養兩周后,在TEM培養體系下,添加0.2 μM DiL共孵育20 min,在熒光倒置顯微鏡(Nicon)下觀察小鼠肝前體樣細胞(Rodent hepatocyte-derived liver progenitor-like cells, rHepLPCs)的標記情況。
(四)核酸、羥脯氨酸和糖胺聚糖定量分析 稱取冷凍干燥處理過的臍帶組織和臍帶脫細胞材料,使用DNA抽提試劑盒(QIAamp)、羥脯氨酸定量試劑盒(酸化法)和BlyscanTM 硫酸化糖胺聚糖定量試劑盒(Biocolar),根據公式計算各個樣品內各成分含量。
(五)石蠟包埋切片和化學染色 10%甲醛固定,不同濃度酒精脫水(75%、95%和100%),二甲苯脫蠟,用熔化石蠟包埋樣品。用輪轉式切片機切片、制片并烘干,常溫保存。Masson染色和HE染色選用相應試劑盒并拍攝圖片。
(六)肝前體樣細胞3D培養和細胞增殖情況 制備rHepLPC細胞懸液,密度在5×107/mL,50 μL體積量接種在支架材料的華通膠面上,30 rpm水平搖晃培養,構建三維支架上培養rHepLPCs復合體(3D-rHepLPCs)。使用alamarBlueTM細胞活力檢測試劑(Invitrogen)檢測細胞活性,酶標儀讀取吸光度值定量分析細胞增殖情況,對照組為2D培養的rHepLPCs。
(七)熒光定量PCR 使用Trizol試劑裂解支架上的細胞,三氯甲烷和異丙醇提取總RNA,使用GoScript?反轉錄試劑盒(Promega)合成cDNA,使用7300 plus實時PCR系統(Life Technologies)和SYBR Green qPCR Mix(2X,High ROX)(碧云天生物科技有限公司),以β-actin為內參進行內部控制計算相關基因的表達量,使用△△Ct方法分析基因轉錄數據,引物由上海華津生物科技有限公司合成,引物序列選自PrimerBank數據庫。
(八)氨清除和尿素合成 換過新鮮培養基后,向TEM培養基中加入3 mM NH4CI,與細胞共同孵育24小時,氨成分(快速)試劑盒(Megazyme)檢測氨清除量,QuantiChromTM尿素測定試劑盒(BioAssay Systems)檢測尿素含量。
(九)統計學處理 通過GraphPad Prism 7軟件進行統計學分析,采用student’st檢驗,P<0.05為差異有統計學意義。
結 果
一、臍帶脫細胞材料的外觀和內部結構
將新鮮臍帶組織置于低-高滲透壓環境破壞細胞,使用TritonX-100和SDS有效去除殘留的細胞碎片,經過冷凍干燥,增加材料內部貫通程度,低溫輻照滅菌,制備臍帶脫細胞支架材料。H&E染色示材料孔隙增大,細胞核有效去除,而Masson染色示材料仍保留較多膠原成分,見圖1。
二、材料的核酸殘留量和細胞外基質含量情況
經定量分析,脫細胞處理前的臍帶組織核酸含量為(629.87±22.30)ng/mg (干重),而臍帶脫細胞支架材料僅保留(60.20±1.42)ng/mg (干重)核酸含量,核酸去除率達到90.5 %以上,有統計學上差異,P=0.0023;脫細胞處理前的臍帶組織羥脯氨酸含量為(4.97±1.41)μg/mg(干重),臍帶脫細胞支架材料仍能保留(2.74±0.49)μg/mg(干重)羥脯氨酸含量,差異無統計學意義(P=0.101 0);脫細胞處理前的臍帶組織有(8.82±0.18)μg/mg(干重)糖胺聚糖含量,脫細胞處理后的支架材料含量為6.80±0.23)μg/mg(干重糖胺聚糖含量,有統計學上差異(P=0.030 6)。脫細胞工藝去除核酸效果明顯,對羥脯氨酸和糖胺聚糖等成分含量影響較小。
三、rHepLPCs在臍帶脫細胞支架上的分布和增殖情況
新鮮分離的小鼠原代肝細胞胞質大核深染,呈多邊形,形態不均一。在TEM體外培養14 d,細胞形態發生變化,呈魚梭形,核質比增大,形態均一。用Dil標記過的肝細胞在熒光顯微鏡鏡下分布均勻,易于定位追蹤。在TEM和三維培養下rHepLPCs(rHepLPCs-3D),細胞培養情況見圖2。細胞增殖方面,第一天時支架上培養rHepLPCs細胞稍慢于平面培養,而培養14 d,細胞數量十分接近平面擴增量,見表1。

表1 不同天數支架材料上培養肝前體樣細胞的吸光度值(±s)
四、rHepLPCs在臍帶脫細胞支架上的功能基因表達和氨代謝情況
QPCR分析小鼠原代肝細胞、2D培養下rHepLPCs和rHepLPCs-3D功能基因表達情況,見表2。TEM作用下原代肝細胞向肝前體樣細胞轉化過程中,肝細胞標志物HNF4α表達明顯下降,膽管細胞標志物CK19表達明顯升高,提示肝前體細胞在體外高效擴增中部分丟失肝細胞功能,血漿蛋白Alb、氨代謝關鍵酶CPS和糖異生關鍵酶G6PC相應地表達下調。在臍帶脫細胞支架上培養第7天和第14天,肝細胞功能基因表達部分恢復上調,膽管細胞標志物明顯下調。
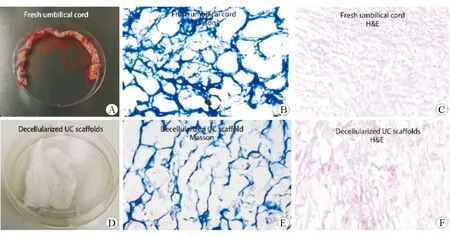
A:剖宮產婦臍帶;B:新鮮臍帶Masson染色;C:新鮮臍帶H&E染色;D:臍帶脫細胞支架材料;E:支架材料Masson染色;F:支架材料H&E染色,×40
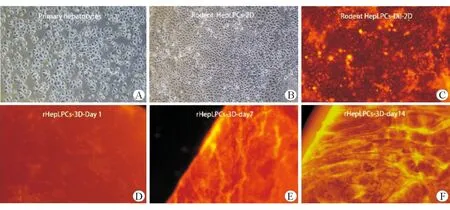
A:原代肝細胞貼壁4 h;B:肝前體樣細胞2D培養下14 h;C:標記過Dil的rHepLPCs;D:支架培養rHepLPCs第1天;E:支架培養rHepLPCs第7天;F:支架培養rHepLPCs第14天,×40

表2 2D和3D培養下肝前體樣細胞功能基因比較(±s)
氨代謝能力是肝細胞解毒功能的重要內容,表現為氨解毒和尿素合成的兩個過程。2D培養下的rHepLPCs,氨清除量為(5.7±0.9)mg/(dL·106細胞·d),而尿素含量為(7.1±2.5)mg/(dL·106細胞·d),3D支架培養的rHepLPCs在培養1周時氨清除和尿素量達到2D培養的3倍水平,在培養2周時氨清除和尿素量達到2D培養的3倍水平近6倍,均有統計學意義,P<0.05,見表3。

表3 2D和3D培養下肝前體樣細胞氨代謝能力比較[mg/( dL·106細胞·d)]
討 論
組織工程化肝臟的核心要素是細胞,原代肝細胞是最理想的種子細胞[5,6]。細胞支架材料的選擇,對3D培養體系下細胞功能提升和長期存活至關重要。使用化學小分子調控轉錄因子的表達逆轉肝細胞命運,實現肝前體樣細胞在體外高效擴增和進一步分化成熟,解決了肝細胞在體外不能長期擴增的難題[7,8]。rHepLPCs在臍帶脫細胞支架上培養,實現了肝細胞功能部分恢復,尤其在氨代謝方面表現突出。
臍帶組織(Umbilical Cord, UC),屬于黏液結締組織,包含兩條動脈和一條靜脈,周圍包繞著華通膠成分(Wharton’s jelly matrix, DWJM)。華通膠富含膠原(Collagen)、糖胺聚糖(Glycosaminoglycan, GAGs)和多種生長因子[9]。此外,無血管滋養管、神經、淋巴等結構,使剝離臍帶血管、保留華通膠結構成為可能[10]。從材料來源講,臍帶脫細胞支架作具有臨床上易獲得,醫學倫理爭議小等特點。
有多家國內外研究團隊報道臍帶脫細胞支架在軟骨重建和神經損傷等組織修復方面,側面證明臍帶脫細胞支架材料的潛在應用價值[11,12]。
從組織工程化肝臟的構建方式講,采用多種培養策略,提高肝前體樣細胞在支架上再定植效率和分化成熟度[13-15];多細胞培養模式,如肝細胞、間充質干細胞和內皮細胞共培養,對改善細胞的氧耗和新陳代謝和功能性血管網絡形成至關重要[16]。
綜上所述,聯合臍帶脫細胞支架的3D培養,肝前體細胞可以發揮氨代謝的優勢,建立富有潛力的肝臟組織功能單元,為以血氨升高為特征的急性肝衰竭治療提供新選擇。

