基于PI3K/AKT信號通路探討苦參堿對人皮膚鱗狀細胞癌A431細胞的作用研究
方曉琳,李海艦,趙秋嬋,李莉娟,宋少華
(廣東省第二人民醫(yī)院檢驗醫(yī)學部,廣東 廣州 510317)
人皮膚鱗狀細胞癌(human skin squamous cellcarcinoma,SCC)是主要發(fā)生于人體皮膚的鱗狀上皮組織,是我國常見的皮膚惡性腫瘤之一。其發(fā)病率較高,在皮膚惡性腫瘤中占第2位,流行病學研究表明大約20%人當中可能發(fā)生皮膚癌,并且其發(fā)病率每年呈逐漸增高的趨勢,其已成為世界性的影響公眾健康的問題[1]。目前其病因尚未闡明,研究表明[2]其可能與慢性炎癥、化學致癌劑、人乳頭瘤病毒感染等密切相關。臨床上治療SCC的方式主要以手術切除為主,輔助以放射治療和化學藥物治療,但以上治療方式對人體皮膚損傷甚大,此外,患者依從性和預后也較差[3],因此尋找高效、低毒副作用的防治SCC新藥具有重要的臨床意義。
苦參為豆科植物苦參的干燥根,其味苦,性寒,現(xiàn)代藥理學研究表明[4-5]其具有抗腫瘤、抗菌、強心、抗炎等多種藥理作用。苦參堿(matrine,MT)是苦參中主要的活性成分,已有較多研究表明[6-10]其在體外對胰腺癌、肺癌、結腸癌、乳腺癌和前列腺癌等多種腫瘤細胞均具有較好的殺傷作用。林星鎮(zhèn)[11]研究發(fā)現(xiàn)苦參堿對人口腔鱗狀細胞癌Tca8113細胞具有明顯的體外增殖抑制作用,以及通過上調FAS蛋白、Caspase-3表達,激活細胞內核酸內切酶,誘導腫瘤細胞凋亡,綜上提示苦參堿可能對SCC具有較好的治療作用。本研究旨在探討苦參堿對SCC細胞增殖、凋亡和PI3K/AKT信號通路的影響,初步闡明其作用機制,為苦參堿防治SCC的臨床應用提供部分實驗依據(jù)。
1 材料與儀器
1.1 藥物與試劑
苦參堿(南京凱基生物科技發(fā)展有限公司,質量分數(shù)>97%);人皮膚鱗狀細胞癌A431細胞株(天津奧爾生物科技有限公司);CCK-8、PBS緩沖液、DMEM細胞培養(yǎng)液、胎牛血清、DMSO、0.25%胰酶消化液(美國Gibco公司);BCA 蛋白定量試劑盒(南京生航生物技術有限公司);AKT抗體、HRP標記二抗(英國Abcam公司);腫瘤壞死因子α(TNF-α)和白介素1α(IL-1α)ELISA檢測試劑盒(上海銘博生物科技有限公司)。
1.2 主要儀器
BG-sub MIDI電泳儀、Applied Biosystems PCR儀、CO2培養(yǎng)箱(Thermo Fisher Scientific公司);Sunrise-Basci酶標儀(奧地利Tecan公司)。
2 方法
2.1 人皮膚鱗狀細胞癌A431細胞培養(yǎng)
采用DMEM培養(yǎng)基[含10%(φ)胎牛血清和0.5%抗生素]于5%(φ)CO2、37 ℃細胞培養(yǎng)箱中常規(guī)傳代培養(yǎng)人皮膚鱗狀細胞癌A431細胞。具體操作步驟如下:使用PBS緩沖液清洗細胞3遍,0.25%胰酶消化液1 mL消化細胞,倒置顯微鏡下觀察,待細胞變圓后加入2 mL培養(yǎng)基終止消化,接著轉移至無菌Ep管中并離心(1 000 r/min ,5 min),棄去舊培養(yǎng)液,加入新鮮培養(yǎng)液重懸細胞,常規(guī)傳代培養(yǎng)。
2.2 CCK-8 法檢測人皮膚鱗狀細胞癌A431細胞增殖抑制率
0.25%胰酶消化液消化處于對數(shù)生長期的人皮膚鱗狀細胞癌A431細胞,將對數(shù)期人皮膚鱗狀細胞癌A431細胞接種于96孔板,每孔為1×104個細胞,于含有5% CO2的37 ℃細胞培養(yǎng)箱培養(yǎng)24 h后,分別加入苦參堿梯度濃度處理,使其終濃度分別為10、20、40、80 nmol/L,其中以0 nmol/L設定為空白對照組,每組6個復孔。繼續(xù)培養(yǎng)24、48、72、96 h 后,每孔加入100 μL含10 μL的CCK8試劑的DMEM 培養(yǎng)液,孵育4 h,在酶標儀450 nm 波長處檢測細胞吸光度A值,并計算各組細胞增殖抑制率。增殖抑制率=[1-A(λ) 藥物處理組/A(λ)空白對照組]×100%。
2.3 ELISA法檢測A431細胞TNF-α和IL-1α的水平
將對數(shù)生長期的A431細胞接種到24孔培養(yǎng)皿中,每孔細胞為1×104個,于細胞培養(yǎng)箱中培養(yǎng)24 h,然后加入終濃度為10、20、40、80 nmol/L的苦參堿,以0 nmol/L設定為空白對照組,每組6個重復孔,繼續(xù)培養(yǎng)48 h后,收集細胞培養(yǎng)液上清,嚴格按照ELISA酶聯(lián)免疫吸附試劑盒操作說明書,測定細胞培養(yǎng)液上清TNF-α和IL-1α的水平。
2.4 real-time qPCR法檢測人皮膚鱗狀細胞癌A431細胞Bax和Bcl-2基因表達
將終濃度為10、20、40、80 nmol/L的苦參堿處理人皮膚鱗狀細胞癌A431細胞48 h后,PBS緩沖液沖洗5次后,按Trizol法提取細胞總RNA,RT-PCR法并合成cDNA。使用PCR儀檢測Bax和Bcl-2基因的表達水平。其引物序列分別為Bax:F-5′-CGAATTGGCGATGAACTGGA-3′,R-5′-CAAACATGT CAGCTGCCACAC-3′;Bcl-2:F-5′-GACTGAGTACCT GAACCGGCATC-3′,R-5′-CTGAGCAGCGTCTTCAGAG ACA-3′;GAPDH:F-5′-GCACAGTCAAGGCTGAGA ATG-3′,R-5′-ATGGTGGTGAAGACGCCAGTA-3′。
2.5 Western blot法檢測人皮膚鱗狀細胞癌A431細胞AKT蛋白表達
將終濃度為10、20、40、80 nmol/L的苦參堿處理人皮膚鱗狀細胞癌A431細胞48 h后,提取并檢測細胞總蛋白。按照每孔50 μg上樣,常規(guī)經(jīng)SDS-PAGE分離、轉膜、封閉后,加入AKT一抗4 ℃冰箱過夜。PBS洗膜5次,加HRP標記的二抗稀釋液,室溫孵育2 h,PBS洗膜5次,ECL試劑化學發(fā)光、顯影。Image J軟件對圖像進行灰度分析,以GAPDH為參照。目的蛋白表達水平=目的條帶灰度值/GAPDH條帶灰度值。
2.6 苦參堿與AKT對接驗證
從ProteinDatabase(https://www.rcsb.org/)數(shù)據(jù)庫AKT蛋白晶體結構,選擇其具有配體的蛋白復合物,以保證其對接的精度。然后分別于pubchem(https://pubchem.ncbi.nlm.nih.gov/)下載苦參堿的結構。AKT與苦參堿均使用AutodockTools 1.5.6轉化為PDBQT格式后采用Autodock vina 1.1.2進行分子對接。最后,選取Vina分值最低的構象用PyMOL 2.4進行作圖分析。
3 結果
3.1 苦參堿對人皮膚鱗狀細胞癌A431細胞增殖抑制率的影響
不同濃度(10、20、40、80 nmol/L)苦參堿,不同時間(24、48、72、96 h)作用于A431細胞后,其增殖抑制率隨著苦參堿濃度的升高和處理時間的延長而升高,呈濃度和時間依賴性,見圖1。

圖1 苦參堿對人皮膚鱗狀細胞癌A431細胞增殖抑制率的影響Figure 1 Effects of matrine on the proliferation inhibition rate of A431 cells
3.2 苦參堿對人皮膚鱗狀細胞癌A431細胞TNF-α和IL-1α水平的影響
與空白對照組比較,不同濃度苦參堿組的TNF-α和IL-1α水平明顯降低(P<0.05,或P<0.01),呈濃度依賴性,見圖2。

1.空白對照組; 2. 10 nmol/L苦參堿組; 3. 20 nmol/L苦參堿組; 4. 40 nmol/L苦參堿組; 5. 80 nmol/L苦參堿組;與空白對照組比較:*P<0.05,**P<0.01。
3.3 苦參堿對人皮膚鱗狀細胞癌A431細胞Bax和Bcl-2 mRNA表達的影響
與空白對照組比較,不同濃度苦參堿組BaxmRNA 表達顯著升高(P<0.05),而Bcl-2 mRNA表達量顯著降低(P<0.05),呈濃度依賴性,見表1。
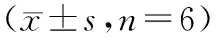
表1 苦參堿對人皮膚鱗狀細胞癌A431細胞Bax和Bcl-2 mRNA表達的影響Table 1 Effects of matrine on the expression of Bax and Bcl-2 mRNA in A431 cells
3.4 苦參堿對人皮膚鱗狀細胞癌A431細胞AKT蛋白表達的影響
與空白對照組比較,不同濃度苦參堿組AKT蛋白表達水平明顯降低(P<0.05) ,作用呈濃度依賴性,見圖3。
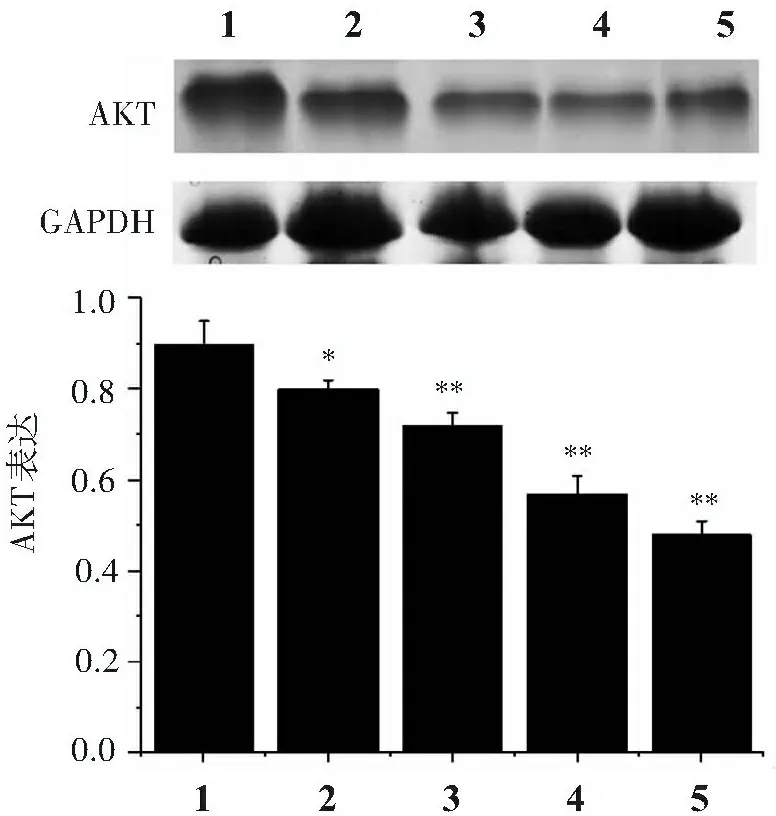
1.空白對照組; 2. 10 nmol/L苦參堿組; 3. 20 nmol/L苦參堿組; 4. 40 nmol/L苦參堿組; 5. 80 nmol/L苦參堿組; 與空白對照組比較:*P<0.05,**P<0.01。
3.5 苦參堿與AKT對接驗證
使用AutoDock Vina(1.1.2 版本)將苦參堿對接蛋白AKT的活性口袋,Vina 得分(Vina score)是用Vina 程序以相應的口袋參數(shù)對受體和配體進行分子對接所得到復合物的得分,分值越低則代表受體和配體親和力越高。對接結果顯示,苦參堿與AKT靶點親和力Vina 得分為-8.4 kcal/mol,結果可見,苦參堿與蛋白AKT具有較好的結合活性。見圖4。

A.苦參堿模式圖; B. AKT模式圖; C.苦參堿與AKT對接模式圖。
4 討論
SCC是由多種致病因素(如紫外線照射、皮膚感染、遺傳等) 共同作用所產(chǎn)生的一種惡性腫瘤[12]。其發(fā)病機制目前尚不十分明確,臨床治療上也無特效的治療措施,因此探索SCC的發(fā)生機制和尋找安全有效的治療藥物是目前亟待解決的問題。
惡性增殖與分化異常是腫瘤細胞的兩個基本生物學特征,其中抑制腫瘤細胞的惡性增殖是評價抗腫瘤藥物療效較為直接的觀察指標之一[13]。本研究發(fā)現(xiàn)苦參堿對人皮膚鱗狀細胞癌A431細胞的增殖具有明顯的抑制作用,在10~80 nmol/L濃度范圍內,隨著苦參堿濃度的升高和處理時間的延長,人皮膚鱗狀細胞癌A431細胞增殖抑制率也隨之升高,呈濃度和時間依賴性。TNF-α是一種由單核巨噬細胞產(chǎn)生的參與機體多種炎癥免疫過程的重要促炎癥因子。TNF-α與腫瘤發(fā)生發(fā)展密切相關,有研究表明[14]在腫瘤微環(huán)境中如TNF-α長期高濃度表達可導致腫瘤進一步惡化。IL-1α作為一種內源性熱源參與機體炎性過程,近年來研究發(fā)現(xiàn),IL-1α與腫瘤發(fā)生發(fā)展也密切相關,特別是在腫瘤的發(fā)生和轉移中具有重要生物學作用[15]。本研究發(fā)現(xiàn)苦參堿可明顯降低TNF-α和IL-1α的水平,提示苦參堿可通過抗炎途徑,降低促炎癥因子水平,從而抑制人皮膚鱗狀細胞癌A431細胞的增殖。
促凋亡基因Bax和抗凋亡基因Bcl-2是線粒體凋亡途徑過程中最為重要的調節(jié)因子[16]。Bax主要通過升高線粒體膜通透性和促進細胞色素C的釋放而起到誘導細胞凋亡作用,而Bcl-2主要通過減少線粒體細胞色素C的釋放而發(fā)揮抗細胞凋亡作用[17]。本研究發(fā)現(xiàn)苦參堿可顯著升高人皮膚鱗狀細胞癌A431細胞的BaxmRNA 的表達水平 (P<0.05),而顯著降低Bcl-2 mRNA的表達水平(P<0.05),且呈濃度依賴性,提示了苦參堿可能通過影響線粒體凋亡途徑,上調Bax基因表達,下調Bcl-2基因表達,從而激活Caspase-3的活性,最終引起人皮膚鱗狀細胞癌A431細胞的凋亡。
PI3K/AKT信號通路是近年來發(fā)現(xiàn)的一條關于細胞內與癌癥發(fā)生發(fā)展密切相關的重要信號途徑,其參與了癌癥細胞的增殖、存活、侵襲遷移、新生血管形成及抑制細胞凋亡等過程[18]。有研究表明,抑制PI3K/AKT信號通路可抑制垂體腺瘤細胞的增殖和侵襲能力[19]。越來越多的實驗研究證實[20],通過阻斷PI3K/AKT信號通路的傳導可能是治療人皮膚鱗狀細胞癌的有效手段之一。本研究發(fā)現(xiàn)苦參堿可以明顯降低人皮膚鱗狀細胞癌A431細胞的AKT蛋白表達水平,且呈濃度依賴性。此外,通過分子對接發(fā)現(xiàn)苦參堿對AKT具有較好的結合活性,綜上提示苦參堿可能通過抑制PI3K/AKT信號通路,從而促進人皮膚鱗狀細胞癌A431細胞的凋亡,本研究不足之處在于只探討了苦參堿對PI3K/AKT信號通路中的AKT蛋白表達的作用,是否對通路其他關鍵蛋白起調控作用以及可否同時作用于其他癌癥信號通路起協(xié)同作用,還需進一步的深入研究。
綜上所述,苦參堿具有抑制人皮膚鱗狀細胞癌A431細胞增殖和誘導凋亡作用,其作用機制可能與抑制PI3K/AKT信號通路的激活有關。

