毛細管電泳法測定復方氨基酸注射液的游離磷酸鹽
林東,劉玉萍
(廣州市藥品檢驗所,廣東 廣州 510160)
磷是人體不可缺少的元素之一,在腸外營養(yǎng)液中常常添加磷酸鹽作為補磷成分[1]。某些腸外營養(yǎng)液中的復方氨基酸注射液采用甘油磷酸鈉作為補磷的成分,但甘油磷酸鈉在工藝生產中,遇熱易分解產生少量的游離磷酸鹽。人體攝入過多游離磷酸鹽時,可與鈣結合成難溶于水的正磷酸鈣,使體內的鈣無法充分吸收、利用,容易引起骨折、牙齒脫落和骨骼變形,長期用藥可引起血磷升高、血鈣降低。因此,很有必要對游離磷酸鹽限度進行控制。目前,測定游離磷酸鹽的方法主要為分光光度法,操作較為繁瑣,且重現(xiàn)性比較差[2]。本文參考文獻[3]建立毛細管電泳檢測法對某市售腸外營養(yǎng)液中復方氨基酸注射液的磷酸鹽進行測定,結果顯示方法準確可靠,可為復方氨基酸注射液中游離磷酸鹽的含量測定提供參考。
1 儀器與試藥
7100型安捷倫毛細管電泳儀及熔融石英毛細管(75 μm×80 cm,有效長度70 cm)。
3批復方氨基酸注射液(編號:A1;A2;A3);Anion Analysis Kit試劑盒[Beck Am Coulter公司生產,批號:M809229,包括有NaOH溶液(Conditioner-Na)、沖洗液(Rinse Solution)、聚陽離子表面活性劑(Anion Coating)、嘧啶二甲酸緩沖液(Anion Separation Buffer,加速劑)、酸性沖洗液(Anion Acid Rinse)、內標液(枸櫞酸緩沖液)等試劑];KH2PO4(天津科密歐化學試劑有限公司,批號:20100318,105 ℃干燥至恒重);酶磷試液(Roche公司,批號:12917632);水為去離子水。
2 方法與結果
2.1 溶液配制
2.1.1 對照品溶液 取KH2PO4約0.1 g,精密稱定,置200 mL量瓶中,加去離子水溶解并稀釋至刻度,搖勻,得對照品儲備液。分別精密量取對照品儲備液1、3、5、8、10、12、15 mL,各置50 mL量瓶中,精密加入內標液0.5 mL,加去離子水溶解并稀釋至刻度,搖勻,作為系列對照品溶液①~⑦。
2.1.2 游離磷酸鹽供試品溶液 精密量取復方氨基酸注射液6 mL,置50 mL量瓶中,精密加入內標液(枸櫞酸緩沖液)0.5 mL,加去離子水溶解并稀釋至刻度,搖勻,作為游離磷酸鹽測定溶液。
2.1.3 酶解甘油磷酸鈉供試品溶液 參照進口注冊標準操作:精密量取復方氨基酸注射液400 μL,置10 mL量瓶中,精密加入磷酸酶試液[取磷酸酶溶液40 μL和緩沖溶液(稱取鹽酸三乙醇胺1.85 g、MgCl20.4 g、加水80 mL使溶解,用1 mol/L NaOH溶液調節(jié)pH至7.4,用水稀釋至100 mL,搖勻)]1 mL,搖勻,置37 ℃水浴中反應35 min,加入內標液0.1 mL,并用去離子水稀釋至刻度,搖勻,作為總磷酸鹽測定溶液。
2.2 毛細管電泳條件
以嘧啶二甲酸緩沖液為操作緩沖液,檢測波長為232 nm,帶寬4.0,參比波長為215 nm,帶寬10.0,毛細管溫度為20 ℃,分離電壓為30 kV,進樣端為負極,壓力進樣為3 447.3 Pa,進樣時間為14 s。每次進樣前,依次用NaOH溶液、沖洗液、聚陽離子表面活性劑、嘧啶二甲酸緩沖液(加速劑)沖洗毛細管柱180 s。每次進樣后,依次用NaOH溶液、酸性沖洗液、沖洗液沖洗毛細管柱100 s。
2.3 系統(tǒng)適用性試驗
取“2.1”項下的對照品溶液⑤10 mL、游離磷酸鹽供試品溶液和酶解甘油磷酸鈉供試品溶液進樣分析,結果顯示枸櫞酸根、磷酸根離子的分離度為14.5(見圖1),連續(xù)進樣5次,其峰面積與內標峰面積比值的相對標準偏差為1.7%。
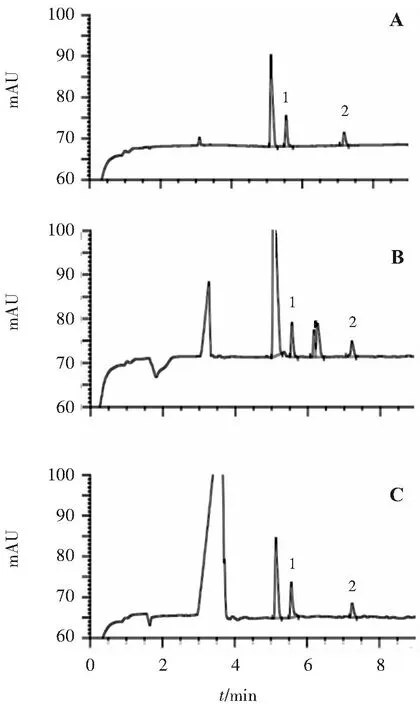
A.對照品溶液; B.游離磷酸鹽供試品溶液; C.酶解甘油磷酸鈉供試品溶液;1.磷酸根; 2.枸櫞酸根(內標)。
2.4 標準曲線的制備
取系列濃度對照品溶液①~⑦按“2.2”項電泳條件分別進樣,記錄電泳圖譜,以磷酸根(HPO32-)濃度為橫坐標、磷酸根與枸櫞酸根峰面積比值為縱坐標進行線性回歸,得回歸方程Y= 0.422 7x- 0.051 7,線性范圍為 0.079 1~1.186 6 mmol/L,r為0.995 0。
2.5 精密度試驗
取游離磷酸鹽供試品溶液(編號:A3)與酶解甘油磷酸鈉供試品溶液(編號:A3),分別重復進樣6次,測得的結果代入線性回歸方程計算磷酸根濃度,其RSD值分別為1.8%和2.0%。
2.6 加標回收率試驗
精密量取“2.1”項下的對照品溶液⑤(濃度為0.791 1 mmol/L)0.5 mL與游離磷酸鹽供試品溶液(編號:A1)0.5 mL,混勻,合并成1 mL的游離磷酸鹽供試品加標試樣,配制6份進樣,測得的結果代入線性回歸方程,計算加標回收率;精密量取“2.1”項下的對照品溶液⑤0.5 mL與酶解甘油磷酸鈉供試品溶液(編號:A3)0.5 mL,混勻,合并成1 mL的酶解甘油磷酸鈉供試品加標試樣,配制6份進樣,測得的結果代入線性回歸方程,計算加標回收率,結果見表1。可見,平均回收率分別為99.2%和100.0%,符合方法學要求。
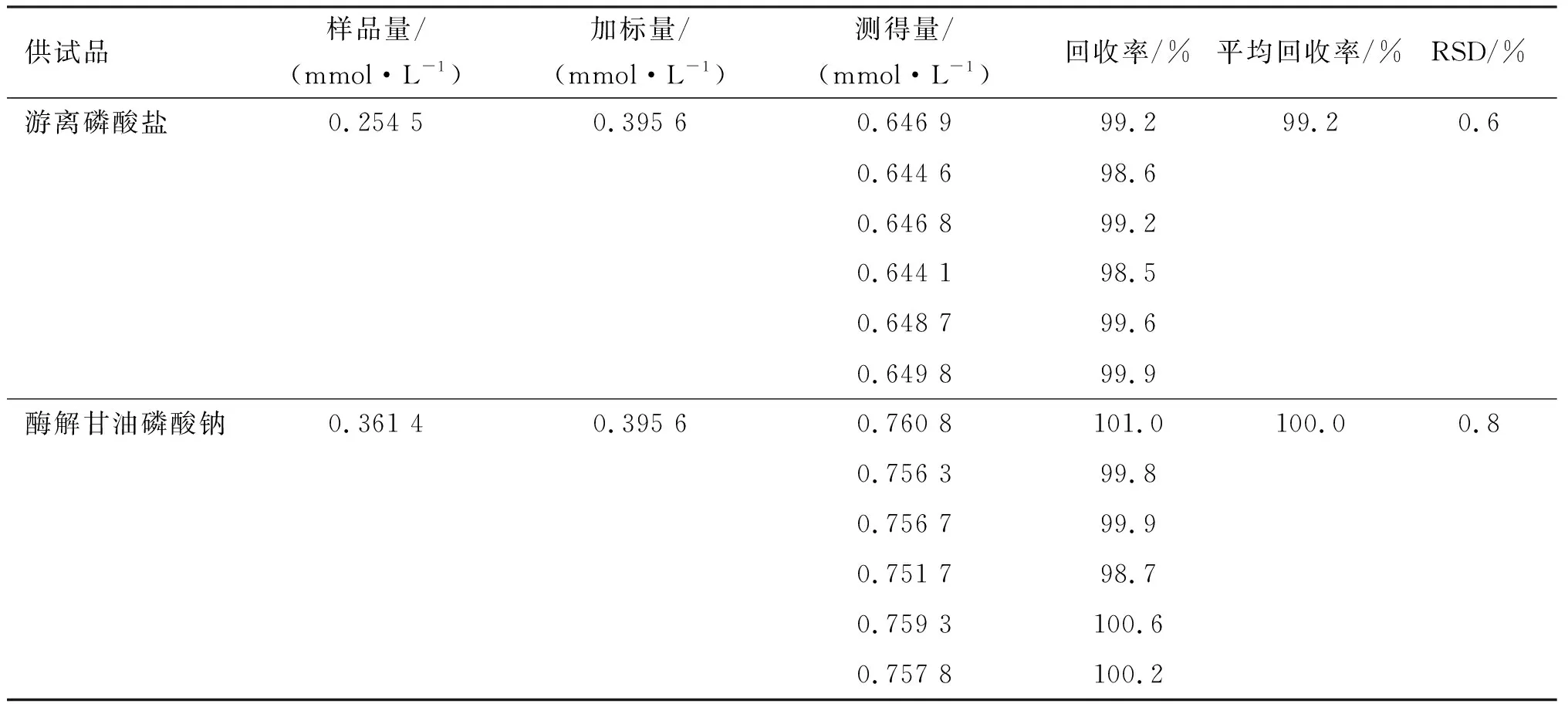
表1 加標回收率試驗結果Table 1 Results of fortified recovery
2.7 樣品測定
取按“2.1”項下方法配制的對照品溶液①~⑦、游離磷酸鹽供試品溶液和酶解磷酸鹽供試品溶液,分別進樣,采用內標法加標準曲線測定復方氨基酸注射液中的游離磷酸鹽和總磷酸鹽含量,結果見表2。

表2 供試品中磷酸鹽的測定結果Table 2 Determination Results of phosphate in test samples
3 討論
根據(jù)參考文獻[4],采用嘧啶二甲酸為間接紫外檢測試劑,磷酸鹽在232 nm無紫外吸收,而嘧啶二甲酸根離子通過檢測器時,出現(xiàn)較大的背景吸收,當無紫外吸收的待測離子通過檢測器時,由于降低背景吸收而出現(xiàn)負信號,達到檢測目的。但由于本試驗使用的是安捷倫7100型毛細電泳儀,無法通過儀器直接把負信號轉變?yōu)檎盘枺虼嗽趦x器中設定215 nm的參比波長,來實現(xiàn)正信號轉化。
參照文獻[3]方法,筆者適當延長進樣前后的沖洗時間,有效地提高了基線穩(wěn)定性及保留時間的遷移。另外,也需要注意儀器所在環(huán)境的濕度,過高易產生電流泄漏,同樣會對基線造成影響[5]。
以甘油磷酸鈉為補磷成分的復方氨基酸注射液,在進口注冊標準中主要對磷酸鹽有含量測定的要求,但并未對其游離磷酸鹽限度進行合理控制,由產品處方可知磷酸鹽的主要來源是甘油磷酸酸鈉。工藝生產過程中,甘油磷酸鈉受熱易分解成游離磷酸鹽,過量的磷酸鹽對人體造成危害。因此,如何控制甘油磷酸鈉制劑中的游離磷酸鹽比例,建議相關企業(yè)做進一步研究。
本方法相較于傳統(tǒng)的紫外分光光度法,操作上更為簡便、高效、消耗試劑少,可作為復方氨基酸注射液中游離磷酸鹽質量分數(shù)的測定方法,效率更高。

