奶牛糞便分離的伊氏李斯特菌伊氏亞種基因組序列測定及其分子特征分析
蔣華英,甘 霖,毛 盼,宋澤萱,紀順師,王怡倩,王 艷,徐保紅,高偉利,陳崢宏,葉長蕓
伊氏李斯特菌是一類革蘭陽性、兼性厭氧的胞內病原菌。對外界環境條件耐受能力強,可形成生物膜,在包括低溫、高鹽、較寬的p H范圍等環境條件下都能定植并繁殖[1-2],這種特性使伊氏李斯特菌通常可長期存在于各類環境中[3]。伊氏李斯特菌主要感染動物,特別是反芻類動物,可導致動物敗血癥、乳腺炎、腸炎、流產等[2,4-5]。近年來也常有伊氏李斯特菌引起人感染的報道[2,6-8]。伊氏李斯特菌引起的人李斯特菌病的報道較單增李斯特菌少,但伊氏李斯特菌在食品中的污染并不少見,人具有攝入伊氏李斯特菌污染食品而感染的風險[9-11]。由于動物與環境接觸較密切,感染伊氏李斯特菌的動物可通過糞便將伊氏李斯特菌排入周圍環境,作為市場肉類食品的來源,養殖畜禽類動物如果攜帶伊氏李斯特菌,會增加其污染(肉類)食品及奶制品的風險[12]。國外已有多起伊氏李斯特菌引起反芻類動物李斯特菌病暴發的報道[13-14],而我國反芻類動物中伊氏李斯特菌的存在情況尚不清楚。伊氏李斯特菌的毒力島LI PI-1與單增李斯特菌所共有,毒力島LIPI-2包括smc L基因及一組內化素蛋白基因。而smc L則為伊氏李斯特菌特有基因,編碼一種能破壞細胞膜的鞘磷脂酶C,其遺傳性相對不穩定。LIPI-2被認為可能在伊氏李斯特菌的致病性和宿主嗜性中起重要作用[15]。Yin Yue-lan等2019年從綿羊李斯特菌病暴發事件中分離到一種同時包含單增李斯特菌毒力基因和伊氏李斯特菌毒力基因的特殊菌株,其毒力強于單增李斯特菌,提示在同一環境中共存的不同種李斯特菌,其毒力基因可能存在一定的相關性[16]。
本研究首次從國內奶牛糞便中分離到伊氏李斯特菌,并對其進行了全基因組測序,并分析其遺傳特征,以及毒力基因、耐藥基因和前噬菌體基因等分子特征。
1 材料與方法
1.1 樣本采集 2019年7月在某奶牛場共采集196份奶牛糞便樣本。用無菌棉簽蘸取適量新鮮奶牛糞便,保存于含20%甘油的腦心營養液中,放置4℃保存,并及時送至實驗室進行細菌分離和鑒定。
1.2 樣本的分離和鑒定 奶牛糞便樣本根據ISO 11290方法進行李斯特菌的分離培養[17]。將20%甘油腦心培養液保存的糞便樣本充分混勻,取1 mL混合物加入10 mL Half Fraser增菌液中,放置于空氣搖床,30℃,220 r/min,孵育24 h;隨后,取1 mL Half Fraser增菌培養物轉移至5 mL Fraser增菌液中,放置于空氣搖床,37℃,220 r/min,孵育48 h。用接種環取4~5環的二次增菌液,接種至李斯特菌顯色固體培養基CM1080平板(Oxoid,Basingstoke,UK),將平板放置于恒溫箱,37℃培養36~48 h。從每個CM1080平板上各挑選5個疑似菌落,涂布于腦心浸液固體培養基進行純培養,采用基于李斯特菌屬和各個種的特異性引物進行PCR鑒定[18],引物由北京擎科測序公司合成,選擇伊氏李斯特菌參考菌株PA M55作為陽性對照。
1.3 核酸提取及測序 將本研究中奶牛糞便樣本分離的伊氏李斯特菌在腦心浸液固體培養基上純化后,用 Wizard○RGeno mic DNA Purification Kit提取核酸,由北京諾禾致源生物信息科技有限公司完成基因組測序。選用高通量Illu mina Hiseq PE150測序平臺進行測序及SOAP denovo(version 2.04)軟件進行組裝,伊氏李斯特菌PA M55為參考菌株。
1.4 基于核心基因的進化樹分析 將測序后的伊氏李斯特菌和NCBI中獲得的其他伊氏李斯特菌基因組序列進行比較,通過Mu Mer軟件將所選擇菌株基因組序列比較得到的SNP用MEGA 6.0軟件構建系統進化樹,算法采用Neighbor-joining法,bootstraps參數設置為1 000。其中,將NCBI上伊氏李斯特菌 PA M55、NCTC11846、WSLC3010、RR3、NCTC11007、WSLC3009、ICDC_Liv037、ICDC_Liv035、G_770及NCTC12701的全基因組序列作為對照進行比對分析,其中伊氏李斯特菌G_770分離自一名法國艾滋病患者,將其納入本研究與分離自奶牛糞便標本的伊氏李斯特菌一起比對分析。單增李斯特菌EGD-e作為外群參照菌株。
1.5 毒力基因 在兩個網站https://cge.cbs.dtu.dk/ser vices/Vir ulenceFinder/和htt p://www.mgc.ac.cn/VFs/main.ht m上進行了伊氏李斯特菌的毒力基因比對分析,參數設置為最少80%的長度和85%的同一性[19],以單增李斯特菌EGD-e為參考菌株。
1.6 耐藥基因和噬菌體基因 伊氏李斯特菌分離菌株基因組在耐藥基因數據庫(The Co mprehensive Antibiotic Resistance Database)中進行耐藥相關基因的比對分析,使用噬菌體數據庫網站(http://phaster.ca/)比對分析噬菌體基因。
1.7 CRISPR/Cas系統 CRISPR簇由一段不連續的同向重復序列和插入其中的間隔序列組成,與CRISPR相關基因cas基因構成CRISPR/Cas系統,是細菌的反入侵免疫系統。本研究采用CRISPRdigger軟件[20]對伊氏李斯特菌基因組進行CRISPR系統的檢測。
2 結 果
2.1 奶牛糞便樣本中伊氏李斯特菌的檢測結果196份奶牛糞便樣本中有9份樣本為李斯特菌陽性,經特異基因的PCR鑒定,3株為伊氏李斯特菌,6株為英諾克李斯特菌,分離率分別為1.53%和3.06%。參考曹曉龍等的分型方法[18],3株伊氏李斯特菌的MLST分析結果均為ST1型。
2.2 伊氏李斯特菌基因組基本特征及基于核心基因組的系統發育樹分析 3株伊氏李斯特菌分離株的Scaffol d數為15~17個。基因組長度、G+C含量及總編碼基因數分別為2.87~2.90 Mbp、36.97%~37.00%及2 894~2 923個。總RNAs為87~96個。16S r DNA基因序列分析確定為伊氏李斯特菌伊氏亞種。
奶牛糞便樣本分離的3株伊氏李斯特菌與參考菌株PA M55(羊來源)的ST型相同(ST1),采用基于核心基因組的SNPs分析構建了3株伊氏李斯特菌與PA M55及NCBI數據庫中部分伊氏李斯特菌菌株基因組序列的系統發育樹(圖1)。系統發育分析顯示,3株伊氏李斯特菌分離株與PA M55(羊)及G_770(病人)同屬于一個分支。基于核心基因的SNPs分析發現奶牛糞便樣本分離的3株伊氏李斯特菌間無SNPs差別。
2.3 毒力基因 3株伊氏李斯特菌分離株與G_770菌株的毒力島LIPI-1及LIPI-2基因均陽性,其他絕大部分致病性李斯特菌毒力相關基因也為陽性,但3株伊氏李斯特菌分離株的免疫調節基因inl K、int A,侵襲相關基因aut、vi p缺失,G_770免疫調節基因int A,侵襲相關基因aut、vip缺失,inl K基因存在(圖2)。毒力相關基因主要包括粘附基因(f bp A、ami、inl F、Lap)、定植基因(op p A、cl pc、cl p P、f ri、htr A、per R、prs A 2、p yc A、rel A、sod、tig)、侵襲 基 因 (aut、iap、gtc A、inl A、inl B、inl P、l pe A、vi p)、溶細胞膜基因(hl y、smc L)及毒力調控關聯基因(cheY、lis K、pr f A、vir R)等。
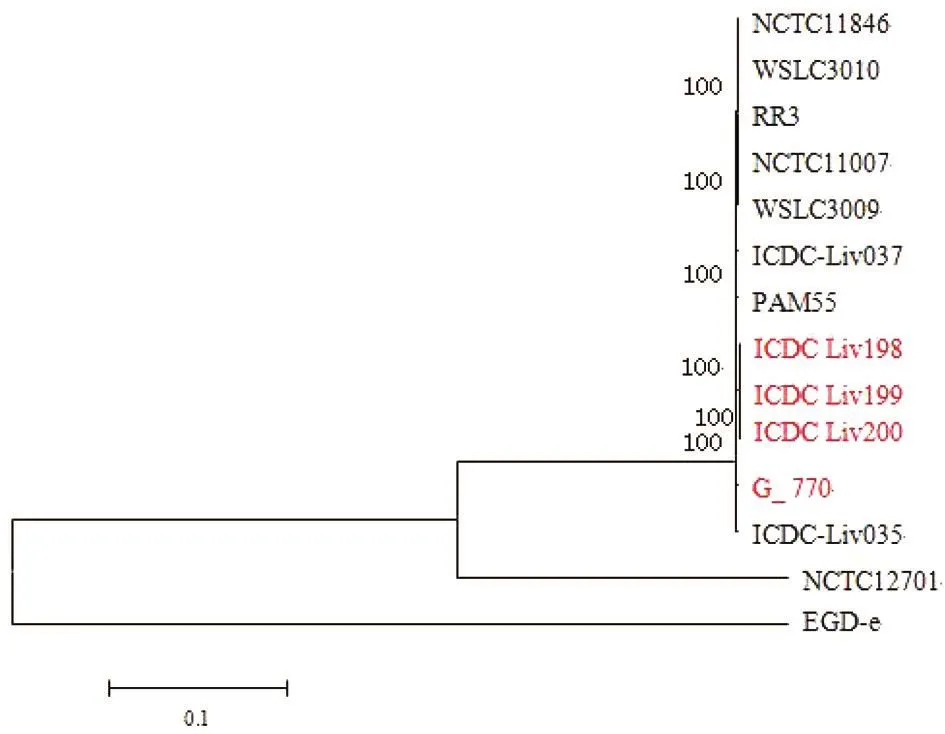
圖1 伊氏李斯特菌基于核心基因組SNPs的系統進化分析Fig.1 Phylogenetic relationship of Listeria ivanovii strains based on SNPs of core genes
2.4 耐藥基因和前噬菌體基因 通過與耐藥基因庫(The Co mprehensive Antibiotic Resistance Database)比對,3株伊氏李斯特菌均含22個抗性相關基因 (ileS、cls、al a S、l mr D、mur A、ef r A、l mr C、r po B、EF-Tu、mpr F、Tae A、arl R、r ph B、mf d、gyr A、mec C、mec B、mec A、tet 42、nor B、l mr P、l mr B),其中Identity>80%的耐藥相關基因為達托霉素抗性基因mpr F、NO還原酶基因nor B。G_770菌株除此之外還包含van Z等基因。
通過噬菌體網站(http://phaster.ca/)比對Liv198、Liv199以及Liv200菌株分別含有一個長度分別為25.5 kb、27.5 kb和25.5 kb的不完整前噬菌體(命名為Prophage_1),GC含量分別為36.4%、36.5%和36.4%,各有16個編碼基因。前噬菌體上有結合膽汁酸水解酶基因、銅抗性基因等。而G_770菌株包含與之類似的前噬菌體基因,長度為25.6 kb,GC含量為36.4%,包含16個編碼基因。
2.5 CRISPR位點 3株伊氏李斯特菌基因組各包含一個CRISPR位點,其單元重復序列為TTTACATTTCATAATAAGTAATTAAAACC,在 Liv 198菌株中該單元重復序列重復11次,有10個間隔區,在Liv199和Liv200菌株中該重復序列重復13次,有12個間隔區。下游基因依次編碼CRISPR相關蛋白Cas2,I-B型CRISPR相關內切酶Cas1,CRISPR相關蛋白Cas4,CRISPR相關解旋酶/核酸內切酶Cas3,I-B型CRISPR相關蛋白Cas5,I-B型CRISPR相關蛋白Cas7/Cst2/Dev R,I-B型CRISPR相關蛋白Cas8b1/Cst1,CRISPR相關核糖核酸內切酶Cas6。以上基因元件共同構成I-B型CRISPR/Cas系統。G_770伊氏李斯特菌也包含一個I-B型CRISPR/Cas系統,其單元重復序列為GTTTTAATTACTTATTATGAAATGTAAAT,該單元重復序列重復10次,有9個間隔區。Liv198菌株的CRISPR/Cas系統結構見圖3。
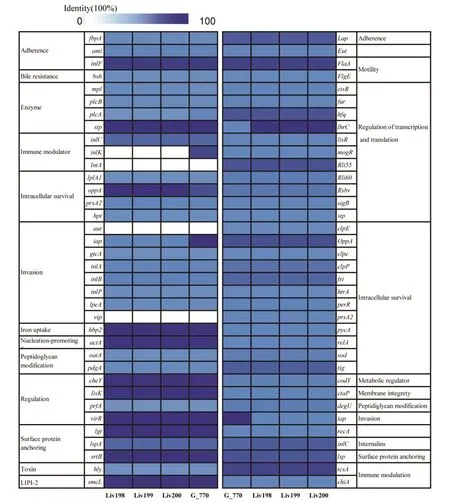
圖2 伊氏李斯特菌分離株的毒力相關基因Fig.2 Vir ulence-related genes of Listeria ivanovii str ains
3 討 論
本研究對養殖場采集的196份奶牛糞便樣本進行了李斯特菌的檢測,其中伊氏李斯特菌的分離率為1.53%,英諾克李斯特菌為3.06%,國外研究發現動物類養殖場中的飼料、環境及動物相關產品如原奶中伊氏李斯特菌的攜帶情況較多,攜帶率約9.2%~25%[21-22],動物糞便中伊氏李斯特菌分離很少[23],但常有由伊氏李斯特菌引起反芻類動物李斯特菌病暴發的報道[13]。伊氏李斯特菌可存在于土壤、水、飼料及養殖環境中,且伊氏李斯特菌有明顯的生態偏好,在反芻類動物養殖場周圍環境中更常見,為養殖場動物感染的重要來源[11,21,24]。伊氏李斯特菌耐酸、耐鹽、耐低溫,對消毒劑等有一定抵抗力,生存力較強,從源頭、加工環境、運輸、儲存、銷售市場再到消費者家冰箱等各個環節中可以定殖甚至持續存在[3],任一環節出現伊氏李斯特菌污染都可能造成整條食品鏈的污染。Catherine M等在澳大利亞維多利亞州的7個牧場的牛奶和環境里分離出伊氏李斯特菌,分離率約為3.3%[11]。

圖3 Liv198 CRISPR/Cas系統結構示意圖Fig.3 CRISPR/Cas systemidentified in Liv198 strain
伊氏李斯特菌污染不僅影響食品質量,對人還有潛在致病性。1992年Cu mmins AJ等首次從英國一名艾滋病患者的血液樣本中分離出伊氏李斯特菌,該患者表現為腹瀉、發熱和明顯的神經系統癥狀,確診后經阿莫西林治療2周后好轉[25]。1994年Lessing MP等從英國另一名26歲的青年艾滋病患者的血液中分離出伊氏李斯特菌[26];2007年Guillet C等從法國一名腎移植患者的血液和糞便中均分離出伊氏李斯特菌,該患者臨床癥狀表現為腹瀉、嘔吐、脫水和低熱等[6]。2014年Beye M報告了一例由伊氏李斯特菌G_770引起的艾滋病患者死亡的案例[27]。國內李華信等也報道了血和骨髓同時感染伊氏李斯特菌和類志賀鄰單胞菌的案例[7]。因此,伊氏李斯特菌對免疫低下的人群有潛在致病風險。Dahshan H等在埃及某一禽類養殖場的雞飼料、水、雞肉、養殖場垃圾中首次檢測出伊氏李斯特菌,檢出率為10%~25%,發現養殖場存在交叉污染現象[22]。由于伊氏李斯特菌可引起動物尤其是反芻類動物的流產、乳腺炎以及李斯特菌病暴發[14,28],除了帶來重大經濟損失外,還可能通過動物接觸及污染食品感染人發生李斯特菌病,因此,對動物中伊氏李斯特菌的監測具有重要的公共衛生意義。
本研究中分離的3株伊氏李斯特菌經MLST鑒定為ST1型,與臨床病人分離菌株G_770、病羊中分離的PAM55菌株及曹曉龍等從云南的野鼠中分離的伊氏李斯特菌型別一致,在國外研究的樣本中也有相同型別[29]。ST1型為中國多個地區的動物來源伊氏李斯特菌的優勢型別,甘霖等通過細胞及動物實驗證實ST1型別為高毒力菌株,對人和動物有潛在致病風險[30]。基于核心基因組的SNPs的系統進化分析顯示,本研究分離的伊氏李斯特菌與國外分離的PA M5菌株(羊來源)以及G_770(病人來源)同屬于一個分支。Liv198和Liv199菌株分離自養殖場同一飼養欄內不同區域的奶牛糞便樣本,Liv200分離自另一飼養欄牛群糞便樣本,3株菌的核心基因組無SNP差別,提示可能為同一克隆菌株來源。
毒力相關基因分析顯示,3株伊氏李斯特菌分離株均攜帶了毒力島LIPI-1、LIPI-2,并且粘附、侵襲、定殖能力、動力及毒力基因調節相關的基因均為陽性,提示這3株菌均有致病性。免疫調節基因inl K、int A和侵襲相關基因aut、vip在這3株菌中缺失,但與其功能相似的其他免疫調節基因(inl C、tcs A等)、侵襲相關基因(iap、gtc A、inl A、inl B、inl P、l pe A等)完整,這些基因變化對于3株伊氏李斯特菌的毒力是否有影響還需進一步研究證實。病人來源的伊氏李斯特菌G_770菌株的毒力基因存在情況與3株伊氏李斯特菌分離株相同,但其免疫調節基因inl K陽性,G_770與奶牛分離菌株間是否具有毒力差異還需進一步研究證實。伊氏李斯特菌可以粘附和侵襲人類胎盤羊膜細胞,裂解吞噬泡,聚合宿主細胞肌動蛋白,并且比單增李斯特菌的細胞間擴散能力更強,雖然伊氏李斯特菌在細胞內的存活率低于單增李斯特菌,但對于免疫力低下或缺陷的人來說仍具有潛在感染風險[8,25-26]。
本研究發現3株伊氏李斯特菌分離株攜帶20個抗性相關基因,但其中Identity>80%的僅有達托霉素抗性基因mpr F、NO還原酶基因nor B。病人來源的伊氏李斯特菌G_770菌株耐藥相關基因的攜帶情況也相似,但其還攜帶了van Z基因。G_770菌株攜帶的van Z是Tn1546轉座子的一部分[31],該轉座子的存在賦予糞腸球菌對糖肽的抗性。在沒有Tn1546轉座子其他成分的情況下,VanZ賦予了糞腸球菌對替考拉寧(而非萬古霉素)低水平的抗性[32]。目前尚未見人和動物來源李斯特菌株對萬古霉素耐藥的報道[33]。
前噬菌體是一種整合在宿主基因組上的溫和噬菌體,插入染色體特定部位,與細菌染色體的復制聯系緊密。本研究分離的伊氏李斯特菌和G_770菌株的前噬菌體為不完整噬菌體Prophage1,其以非常保守的形式存在于本研究菌株及PA M55等伊氏李斯特菌伊氏亞種中。Prophage1含有結合膽汁酸水解酶基因、銅抗性基因等[34],這些功能對伊氏李斯特菌的生存能力有關。通常認為伊氏李斯特菌中的伊氏亞種對噬菌體敏感,而倫氏亞種相對耐噬菌體感染[35]。
CRISPR/Cas系統被認為是細菌的重要免疫防線之一,利用小干擾CRISPR RNA(cr RNAs)和靶核酸之間的堿基互補來識別和降解外源遺傳元件。CRISPR/Cas包括由不連續的高度保守的重復序列和具有多樣性的間隔序列組成的CRISPR位點及位于CRISPR位點附近的cas基因,cas基因編碼Cas蛋白 Cas1、Cas2、Cas4,干擾蛋白 Cas3、Cas5、Cas7,以及亞型特異性蛋白Cas8b和Cas6b。G_770與本研究的伊氏李斯特菌存在I-B型CRISPR/Cas系統,可以認為具有抵抗外來入侵元件的能力。
本研究發現國內養殖場奶牛可攜帶伊氏李斯特菌。通過基因組、毒力基因、耐藥基因、噬菌體基因及CRISPR/Cas系統等遺傳特征的分析,發現奶牛分離菌株與國外病人分離株在遺傳關系及菌株分子特征上具有很高的相似度。伊氏李斯特菌可通過糞便途徑污染環境造成動物間的交叉傳播。食品加工過程處理不當,人體可能通過攝入伊氏李斯特菌污染的牛奶或牛肉制品而感染,發生李斯特菌病。因此,應重視伊氏李斯特菌潛在的致病風險,加強病原學監測,預防由其所致的人李斯特菌病。

