慢性炎性脫髓鞘性多發神經根神經病和多灶性運動神經病臨床對比分析
陳雪婷 鄭惠文 張 琪 劉 潔 張作慧 劉永海
徐州醫科大學附屬醫院,江蘇 徐州 221004
慢性炎性脫髓鞘性多發神經根神經病(chronic inflammatory demyelinating polyneuropathy,CIDP)和多灶性運動神經病(multifocal motor neuropathy,MMN)是最常見的免疫介導的慢性周圍神經病。CIDP是一組免疫介導的慢性致殘性運動感覺神經炎性脫髓鞘疾病[1],在世界范圍內較少見,發病率為(1~8.9)/10萬[2]。此病呈慢性進展或復發性病程,臨床表現為對稱性肢體遠端或近端無力,大多自遠端向近端進展,多數伴感覺障礙、腱反射減弱或消失,部分患者可有自主神經功能障礙和腦神經麻痹表現;腦脊液蛋白-細胞分離現象是其特征性表現;神經活檢可見有髓神經纖維節段性脫髓鞘、軸索變性、施萬細胞增生并形成洋蔥頭樣結構、單核細胞浸潤等表現。治療首選糖皮質激素和靜脈注射丙種球蛋白(IVIG),若二者均無效,可考慮血漿置換[3]。MMN是一種僅累及運動神經的多發單神經病變,之前被歸為部分變異型CIDP。1988年PESTRONK等[4]描述了5例神經電生理表現為多灶性運動神經傳導阻滯的病例,并首先將其命名為MMN。該病較為罕見,發病率約為0.3/10萬,男女比例約為2.7∶1,多數于50歲之前發病,但兒童期發病者少見。該病早期上肢受累多見,臨床表現為緩慢進展的非對稱性的以遠端為主的肌無力和肌萎縮,感覺神經多不受累,運動神經傳導阻滯是其電生理特征;部分患者血清抗神經節苷脂GM1抗體滴度升高,丙種球蛋白治療有效[5]。CIDP和MMN臨床表現和疾病演變過程基本一致,早期兩者臨床表現和肌電圖特征往往不典型,極易誤診和漏診,加之二者治療方法不盡相同,因此早期確診、及早應用正確的治療方法是減少致殘率和病死率的關鍵。
目前關于CIDP和MMN臨床表現及肌電圖特征的對比研究較少,且多以病例報告的形式呈現,缺乏系統研究。本研究擬對CIDP和MMN的臨床表現及肌電圖特點進行對比分析,為早期疾病診療提供可靠的數據參考,提高臨床對這兩種疾病的認識,以減少漏診和誤診。
1 資料與方法
1.1研究對象收集徐州醫科大學附屬醫院神經內科2015-01—2020-01收治的MMN患者8例,以及與之性別、年齡相匹配的CIDP患者17例,招募了20名健康志愿者作對照。CIDP組男10例,女7例,年齡25~82(56.22±14.02)歲;MMN組男5例,女3例,年齡31~78(56.97±13.22)歲。2組患者一般資料比較差異無統計學意義(P>0.05),具有可比性。
1.1.1 納入標準:①CIDP組患者的診斷參照2010年歐洲神經病學聯盟(EFNS)及國際周圍神經病學會(PNS)指南的診斷標準[6]。NNM組患者的診斷參照EFNS和PNS對MMN的診斷標準[7];②臨床資料完整;③接受肌電圖檢查。
1.1.2 排除標準:①有其他引起周圍神經病的相關病史,如糖尿病、乙醇性周圍神經病;②存在神經肌肉接頭病變、神經前角病變或肌肉病變;③輔助檢查不完善。
1.2研究方法
1.2.1 臨床資料:收集患者的相關臨床資料,包括起病形式、癥狀、體征及分布情況、腦脊液蛋白水平等。
1.2.2 神經電生理檢查:電生理主要是常規的神經傳導檢測。運動神經測定:測定4條運動神經,包括正中神經、尺神經、脛神經、腓總神經;測定參數包括遠端復合肌肉動作電位(dCMAP)波幅、運動神經傳導速度(MNCV)、遠端潛伏期(DL),其中CMAP波幅采用峰-峰值波幅,DL為從刺激開始至CMAP起始點之間的時間。感覺神經測定:測定3條感覺神經,包括正中神經、尺神經、腓腸神經;采集感覺神經動作電位波幅(SNAP)、感覺神經傳導速度(SNCV),其中SNAP波幅采用峰-峰值波幅。F波:測定正中神經、尺神經、脛神經、腓總神經F波,記錄其出現頻率和平均潛伏期。
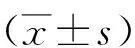
2 結果
2.1臨床特征CIDP組和MMN組對比發現,MMN組多為不對稱上肢起病,CIDP組則以對稱性雙下肢或四肢起病為主。CIDP組和MMN組所有患者均有肢體遠端受累表現,CIDP組患者有58.8%累及近端,而MMN組僅有12.5%累及近端,2組比較差異有統計學意義(P<0.05)。CIDP組4例(23.5%)有腦神經受累表現,其中3例為面神經麻痹,1例為舌咽、迷走神經麻痹,而MMN組患者均未發現累及腦神經,2組比較差異無統計學意義(P>0.05)。CIDP組患者均有感覺障礙,表現為肢體麻木或疼痛,且均有腱反射減弱,15例出現對稱性肌無力癥狀,遠端較近端重,未發現肌肉萎縮患者。MMN組僅1例有感覺障礙,表現為肢體麻木,所有患者均出現肢體無力癥狀,半數患者腱反射減弱,6例(75%)出現肌肉萎縮。CIDP組患者感覺障礙、腱反射減弱比例明顯高于MMN組,肌萎縮比例低于MMN組,差異有統計學意義(P<0.05)。見表1。
2.2輔助檢查結果
2.2.1 腦脊液:CIDP組患者接受腰穿檢查,17例(100%)患者腦脊液蛋白水平均升高,達(1.04±0.68)g/L;MMN組7例接受腰穿檢查,其中1例腦脊液蛋白水平升高,達(0.36±0.12)g/L;CIDP組腦脊液蛋白水平明顯高于MMN組,差異有統計學意義(P<0.001)。
2.2.2 神經電生理:dCMAP波幅在CIDP組和MMN組均有減低;兩兩比較,MMN組dCMAP波幅在正中神經、尺神經低于CIDP組,在腓總神經高于CIDP組,差異有統計學意義(P<0.05)。與正常對照組相比,CIDP組dCMAP波幅在正中神經、尺神經、腓總神經、脛神經均明顯減低,而MMN組與正常對照組相比僅在正中神經、尺神經明顯減低,而在腓總神經和脛神經,兩者相比差異無統計學意義(P>0.05)。CIDP組在正中神經、腓總神經、脛神經的MCV低于MMN組,差異有統計學意義(P<0.05)。與正常對照組相比,CIDP組所研究的四條運動神經中MCV均明顯減慢。MMN組與正常對照組相比,在正中神經、尺神經、腓總神經MCV減慢。CIDP組在尺神經、脛神經、腓總神經較MMN組明顯延長,在正中神經、尺神經、腓總神經、脛神經較正常對照組明顯延長,差異有統計學意義(P<0.05);而與正常對照組相比,MMN組在所研究的四條運動神經中未發現DL延長的現象。如表2、圖1A~C所示。<
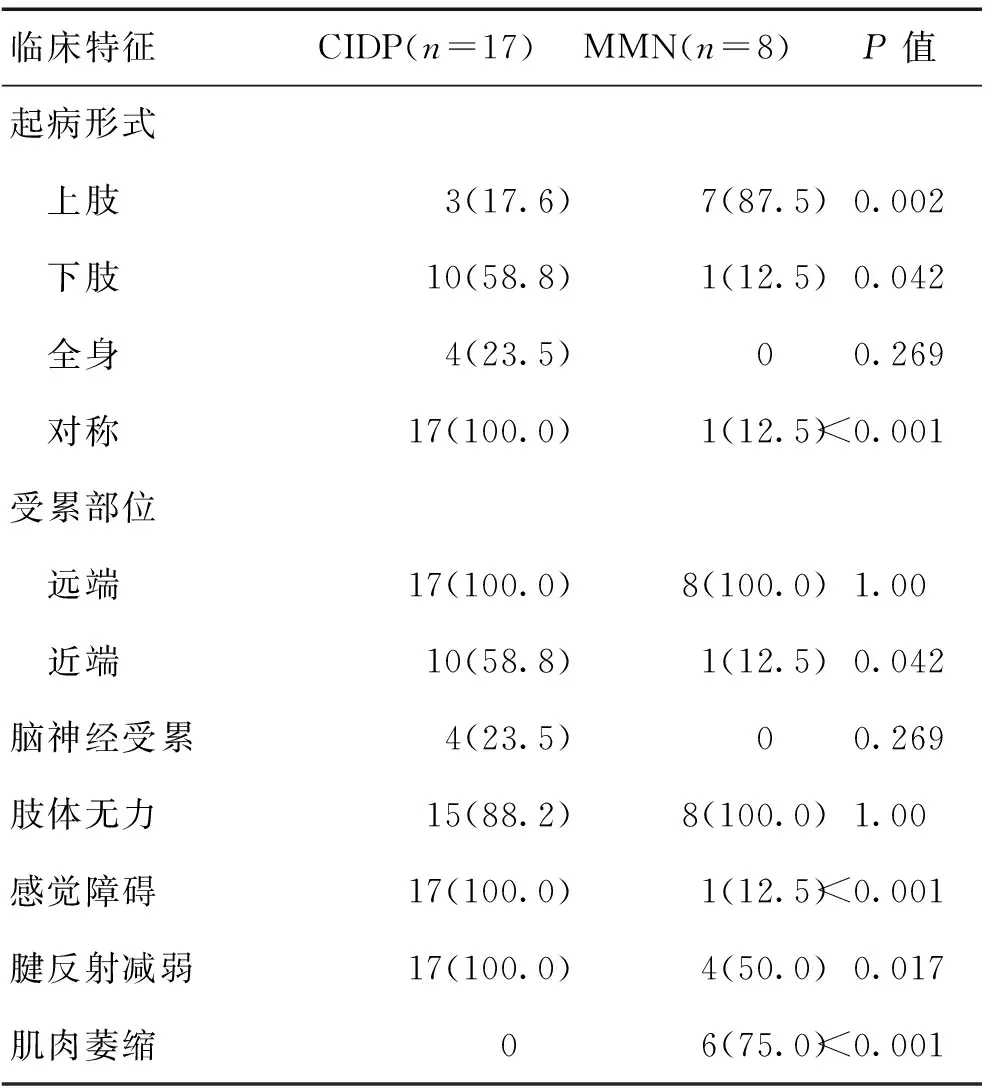
表1 CIDP和MMN臨床特征比較 [n(%)]Table 1 Comparison of clinical characteristics betweenCIDP and MMN [n(%)]
/p>
CIDP組與正常對照組相比,F波潛伏期在正中神經、尺神經、腓總神經、脛神經中均延長,差異有統計學意義(P<0.05);與MMN組相比,在以上四條神經中也有F波潛伏期延長的表現,差異均有統計學意義(P<0.05)。而MMN組與正常對照組比較,僅在腓總神經F波潛伏期延長。如表2、圖1D所示。
在感覺神經中,CIDP組SNAP和SCV均顯著低于正常對照組和MMN組,差異有統計學意義(P<0.05),而MMN組與正常對照組相比差異無統計學意義(P>0.05)。如表2、圖1E、F所示。
MMN患者表現為多灶性非對稱的傳導阻滯,上肢顯著高于下肢;此外,MMN組上下肢傳導阻滯比例均高于CIDP組,差異有統計學意義(P<0.05)。如表2、圖1所示。
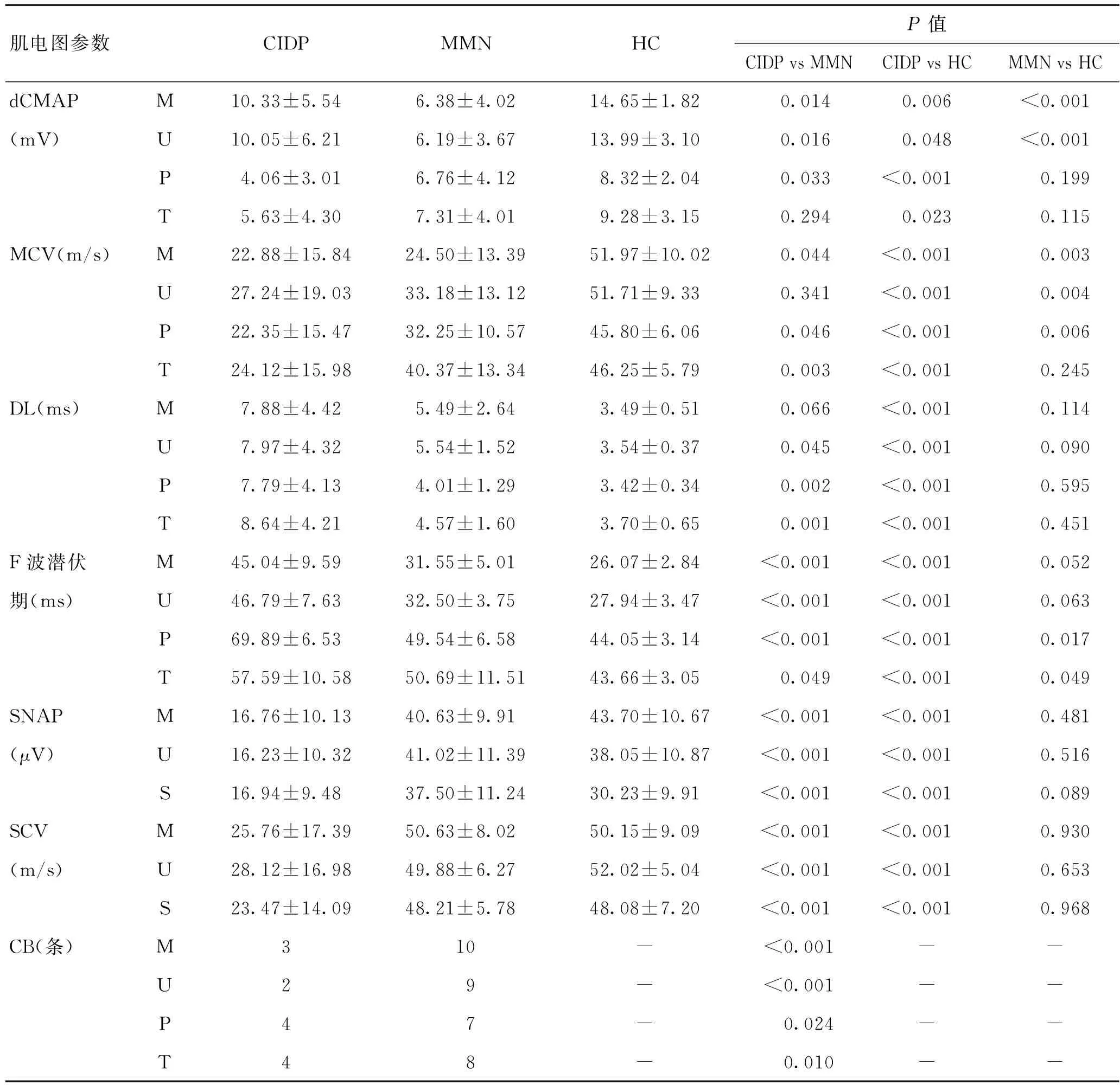
表2 CIDP、MMN和HC神經電生理指標比較Table 2 Comparison of Neuroelectrophysiological indexes among CIDP,MMN and HC
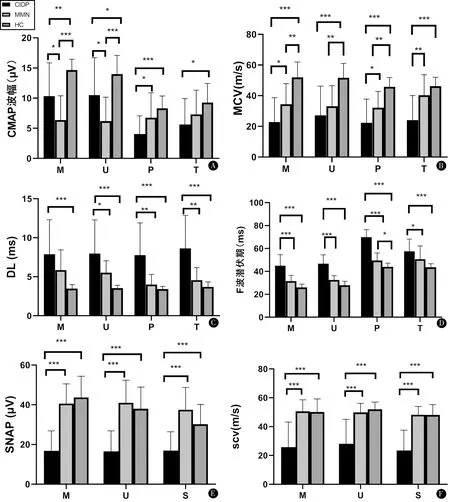
注:CIDP組黑色條,MMN組淺灰色條,健康對照組(HC)深灰色條;M:正中神經;U:尺神經;P:腓總神經;T:脛神經,S:腓腸神經;*P<0.05,**P<0.01,***P<0.001圖1 A~C:CIDP組、MMN組和HC組運動神經研究結果;D~F:CIDP組、MMN組和HC組F波和感覺神經研究結果Figure 1 A-C:Motor nerve conduction study results in the CIDP,MMN and HC;D-F:F-wave and sensory nerve conduction study results in the CIDP、MMN and HC
3 討論
本次研究對比分析了17例CIDP患者和8例MMN患者,兩者臨床表現類似但不完全相同。CIDP患者病變彌漫且對稱,癥狀多表現為四肢或雙下肢遠端麻木或無力,病變多從遠端向近端進展,腱反射減弱,腦脊液蛋白明顯升高。MMN多累及運動神經的多數單神經,往往以上肢起病,癥狀多表現為肢體力和不同程度的肌萎縮,無感覺受累,腱反射可正常,腦脊液蛋白多正常或輕度升高。文獻[8]報道部分MMN患者雖無主觀感覺障礙,但肌電圖或神經活檢可發現感覺神經受損。除是否存在感覺障礙外,本研究中也發現了其他能將CIDP和MMN區分開來的特征,如CIDP可累及腦神經,本研究中共有23.5%的CIDP患者伴腦神經受累,其中3例為面神經麻痹,表現為單側或雙側周圍性面癱,1例為舌咽、迷走神經麻痹,表現為飲水嗆咳和咽反射消失。既往研究顯示約20%的CIDP患者有腦神經受累[9-11],與本研究相似;本研究中MMN患者未發現累及腦神經,既往研究也未見報道。
早期CIDP和MMN患者臨床表現往往不典型,極易誤診,神經電生理檢查對二者的診斷和鑒別診斷具有重要意義。在疾病早期,為了提高診斷率,至少要對4條運動神經和3條感覺神經進行檢查[12]。本研究對CIDP組17例患者112條神經和MMN組8例患者53條神經進行了神經電生理檢查。既往研究表明,在運動神經傳導方面,脫髓鞘型主要表現為MCV減慢、DL延長、F波潛伏期延長或消失,而CMAP相對正常;而軸索型主要表現為CMAP波幅下降,而DL、MCV、相對正常[13]。本研究顯示CIDP和MMN均有脫髓鞘改變,但CIDP組MCV減慢和DL延長程度更重,說明CIDP組較MMN組脫髓鞘程度更為嚴重;此外,CIDP組MCV減慢和DL延長累及多個神經,說明CIDP組病變更為彌散。CMAP是神經所支配肌肉所有運動單位興奮后的復合動作電位,其波幅大小反映了去極化的肌纖維數量,間接反映功能性運動單位的數目[14]。2組患者均有CMAP波幅減低,在上肢神經中MMN組CMAP波幅的減低較CIDP組顯著,而在下肢神經中CIDP組CMAP波幅的減低較MMN組顯著,說明2組患者的運動神經均有繼發性軸索損害,MMN組主要累及上肢,CIDP組四肢均受累,這與2組患者的起病形式和受累部位相吻合,也與之前報道CIDP和MMN是以脫髓鞘為主、伴繼發性軸索損害的周圍神經病一致[15-16]。在感覺神經傳導方面,CIDP組存在明顯的SNAP波幅下降和SCV的減慢,而MMN組SNAP和SCV則相對保留,說明CIDP常累及感覺神經,而MMN則無感覺神經受累,這在2組患者的臨床表現上也得到印證。因此,感覺神經電生理檢查也是區分這兩種疾病的特征之一。但也有報道部分MMN患者在隨訪期間可發現SNAP波幅減低,且其減低與殘疾程度之間有明顯相關性,這一結論尚需擴大樣本量并開展系列肌電圖檢查加以印證[8]。
傳導阻滯(CB)是MMN患者標志性的神經電生理表現[17],它是指近端比遠端刺激引出的CMAP波幅降低或面積減少,且不伴或僅伴有局灶性的異常時間離散[18]。研究報道CIDP患者CB是由于彌漫且嚴重的脫髓鞘改變引起[19];而MMN患者CB的病變基礎為Ranvier節點處傳導受損,部分患者可發現抗GM1抗體陽性,它可與運動神經的GM1結合,導致軸膜上的鈉離子通道重構和軸突損害,進而形成CB[16],因此二者引起CB的機制有所不同。本研究中MMN組8例患者均出現CB,比例明顯高于CIDP組。文獻報道有典型MMN臨床表現的患者神經電生理檢查未發現CB,其原因可能與運動神經受累部位不同有關,周圍神經遠端受累可導致dCMAP減低,影響CB檢測,而常規神經電生理檢查技術無法檢測到近端CB[20]。鑒于常規檢查方法對檢測CB的陽性率不高,近年來有學者提出三重刺激、經皮頸根刺激及經顱磁刺激等技術可能有助于提高陽性率[21],但這些技術并未得到廣泛的臨床應用。
本研究存在一定局限性:CIDP和MMN的病程是一個動態的過程,其電生理特點會隨著病程發生改變,其電生理特點與病程、病情嚴重程度及預后的關系尚需進一步研究。因此,在今后的工作中需要開展系列的神經電生理檢查,力求在減少誤診和預后評估方面為臨床提供可靠的數據參考。

