阿托伐他汀預處理對大鼠腦缺血再灌注損傷的保護作用及炎癥機制
楊曉煒 劉鳳海 崔新宇 石文秀 王錦濤 姚立巖
牡丹江醫學院公共衛生學院,黑龍江 牡丹江 157011
隨著老齡化社會的到來,缺血性腦卒中的發病率呈上升趨勢,嚴重威脅著老年人的健康[1]。因而,缺血性腦卒中的治療一直是醫學領域研究的熱點。通常情況下,當缺血性腦卒中發生時,為了盡快緩解腦缺血缺氧條件下引發的神經細胞腫脹、壞死,原則上應盡快恢復大腦供血。然而有研究證實,在快速恢復大腦供血后,組織、器官的損害有時并未得到好轉反而可能出現進一步惡化,該現象被稱為腦缺血再灌注(cerebral ischemia reperfusion CIR)損傷[2-3]。對其機制分析發現,過度的炎癥反應在腦缺血再灌注損傷過程中起到至關重要的作用。因而,探明腦缺血再灌注損傷的炎癥機制拮抗炎癥反應對于治療缺血性腦卒中十分關鍵[4]。
引起神經系統炎癥放大的關鍵因素是腦內小膠質細胞的激活[5-6]。小膠質細胞可被缺血后死亡神經細胞所釋放的如熱休克蛋白-60、纖維蛋白原、透明質酸等多種內源性配體激活,被激活的小膠質細胞會釋放出大量的炎性介質形成炎癥級聯放大效應,進一步加重神經損傷。因此,抑制小膠質細胞的激活對于抑制炎癥反應從而減輕腦缺血再灌注損傷十分重要。
阿托伐他汀在臨床上主要用于降血脂,研究顯示阿托伐他汀對缺血性卒中也具有預防和治療的作用[7]。阿托伐他汀對缺血性腦卒中的神經保護機制尚不完全清楚,除降脂作用外對腦缺血再灌注后炎癥反應是否有影響少有報道。阿托伐他汀是否在TRL4/NF-κB 通路中起重要作用,尚需進一步研究證實。因此本研究采用線栓法制備大鼠局灶性腦缺血-再灌注(ischemia-reperfusion,I/R)模型,觀察阿托伐他汀對大鼠腦缺血再灌注后 TNF-α、TRL4、NF-κB的表達的影響,旨在觀察和探討阿托伐他汀對SD大鼠腦缺血再灌注后腦保護的炎癥機制,為該藥實現缺血性腦卒中的臨床應用提供科學依據。
1 材料與方法
1.1動物清潔級健康雄性SD大鼠,8周齡,體質量 200~250 g,20~25 ℃ 下分籠飼養,相對濕度 57%,自然晝夜,自由飲水和進食,術前禁食12 h。
1.2試劑大鼠TNF-αELISA試劑盒(武漢博士得生物公司)、大鼠NF-κB ELISA試劑盒(武漢博士得生物公司)、阿托伐他汀:純度大于99.19%(廣東陽江制藥廠有限公司)、2,3,5氯化三苯基四氮唑(TTC)(北京索萊寶科技有限公司)
1.3動物分組及給藥用隨機數字表將大鼠按體質量隨機分為假手術組(15只)、模型組(15只)及預處理組(15只)。給藥:預處理組術前連續14 d每天給予10 mg/kg阿托伐他汀灌胃,假手術組和模型組術前給予等體積生理鹽水灌胃。
1.4造模應用改良的Zea-Longa[8]線栓法制備局灶性腦缺血再灌注模型:大鼠術前腹腔注射10 % 水合氯醛3.5 mL/kg,麻醉后固定于手術板,碘伏消毒,沿頸部正中自下而上切一縱向切口,分離右側頸總動脈、結扎其近心端,分離頸外動脈并結扎其根部,在頸內動脈根部備線并打一活結。在頸總動脈近顱側夾一小動脈夾,結扎處的遠端剪口,將石蠟處理過的線栓插入切口小心向顱側推進,到達動脈夾處取下動脈夾,使線栓得以經頸內動脈到達大腦前動脈,結扎備線固定線栓。由內而外逐層縫合皮膚消毒后分籠飼養。2 h后將線栓前端拔出至頸內、外動脈分叉處,實現血流再灌注。大鼠蘇醒后行Zea-Longa 5分法[8]神經評分,1~3分者說明造模成功,評分標準見下文。
1.5神經功能缺損評分采用 Zea-Longa 5 分法對各組大鼠術后2 h、6 h、12 h、24 h、48 h、72 h進行神經功能缺損評分,具體標準為:0分,神經功能正常;1分,左側前爪無法伸展;2分,出現追尾征;3分,行走時身體向左側傾倒;4分,意識喪失。
1.6梗死體積計算用水合氯醛麻醉后斷頭取腦。將腦組織置于-20 ℃冰箱中20 min取出,切去額端1.0 mm,由前向后每隔2.0 mm作冠狀切片,共切5片。放置于1%TTC磷酸緩沖液(0.23 mol/L,pH 7.5)中,37.5 ℃避光孵育,每隔15 min翻面一次,共孵育30 min。正常組織顯示出紅色,梗死組織顯示為白色。染色后數碼相機拍照,使用ImageJ圖像分析系統計算梗死體積。大鼠腦梗死體積百分比=(正常側大腦半球體積-梗死側非梗死區大腦半球的體積)/正常側大腦半球體積。
1.7TNF-α、NF-κB測定血清:各時間點行內眥靜脈叢取血,室溫靜置2 h左右,將血樣4 ℃ 3 000 r/min,離心10 min。分離血清,按試劑盒說明書操作采用酶聯免疫吸附法(ELISA法)測定TNF-α、NF-κB濃度。腦組織:末次取血后,迅速冰盤上斷頭取腦,加入9倍量的 0~4 ℃ 生理鹽水,在冰浴上勻漿得10% 腦組織勻漿,將腦勻漿在4 ℃ 條件下以3 500 r/min低溫離心15 min,取上清置于-80 ℃ 冰箱備用,用于 TNF-α、NF-κB測定。具體方法參照試劑盒說明。
1.8實時熒光定量PCR技術檢測腦組織TLR4和NF-κBmRNA的表達取大鼠腦缺血再灌注72 h的腦組織,用Trizol法提取組織總RNA,采用 Prime-ScriptTM逆轉錄試劑盒合成 cDNA,再將逆轉錄的產物稀釋5倍,用于熒光定量 PCR(RT-PCR)分析。查找 NCBI 數據庫中的大鼠 TLR4 、NF-κB 和 β-actin 的 mRNA 序列作為模板,設計RT-PCR 引物。TLR4上游5’-GCCGGAAAGTTATTGTGGTGGT-3’,下游5’-ATGGGTTTTAGGCGCAGAGTTT-3’;NF-κB上游5’-GCTTTTCCAGCTGCTATTGG-3’下游5’-GTGGGGACTGCGATCCTTA-3’;β-actin上游5’-GGAGATTACTGCCCTGGCTCCTA-3’下游5’-ACTCATCGTACTCCTGCTTGCTC-3’。引物均由大連寶生物工程有限公司合成。RT-PCR 擴增條件:預變性 95 ℃×5 min,變性95 ℃×30 s,退火 60 ℃×30 s,延伸 72 ℃×30 s,均為35個循環。以β-actin為內參,采用 2-△△Ct法對數據進行分析,即基因表達差異= 2-△△Ct,△△Ct= 實驗組(目的基因Ct值-內參基因Ct值)-對照組 (目的基因Ct值-內參基因Ct值)。
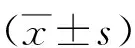
2 結果
2.1各組大鼠再灌注后不同時間點神經功能缺損評分比較假手術組再灌注后各時間點均無神經功能缺損,模型組及預處理組再灌注后各時間點均表現出明顯的神經運動功能障礙。預處理組各再灌注時間點的神經功能缺損評分均明顯低于模型組(P<0.05)。見表1。
2.2大鼠再灌注各時間點血清TNF-α、NF-κB比較與假手術組比較,模型組和預處理組大鼠再灌注各時間點血清TNF-α、NF-κB均有升高(P<0.05);與模型組比較,預處理組大鼠于再灌注2 h、6 h、12 h、24 h血清TNF-α、NF-κB有所下降(P<0.05),再灌注48 h、72 h 2組間差異無統計學意義(P>0.05)。見表2、表3。
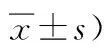
表1 再灌注各時間點神經功能缺損評分比較 (分,Table 1 Comparison of neurological deficit scores at various time points of

表2 各組大鼠再灌注后各時間點血清TNF-α比較Table 2 Comparison of serum TNF-α at various time points after reperfusion of rats in each

表3 各組大鼠再灌注后各時間點血清NF-κB比較Table 3 Comparison of serum NF-κB at various time points after reperfusion in each group of
2.3大鼠再灌注72h腦組織中TNF-α、NF-κB比較與假手術組比較,模型組與預處理組大鼠再灌注72 h腦組織中TNF-α、NF-κB均有所升高(P<0.05);與模型組比較,預處理組TNF-α、NF-κB有所降低(P<0.05)。見表4。
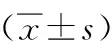
表4 各組大鼠再灌注72 h 腦組織TNF-α、NF-κB比較Table 4 Comparison of TNF-α and NF-κB in brain tissue of rats in each group after 72 hours of
2.4再灌注72h各組腦組織TLR4和NF-κBmRNA表達比較與假手術組相比,模型組和預處理組腦組織中TLR4、NF-κB mRNA 表達顯著上調 (P<0.01),預處理組 TLR4、NF-κB mRNA 表達與模型組相比有所下調(P<0.05)。見表5。
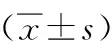
表5 各組大鼠再灌注后72 h腦組織TLR4 、NF-κBmRNA表達比較Table 5 Comparison of TLR4 and NF-κB mRNA expression in brain tissue of rats in 72 hours after
2.5腦缺血再灌注后72h各組大鼠腦梗死體積比較腦缺血再灌注后72 h,假手術組無梗死灶形成;模型組腦梗死體積為 (49.44±1.23)%。預處理組腦梗死體積為(23.54±2.14)%,低于模型組(P<0.05)。見圖1。

圖1 各組梗死體積的比較Figure 1 Comparison of infarct volume in each group
3 討論
缺血性腦卒中是嚴重威脅人類健康的常見病之一,具有極高的致殘率及致死率,然而目前臨床治療效果仍不理想,缺血性腦卒中的治療手段主要是超早期溶栓,但有效治療時間窗短并易繼發腦缺血再灌注損傷[9-10]。腦缺血再灌注損傷病理過程十分復雜,包括過度神經炎性反應、大量自由基生成、膜脂質過氧化等,其中神經炎性反應是最關鍵的病理機制。過度炎癥反應可以使血腦屏障通透性增加,大量的炎性因子通過血腦屏障加重腦損傷。在這一過程中TNF-α與缺血再灌注損傷關系最為直接[11]。首先,TNF-α可通過調節細胞間黏附因子-1(ICAM-1)水平引發血管炎性反應,炎性細胞進入腦組織可損傷神經系統。TNF-α還可促進血管內皮細胞產生凝血活性,使血栓形成。動物研究顯示腦中的TNF-α還會促進前列環素、血栓烷B2等因子的釋放,這些因子除促凝外也會減少血管舒張因子,使血管收縮,從而加重腦損傷[12]。
阿托伐他汀屬于3-羥基-3-甲基戊二酸單酰輔酶A還原酶抑制劑,它能有效降低低密度脂蛋白和膽固醇、降低三酰甘油,增高高密度脂蛋白,故臨床上主要用于調脂治療。臨床應用發現接受阿托伐他汀治療的患者腦卒中的發病風險降低[13]。動物實驗顯示,即使血脂水平正常的大鼠,阿托伐他汀也可減小其缺血再灌注后腦梗死體積,表現為腦保護作用,因此阿托伐他汀可能通過降脂、抗炎、抗氧化等多種機制來發揮神經保護作用,其機制還有待研究[14]。
本研究發現預處理組大鼠腦缺血再灌注后各時間點神經功能評分均低于模型組,腦梗死程度也更輕,且各時間點預處理組TNF-α表達低于模型組。說明阿托伐他汀可抑制神經元的丟失,減輕神經功能損傷的程度,其作用機制可能與影響和調節TNF-α的表達水平有關。阿托伐他汀通過什么機制下調TNF-α表達,有研究發現NF-κB 信號通路可以通過介導炎癥反應促進腦缺血再灌注時的神經損傷。因此,本研究進一步探討了TNF-α下調與NF-κB 信號通路是否有關。
NF-κB 是真核細胞中廣泛存在的核轉錄因子,當細胞處于靜息狀態時,NF-κB通常存在于胞漿中;腦缺血-再灌注時腦組織細胞中的NF-κB 被激活,致使其與抑制性蛋白I-κB 發生分離,從胞漿轉至胞核發揮調控作用,活化后的NF-κB可以促進 TNF-α、IL-1β及IL-6 等促炎因子基因的表達,從而促進炎性反應[15],而這些因子反過來又可進一步激活 NF-κB,使 NF-κB 活化在組織間不斷擴散,加重炎癥反應[16]。NF-κB 活化還可以激活大量氧化活性物質釋放,導致氧化應激,自由基瀑布效應等,加速細胞凋亡進程,故 NF-κB 活化被認為是介導腦缺血再灌注后炎性損傷的關鍵環節。
本研究證明阿托伐他汀在抑制TNF-α的同時也能夠抑制腦組織中NF-κB的表達。說明阿托伐他汀對TNF-α的抑制可能是NF-κB活化受到抑制的結果。為找到NF-κB活化受到抑制的原因,本研究對其作用機制進行了進一步的探究。
與腦缺血再灌注損傷相關的細胞信號轉導通路有很多[17-18],其中TLR4/NF-κB 信號轉導通路對中樞神經系統炎癥反應的調控居于核心地位[19]。TLR4在腦組織中主要由小膠質細胞表達,TLR4 基因敲除小鼠腦缺血再灌注時產生的炎癥因子減少,腦損傷程度減輕[20]。TLR4與配體結合后通過髓樣分化因子88(MyD88)依賴信號通路和非 MyD88依賴信號通路發揮作用。其中MyD88依賴信號通路可引發NF-κB的活化,如前所述,活化后的NF-κB可使TNF-α、IL-6等炎性因子分泌增加,放大炎癥反應[21-22]。
通過本研究觀察到假手術組大鼠TLR4和NF-κB表達極低,模型組明顯高于假手術組,證明 TLR4/NF-κB信號通路在腦缺血再灌注損傷過程中發揮重要作用。當腦缺血發生后,壞死的神經元產生熱休克蛋白-60、透明質酸等大量內源性配體,這些配體與TLR4結合后激活小膠質細胞,后者分泌大量炎性因子,放大的炎癥反應導致更多神經元壞死,壞死神經元釋放更多TLR4的內源性配體,從而激活更多小膠質細胞,周而復始形成惡性循環。而預處理組較模型組TLR4和NF-κB表達降低,可能機制是阿托伐他汀使小膠質細胞表面 TLR4內源性配體減少,TLR4/NF-κB通路受到抑制,TNF-α等炎癥因子分泌受到抑制,炎癥反應減輕,神經元得到保護[22]。
阿托伐他汀通過抑制TLR4/NF-κB通路能夠抑制TNF-α等炎癥因子的表達,從而起到對腦缺血再灌注損傷的保護作用。阿托伐他汀作為調脂藥由于具有臨床療效好、不良反應少等特點被廣泛應用。本研究顯示,阿托伐他汀在缺血性腦卒中的防治方面也具有廣闊的前景。

