新型冠狀病毒S蛋白R(shí)BD肽段的原核表達(dá)與純化
侯江厚 ,張靈霞 ,黃國(guó)紅 ,詹曉燕 ,楊奕梅
1.昆明市婦幼保健院,云南 昆明 650013;2.解放軍總醫(yī)院 第八醫(yī)學(xué)中心,北京 100091
新型冠狀病毒病(COVID-19)是由新型冠狀病毒(SARS-CoV-2)感染引起的一種傳染性極高的呼吸系統(tǒng)性疾病,自2019年12月出現(xiàn)以來(lái),該病在全球范圍內(nèi)迅速蔓延。重癥COVID-19患者可導(dǎo)致多器官損傷和衰竭,最終死亡[1]。目前,針對(duì)COVID-19的治療還沒(méi)有特效藥物,病毒的傳染源、中間宿主以及潛伏期等諸多因素的不明確也將導(dǎo)致本次新冠疫情的防控面臨巨大的壓力和挑戰(zhàn),因此,研發(fā)高效的抗病毒藥物是對(duì)抗SARS-CoV-2感染的關(guān)鍵。SARS-CoV-2的基因圖譜、蛋白結(jié)構(gòu)和入侵受體等生物學(xué)相關(guān)機(jī)制都相繼被快速探明,為抗病毒藥物的研發(fā)奠定了基礎(chǔ)[2]。SARS-CoV-2表面的刺突(spike,S)蛋白是病毒打開宿主細(xì)胞大門的“鑰匙”,S蛋白通過(guò)與宿主細(xì)胞表面的血管緊張素轉(zhuǎn)換酶2(angioten?sin converting enzyme 2,ACE2)受體結(jié)合,介導(dǎo)SARS-CoV-2感染的第一步[3]。自然狀態(tài)下S蛋白以一種相對(duì)穩(wěn)定的同源三聚體形式存在,當(dāng)S蛋白與ACE2結(jié)合時(shí),S蛋白三聚體與ACE2二聚體之間有多個(gè)基團(tuán)相互作用,促進(jìn)細(xì)胞內(nèi)吞而增強(qiáng)病毒入侵過(guò)程。S蛋白由S1和S2兩部分組成,其中S1組成棘突的頭部,受體結(jié)合域(receptor binding domain,RBD)位于S1區(qū)域表面,其受體結(jié)合基序(receptor binding motif,RBM)僅有數(shù)個(gè)氨基酸[4]。阻斷病毒和宿主細(xì)胞受體的結(jié)合可以阻止病毒入侵,是抗病毒藥物研發(fā)策略之一,阻斷S蛋白R(shí)BD是阻止SARS-CoV-2感染的關(guān)鍵,是抗COVID-19藥物研發(fā)的重要靶點(diǎn)。抗體或小分子化合物通過(guò)與S蛋白R(shí)BD靶向結(jié)合,抑制或阻斷RBD與ACE2的結(jié)合,從而抑制SARS-CoV-2進(jìn)入宿主細(xì)胞,避免宿主細(xì)胞感染[5]。
為了獲得RBD完整肽段,我們利用原核表達(dá)系統(tǒng),采用基因重組方法獲得重組RBD肽。蛋白的天然構(gòu)象是保持該蛋白天然活性的前提,結(jié)構(gòu)中二硫鍵的正確配對(duì)往往代表著蛋白正確的空間折疊方式。為了獲得具有天然構(gòu)象的RBD肽并提高重組蛋白的表達(dá)量,我們采用與DsbC蛋白融合表達(dá)的方式,充分利用DsbC分子伴侶和二硫鍵異構(gòu)酶的作用[6]。同時(shí),為了得到?jīng)]有冗余氨基酸的RBD肽,以便在后續(xù)抗體制備、配基篩選及抗病毒藥物篩選時(shí)能夠提高特異性,在其氨基酸序列的N端引入腸激酶位點(diǎn),通過(guò)原核重組表達(dá)并采用腸激酶酶切和二次純化的方法獲得高純度的RBD肽。本研究獲得的RBD肽位于S蛋白Gly319~Asn541,全長(zhǎng)223個(gè)氨基酸殘基。
1 材料與方法
1.1 材料
大腸桿菌BL21(DE3)及其感受態(tài)細(xì)胞、原核表達(dá)載體pET-DsbC由本室制備保存;全基因與引物合成、測(cè)序由北京華大基因公司完成;PCR試劑購(gòu)自上海生工生物有限公司;質(zhì)粒提取、膠回收等常規(guī)分子生物學(xué)實(shí)驗(yàn)試劑盒購(gòu)自天根生化科技(北京)有限公司;限制性內(nèi)切酶、T4DNA連接酶購(gòu)自NEB公司;蛋白質(zhì)相對(duì)分子質(zhì)量marker購(gòu)自北京索萊寶生物公司;重組腸激酶由本室表達(dá)純化;Ni-Sepharose chelating Sepharose Fast Flow親和樹脂填料購(gòu)自中原合聚生物科技公司,本室裝填純化柱;LB培養(yǎng)基、PBS緩沖液配制試劑等其他試劑為進(jìn)口或國(guó)產(chǎn)分析純產(chǎn)品。
1.2 全基因與引物合成
參照GenBank登錄號(hào)(MN908947.3)對(duì)SARSCoV-2的S蛋白氨基酸序列進(jìn)行分析,其RBD氨基酸為Gly319~Asn541。為了獲得沒(méi)有冗余氨基酸的RBD,保持此肽段正確的空間折疊和生物活性,選定此區(qū)域肽段,同時(shí)在N端加入腸激酶序列DDDDK。融合蛋白對(duì)應(yīng)的核酸序列按照利于原核表達(dá)系統(tǒng)表達(dá)的原則進(jìn)行優(yōu)化和全基因合成,在對(duì)應(yīng)的核酸兩端分別加入限制性內(nèi)切酶HindⅢ和XhoⅠ位點(diǎn)序列,3'端加入大腸桿菌終止密碼子taa。
1.3 pET-DsbC-RBD表達(dá)載體的構(gòu)建與鑒定
用限制性內(nèi)切酶HindⅢ和XhoⅠ雙酶切全基因合成的克隆載體pUC-RBD,紫外燈下切下RBD核酸片段并進(jìn)行膠回收,對(duì)表達(dá)載體pET-DsbC同樣以HindⅢ和XhoⅠ進(jìn)行雙酶切和膠回收,16℃條件下采用T4DNA連接酶對(duì)核酸片段和酶切后的載體進(jìn)行混合連接過(guò)夜,連接產(chǎn)物轉(zhuǎn)化感受態(tài)大腸桿菌BL21(DE3),鋪含卡那霉素的固體平板,次日挑選克隆進(jìn)行菌落PCR,篩選陽(yáng)性克隆,PCR產(chǎn)物行1%瓊脂糖凝膠電泳,判斷產(chǎn)物大小。對(duì)陽(yáng)性克隆擴(kuò)大培養(yǎng)并測(cè)序,測(cè)序正確的菌株保存?zhèn)溆谩?/p>
1.4 DsbC-RBD融合蛋白的原核重組表達(dá)與初步純化
取測(cè)序正確的陽(yáng)性工程菌株于37℃振蕩過(guò)夜培養(yǎng)進(jìn)行活化,隔日按1∶100的比例轉(zhuǎn)接至含50 μg/mL卡那霉素的LB培養(yǎng)基中擴(kuò)大培養(yǎng),檢測(cè)細(xì)菌生長(zhǎng)密度,菌液D600nm值約為0.4時(shí)加入IPTG(終濃度為0.5 mmol/L),30℃振蕩誘導(dǎo)10 h,6000 r/min離心5 min收集菌體,加入1×PBS充分混勻,在冰水狀態(tài)下超聲波破碎菌體,12 000 r/min離心30 min,分別取上清和沉淀進(jìn)行12%的SDSPAGE,分析重組DsbC-RBD的表達(dá)形式。
取超聲波破碎后的離心上清,以1 mL/min的速度結(jié)合鎳離子螯合的親和層析柱,PBS緩沖液緩慢平衡層析柱5個(gè)柱體積至基線處于水平狀態(tài),以50 mmol/L咪唑除去菌體自身雜蛋白,150 mmol/L咪唑洗脫收集目的蛋白,收集2次的洗脫液加入變性緩沖液,煮沸10 min,12% SDS-PAGE分析重組DsbC-RBD的純度。純化后的重組蛋白以水充分透析,凍干保存。
1.5 重組DsbC-RBD融合蛋白的腸激酶酶切
取凍干后的DsbC-RBD粉末,用PBS稀釋至1 mg/mL,加入腸激酶,比例為 1∶3000,充分混勻。為了最大限度地保持RBD肽的生物活性,選擇酶切溫度為4℃,酶切時(shí)間為隔夜10 h,酶切后取混合樣品進(jìn)行15% SDS-PAGE分析酶切效率、酶切特異性和目的蛋白R(shí)BD的相對(duì)分子質(zhì)量。
1.6 目的RBD肽的二次親和純化
分子伴侶蛋白DsbC和腸激酶的N端均帶有6×His標(biāo)簽,通過(guò)親和柱層析除去酶切后的DsbC蛋白和腸激酶,采用鎳離子螯合的親和層析方法對(duì)酶切后的RBD肽混合液進(jìn)行分離提純。取酶切后融合蛋白混合液,以1 mL/min的速度重復(fù)結(jié)合鎳離子螯合的親和層析柱3次,小心收集穿過(guò)液,取穿過(guò)液,15% SDS-PAGE分析純化后RBD肽的純度和相對(duì)分子質(zhì)量,計(jì)算目的蛋白R(shí)BD肽酶切后的純化得率,對(duì)純化后的RBD肽充分水透析后,凍干保存?zhèn)溆谩?/p>
2 結(jié)果
2.1 SARS-CoV-2 S蛋白R(shí)BD全基因合成
參考GeneBank公布的SARS-CoV-2 S蛋白氨基酸序列,選擇Gly319~Asn541序列,根據(jù)有利于原核系統(tǒng)表達(dá)的原則,采用氨基酸密碼子同義置換,對(duì)RBD肽段對(duì)應(yīng)的核酸進(jìn)行全基因合成,在該肽段的N端加腸激酶序列DDDDK。合成的序列全長(zhǎng)包含699個(gè)核苷酸,序列如下:

2.2 重組pET-DsbC-RBD表達(dá)載體的構(gòu)建與鑒定
用內(nèi)切酶HindⅢ和XhoⅠ雙酶切合成載體pUC-RBD,將酶切的RBD核酸片段克隆到表達(dá)載體pET-DsbC上,轉(zhuǎn)化大腸桿菌BL21(DE3),鋪固體平板,以合成的鑒定引物采用菌落PCR方法篩選陽(yáng)性克隆,1%瓊脂糖凝膠電泳結(jié)果如圖1,在預(yù)期的約700 bp處有單一條帶,經(jīng)測(cè)序與合成序列完全一致。
2.3 DsbC-RBD融合蛋白的原核表達(dá)及親和純化
取測(cè)序正確的工程菌株擴(kuò)大培養(yǎng),30℃條件下隔夜誘導(dǎo),取誘導(dǎo)后的菌體超聲波破碎,高速離心30 min后,取上清和沉淀進(jìn)行12%的SDS-PAGE,結(jié)果如圖2。融合蛋白的相對(duì)分子質(zhì)量為58×103,和預(yù)期一致,表達(dá)量占菌體總蛋白的30%以上,分別存在于超聲波裂解后的上清和沉淀中。由于可溶性表達(dá)往往代表蛋白正確的折疊方式,RBD上清存在形式保證結(jié)構(gòu)區(qū)的空間構(gòu)象,保證后期抑制劑篩選的特異性。
取超聲波裂解后的上清,以緩慢的速度流經(jīng)His標(biāo)簽親和層析柱,再用PBS緩沖液平衡到基線水平,分別用50 mmol/L咪唑洗脫雜蛋白、150 mmol/L咪唑洗脫收集目的蛋白,12% SDS-PAGE結(jié)果如圖3。經(jīng)親和層析后,DsbC-RBD融合蛋白純度在90%以上,純化后的融合蛋白經(jīng)水透析,凍干保存。
2.4 DsbC-RBD重組融合蛋白的腸激酶酶切
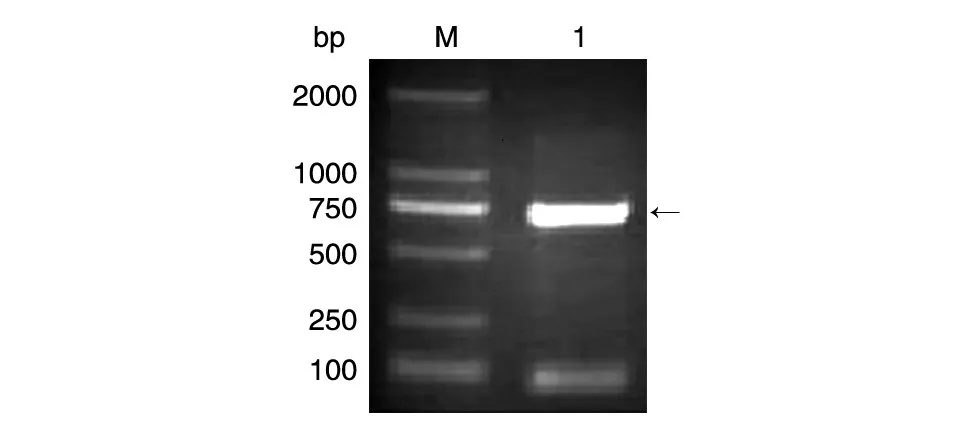
圖1 RBD核酸片段菌落PCR凝膠電泳鑒定結(jié)果
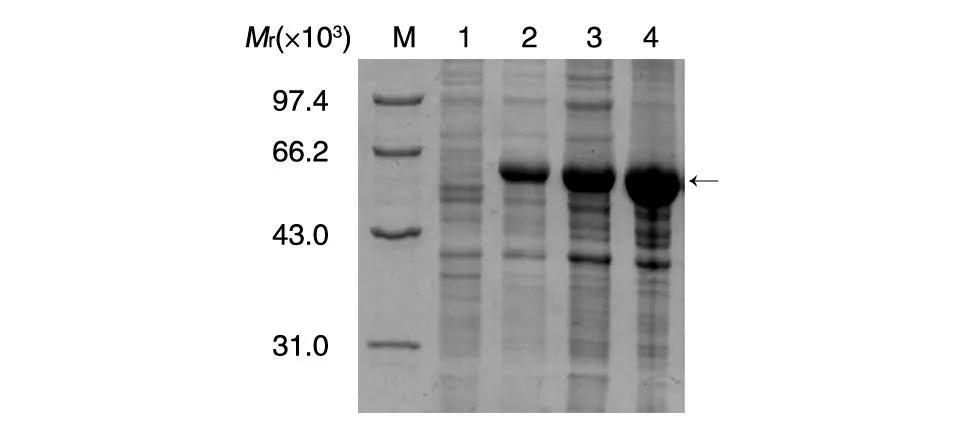
圖2 DsbC-RBD原核表達(dá)產(chǎn)物表達(dá)形式分析
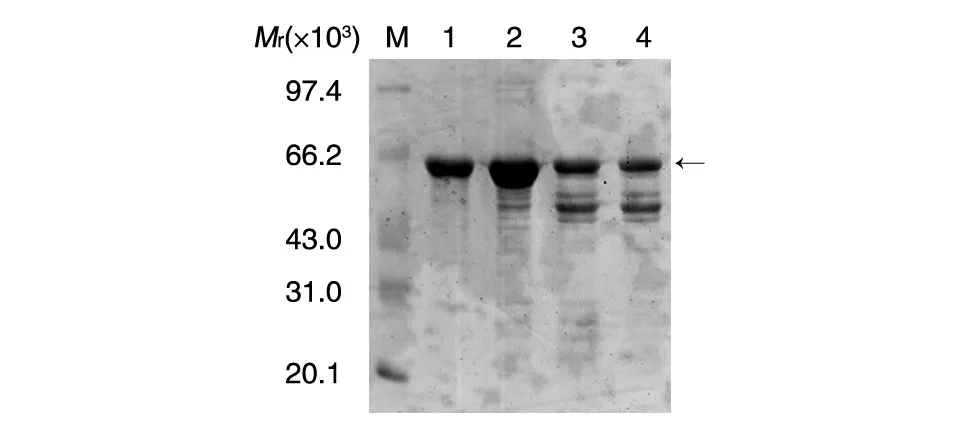
圖3 DsbC-RBD融合蛋白親和純化電泳分析
充分考慮酶切后RBD肽段的生物功能,避免較高溫度對(duì)RBD肽段生物活性的影響,腸激酶酶切只在4℃條件下進(jìn)行,酶切時(shí)間設(shè)為8 h。取酶切后混合樣品以15% SDS-PAGE分析,結(jié)果如圖4,此條件下酶切效率為100%,沒(méi)有產(chǎn)生非特異酶切現(xiàn)象,酶切后顯示RBD肽相對(duì)分子質(zhì)量約為25×103,與理論值一致。
2.5 重組RBD肽的純化
采用鎳離子螯合親和層析對(duì)酶切后蛋白混合液中的RBD肽進(jìn)行分離提純,腸激酶酶切后蛋白混合液以緩慢的速度反復(fù)結(jié)合親和層析柱,收集流穿液以15% SDS-PAGE鑒定回收RBD肽的純度,結(jié)果如圖5,純化后的RBD肽相對(duì)分子質(zhì)量約為25×103,同預(yù)期一致,經(jīng)考馬斯亮藍(lán)染色鑒定,純度大于92%,計(jì)算得率為30%,得率較低。
3 討論
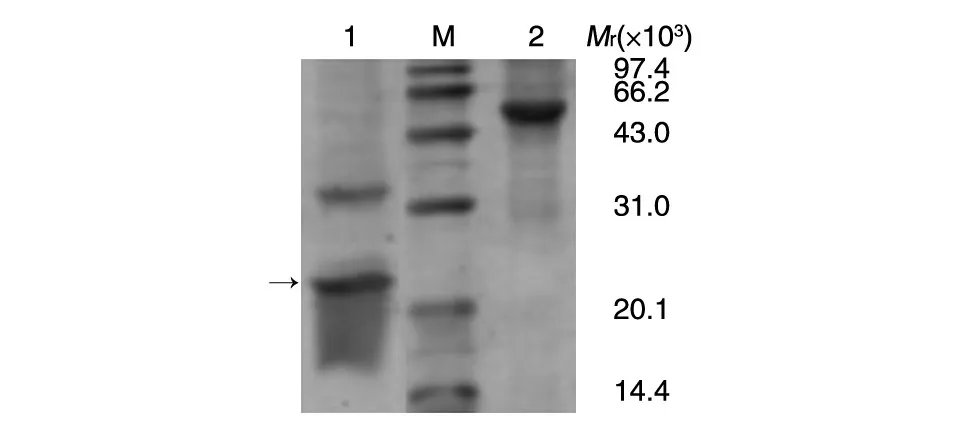
圖4 DsbC-RBD融合蛋白腸激酶酶切電泳分析
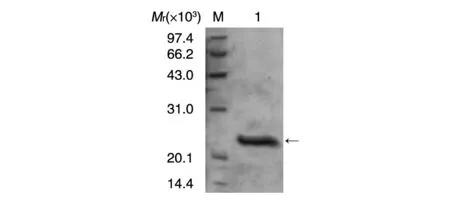
圖5 RBD肽親和純化電泳分析
阻斷病毒和宿主細(xì)胞受體的結(jié)合可以阻止病毒入侵,是抗病毒藥物研發(fā)策略之一,包括靶向病毒或宿主細(xì)胞的受體。SARS-CoV-2具有傳染性極強(qiáng)和潛伏時(shí)間長(zhǎng)短不一的特點(diǎn),同時(shí),病毒真正的傳染源及中間宿主也未明確,病毒存在變異風(fēng)險(xiǎn)等,都導(dǎo)致SARS-CoV-2疫情防控具有諸多不確定因素,因此研發(fā)SARS-CoV-2預(yù)防和治療性疫苗或高效抗病毒藥物迫在眉睫。目前COVID-19仍沒(méi)有特異治療方法和抗病毒治療藥物,MARS-CoV的動(dòng)物模型研究和COVID-19疫情中康復(fù)病人血清的救治均顯示,阻斷入侵策略對(duì)冠狀病毒可能有效,S蛋白R(shí)BD的阻斷是阻止SARS-CoV-2感染的關(guān)鍵,是抗COVID-19藥物研發(fā)的重要靶點(diǎn)。SARS-CoV-2的S蛋白是一種糖蛋白,有3個(gè)RBD,內(nèi)部有二硫鍵連接,在β冠狀病毒屬中保守[7]。RBD結(jié)構(gòu)靠近c(diǎn)ryo-EM三聚體的中央部位,使S蛋白形成易于和宿主受體ACE2結(jié)合的空間構(gòu)象,SARS-CoV-2與受體ACE2的結(jié)合能力比SARS-CoV更強(qiáng),更具傳染性[8]。RBD是誘導(dǎo)抗體產(chǎn)生,阻斷病毒結(jié)合,刺激宿主免疫反應(yīng)、中和抗體及保護(hù)免疫系統(tǒng)免受病毒感染的主要抗原成分。抗體或小分子化合物通過(guò)與S蛋白R(shí)BD的靶向結(jié)合,抑制或阻斷RBD結(jié)合功能,可特異性阻斷RBD與ACE2的結(jié)合,從而抑制SARS-CoV-2進(jìn)入宿主細(xì)胞,避免宿主細(xì)胞感染。
目前已有商品化的RBD肽,但價(jià)格較昂貴,同時(shí)大都采用與人Fc蛋白融合表達(dá),主要用于抗原抗體血清學(xué)檢測(cè),而高純度的RBD肽是后續(xù)抗體制備、配基篩選和藥物篩選驗(yàn)證的基礎(chǔ)和保證。為了獲得高純度的重組RBD肽,我們根據(jù)原核系統(tǒng)的特點(diǎn)對(duì)氨基酸的密碼子組成進(jìn)行了同義置換,以利于原核系統(tǒng)的表達(dá);原核系統(tǒng)內(nèi)的高表達(dá)是后續(xù)純化獲得高純度重組蛋白的基礎(chǔ),采用融合表達(dá)方式,兼并考慮RBD肽存在的二硫鍵,在RBD的N端加入同時(shí)具有伴侶蛋白和二硫鍵異構(gòu)酶作用的DsbC蛋白進(jìn)行融合表達(dá),使得融合蛋白的表達(dá)量達(dá)到總蛋白的30%以上,并獲得了部分可溶性表達(dá),提示獲得的RBD肽可能具有天然空間結(jié)構(gòu)和正確的二硫鍵配對(duì);其次,在RBD肽的N端加入腸激酶切點(diǎn),在目前已經(jīng)很成熟的腸激酶酶切工藝下,通過(guò)二次純化獲得了重組RBD肽,該重組RBD肽不含冗余氨基酸,具有結(jié)構(gòu)完整性,在抗體制備和抗病毒藥物篩選時(shí)將具有較強(qiáng)的特異性。本方法獲得的RBD肽純度為92%,水溶性較好,但得率較低。高純度的RBD肽為隨后開展以RBD肽為靶標(biāo)進(jìn)行相關(guān)抑制劑篩選和機(jī)制研究提供了可靠的保證,也為臨床以RBD肽為重組抗原進(jìn)行血清學(xué)抗體診斷提供了原料。

