唑來膦酸對乳腺癌術后內分泌治療患者骨折風險的影響
林紅曉 王東巖 金雨
(連云港市第一人民醫院骨質疏松科,江蘇 連云港 222000)
骨質疏松主要特征是骨量降低、骨組織結構被破壞、骨脆性增高,具有原發性及繼發性兩大類型〔1,2〕。絕經期女性由于雌激素明顯下降,隨著年齡增長,其骨量丟失更加嚴重,尤其是乳腺癌術后患者普遍存在骨量丟失、骨質疏松〔3,4〕。乳腺癌患者化療治療、內分泌治療等都會導致其雌激素水平顯著下降,導致骨質流失,增加骨質疏松風險,尤其是芳香化酶抑制劑的使用〔5〕。據報道,體重指數(BMI)、絕經年限、年齡三方面因素是乳腺癌術后患者1年內發生骨質疏松的危險因素〔6〕。唑來膦酸屬于第3 代雙磷酸鹽類藥物,具有較強的抗骨吸收能力〔7〕。本研究觀察唑來膦酸對乳腺癌術后內分泌治療患者骨密度(BMD)及骨折風險的影響。
1 資料與方法
1.1一般資料 選取2016年1~12月在連云港市第一人民醫院行乳腺癌手術患者50例作為研究對象,采用隨機數字表法均等分組,對照組年齡53~70歲,均值(60.85±5.36)歲;體重49~68 kg,均值(54.96±4.95)kg;病理分期:Ⅰ期15 例,Ⅱ期10例;絕經年齡均值(49.85±4.28)歲。觀察組年齡53~68 歲,均值(61.96±4.28)歲;體重47~71 kg,均值(55.94±5.02)kg;病理分期:Ⅰ期14 例,Ⅱ期11例;絕經年齡均值(49.52±4.16)歲。兩組患者在絕經年齡、病理分期、體重及年齡等基線資料對比無統計學意義(P>0.05)。診斷標準:乳腺癌患者均經手術、病理及影像學證實;骨質疏松參照世界衛生組織(WHO)公布的診斷標準:BMD 低于正常健康者2.5 個標準差。換而言之,T 值≤-2.5。納入標準:自愿參與本研究,簽署知情同意書,通過醫院倫理學會審核;術后接受內分泌治療;絕經后女性;確診為骨質疏松;病理分期為Ⅰ~Ⅱ期,具有完整的臨床資料及隨訪資料。排除標準:近期使用過影響骨代謝的藥物;對本研究涉及的相關藥物過敏;復發性乳腺癌;卵巢、子宮等生殖系統疾病;腦卒中、心肌梗死等病史;高血壓、糖尿病、骨關節疾病等慢性疾病;惡性腫瘤病情嚴重發生骨轉移;血液系統、內分泌系統等疾病;臨床資料缺失,失訪等。
1.2方法 對照組及觀察組均25例,兩組患者均口服來曲唑或阿那曲唑治療。對照組給予碳酸鈣600 mg(鈣爾奇)+活性維生素D(羅蓋全)。觀察組在對照組基礎上給予靜滴唑來膦酸4 mg(艾朗),每年1次。在征得患者及家屬的知情同意后,予以唑來膦酸注射液。一次靜脈滴注唑來膦酸4 mg,100 ml水溶液以輸液管恒定速度滴注,滴注時間≥15 min,給藥后靜脈注射0.9%氯化鈉注射液250 ml進行水化。
1.3觀察指標 隨訪2年,在內分泌治療前(基線)、內分泌治療第1、2年進行BMD檢測。(1)觀察兩組BMD〔8,9〕。對患者腰椎、股骨頸部位BMD采用雙能X線吸收BMD測量儀進行測定。(2)收集兩組對象的一般資料,同時使用骨折風險因子工具(FRAX)計算骨折風險系數值〔10,11〕。(3)對比治療前后生活質量。本次研究采用健康狀況問卷調查(SF-36)對兩組患者治療前后生活質量進行評估,該量表含有8個維度,分別為總體健康(GH)、精力(VT)、社會職能(SF)、情感職能(RE)、心理健康(MH)、生理功能(PF)、生理職能(RP)、軀體疼痛(BP)。前面2個維度含有體力及精神兩方面,最后3個維度主要是體力,其余3個維度主要針對精神方面。各維度計分采用累加法,計算原始分數后,再以標準公式計算轉換分數,各維度得分為 0 分(最差)~100 分(最好) 。
1.4統計學方法 采用SPSS22.0軟件進行t檢驗、χ2檢驗。
2 結 果
2.1觀察兩組BMD 治療前,對照組與觀察組腰椎及股骨頸兩個部位BMD組間對比無明顯差異(P>0.05),治療1年后、治療2年后對照組兩個部位BMD均較治療前顯著下降,治療2年后顯著低于治療1年后。觀察組兩個部位BMD均較治療前顯著提高,治療2年后顯著高于治療1年后,觀察組治療1年后、治療2年后兩個部位BMD均較對照組顯著升高(P<0.05),見表1。
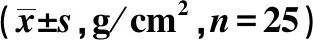
表1 兩組治療前后BMD比較
2.2觀察兩組FRAX骨折風險系數 治療前,兩組骨折風險系數組間對比無明顯差異(P>0.05)。治療1年后、治療2年后對照組骨折風險系數較治療前顯著提高,治療2年后顯著高于治療1年后。觀察組骨折風險系數較治療前顯著下降,治療2年后顯著低于治療1年后,觀察組治療1年后、2年后骨折風險系數均較對照組顯著降低(P<0.05),見表2。
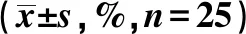
表2 兩組治療前后FRAX骨折風險系數的比較
2.3兩組患者生活質量 治療前,兩組生活質量8個維度組間對比無明顯差異(P>0.05);觀察組治療2年后生活質量各維度評分均較對照組高,對比具有統計學意義(P<0.05),見表3。
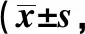
表3 兩組治療前后患者生活質量評分分,n=25)
2.4安全性 治療期間,兩組患者肝腎功能無異常,無不良反應,具有較高的安全性。
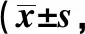
續表3 兩組治療前后患者生活質量評分分,n=25)
3 討 論
近年來乳腺癌的發病率逐年上升,已經成為威脅女性生命健康的惡性腫瘤的首位疾病。為進一步降低乳腺癌患者術后復發率,內分泌治療已經被廣大臨床醫生采納,內分泌治療可以抑制女性體內雄激素向雌激素轉化,而絕經后女性雄激素轉化為雌激素是女性體內雌激素的主要來源之一,因此可進一步加劇女性患者體內雌激素缺乏狀態,導致骨丟失,最終誘發骨質疏松〔12,13〕。如何更好地預防內分泌藥物治療所導致的骨量丟失已經成為近年研究的一個熱點。
有研究顯示,唑來膦酸與內分泌藥物聯合應用可以顯著治療內分泌藥物引起的骨量丟失〔14,15〕。WHO在2008年推薦采用FRAX來評估骨折風險,該工具主要用于評估具有脆性骨折高危因素患者的骨折風險,目前已被推廣于歐美國家,其可在早期對骨折風險予以預測,如骨折風險系數達到一定數值,則需給予患者及時干預和治療。美國骨質疏松基金會(NOF) 推薦,FRAX將“髖部骨折風險系數≥3%”作為推薦治療標準。另有研究顯示〔16〕,在患者的10年骨折風險系數超過7%時,對所有年齡段的患者進行干預治療是非常值得的。然而國內尚無大樣本研究這個干預閾值。臨床何時開始唑來膦酸治療尚無統一的標準,臨床醫師無指南可循。本研究通過雙能X線骨密度測量儀(DEXA)測量腰椎、股骨頸的BMD觀察唑來膦酸對乳腺癌術后應用內分泌治療患者的BMD的影響,同時應用FRAX評估治療前后骨折風險系數。本研究結果提示及早應用唑來膦酸可明顯提高乳腺癌術后應用內分泌治療患者的BMD,同時降低骨折風險系數,起到預防骨質疏松骨折的作用。
從現代醫學模式來看,疾病治療不僅是為了單純延長生存期,而是應以滿意終點為出發點,為此反應健康程度和療效制定不僅需要生物學指標,也應包括生活質量評估。本研究中,觀察組治療2年后生活質量各維度評分均顯著高于對照組,原因在于,經過2年的唑來膦酸治療,患者對乳腺癌術后內分泌治療、唑來膦酸作用機制等都具有一定了解,同時給予健康教育、心理指導、家庭互動等,使得患者體能、精神影響、社會活動、心理健康、體能影響、精力、身體疼痛和一般健康等方面都得到顯著改善。
綜上所述,唑來膦酸應用于乳腺癌術后內分泌治療患者中,能夠提高BMD,預防骨丟失,降低骨折風險,提高患者生活質量,具有較高的安全性。

