創傷性硬膜下積液轉化為慢性硬膜下血腫危險因素分析
易盼 王存祖 陳品 王東東 王輝 何世維 曾巍
創傷性硬膜下積液(TSE)是顱腦創傷(TBI)的常見并發癥,可轉化為慢性硬膜下血腫(CSDH)[1-2],相關發生機制目前尚未明確,可能與創傷性硬膜下積液形成并體積增大而致硬膜下血管破裂,以及積液性狀改變引起局部炎癥反應、包膜形成、管腔內纖維蛋白溶解亢進、出血增加等有關[3]。明確創傷性硬膜下積液轉化為慢性硬膜下血腫的危險因素,可以進行針對性預防與治療,減少誤診和需進一步手術的風險。本研究回顧分析75 例顱腦創傷伴創傷性硬膜下積液患者的臨床資料,探討創傷性硬膜下積液轉化為慢性硬膜下血腫的危險因素。
對象與方法
一、研究對象
1.納入標準 (1)顱腦創傷伴創傷性硬膜下積液。(2)創傷性硬膜下積液均符合以下診斷標準[4]:積液出現于顱腦創傷后;CT可見硬膜下“月牙”形均勻低密度區域;硬膜下病變區CT值<20 Hu;無包膜或包膜不強化。(3)硬膜下積液量 ≤ 100 ml。(4)年齡≥14 歲。(5)創傷至入院時間<24 h。
2.排除標準 (1)顱腦創傷術后發生的硬膜下積液。(2)硬膜下積液量>100 ml,有神經壓迫癥狀、明顯占位效應或顱內高壓癥狀,腦室、腦池受壓變形,中線偏移>10 mm,需外科手術清除積液。(3)隨訪期間(創傷后3 ~6 個月)失訪。
3.一般資料 選擇 2017 年 12 月至 2019 年 7 月在蘇北人民醫院神經外科住院治療并明確診斷為顱腦創傷伴創傷性硬膜下積液的患者共75例,男性63 例,女性 12 例;年齡 27 ~ 88 歲,平均(64.75 ±12.29)歲。既往高血壓29 例(38.67%)、冠心病1 例(1.33%)、糖尿病 8 例(10.67%)、高脂血癥 5 例(6.67%),吸煙 24 例(32%)、飲酒 25 例(33.33%)。本組患者血小板計數(70 ~322)×109/L[正常參考值(100 ~300)×109/L],平均(166.80±55.76)×109/L;其中6 例(8%)正在服用肝素、華法林、阿司匹林或氯吡格雷等抗凝藥,3 例(4%)凝血功能異常[包括凝血酶原時間(PT)>正常參考值3 s、活化部分凝血活酶時間(APTT)>正常參考值10 s 或國際標準化比值(INR)異常(正常參考值0.75 ~1.25)]。創傷后分別予以甘露醇(11 例占14.67%)、氨甲環酸(15 例占20%)或甘露醇與氨甲環酸聯合治療(32 例占42.67%),部分患者(17 例占22.67%)未予以甘露醇和氨甲環酸處理。
二、研究方法
1.影像學評價方法 患者入院后即行頭部CT檢查,治療過程中和隨訪期間通過CT或MRI了解病情進展程度或轉歸。(1)慢性硬膜下血腫診斷符合以下標準[1]:CT 可見硬膜下“月牙”形混雜密度或等密度區域,且CT 值>20 Hu;MRI顯示硬膜下“月牙”形短T1、長T2信號影;常可見包膜且包膜強化。(2)創傷性硬膜下積液轉化為慢性硬膜下血腫的診斷標準[1]:顱腦創傷后CT或MRI呈創傷性硬膜下積液改變,復查CT或MRI顯示創傷性硬膜下積液區域呈慢性硬膜下血腫改變。(3)觀察指標:通過觀察創傷性硬膜下積液側別(單側或雙側)、積液密度(高于或等于腦脊液密度)、創傷后達最大積液量時間、最大積液厚度、積液量最大時中線偏移程度、創傷后急性硬膜下出血側是否出現積液以及是否并發腦萎縮共計7 項參數,判斷創傷性硬膜下積液是否轉化為慢性硬膜下血腫,并采用回歸分析篩選相關危險因素。
2.統計分析方法 采用SPSS 25.0 統計軟件進行數據處理與分析。計數資料以相對數構成比(%)或率(%)表示,采用χ2檢驗或Fisher 確切概率法。呈正態分布的計量資料以均數±標準差()表示,采用兩獨立樣本的t檢驗;呈非正態分布的計量資料以中位數和四分位數間距[M(P25,P75)]表示,行Mann-WhitneyU檢驗。創傷性硬膜下積液轉化為慢性硬膜下血腫相關危險因素的篩查采用單因素和多因素逐步法Logistic 回歸分析(α入=0.05,α出=0.10)。以P≤0.05為差異具有統計學意義。
結 果
本組75 例創傷性硬膜下積液患者CT 檢查顯示,單側積液 37 例(49.33%),雙側積液 38 例(50.67%);積液密度高于腦脊液37 例(49.33%),等于腦脊液38例(50.67%);創傷后達最大積液量時間為 1 ~ 31 d,中位時間6(4,10)d;最大積液厚度3 ~18 mm,中位值7(5,11)mm;積液量最大時中線偏移0 ~5 mm,中位值0(0,0)mm;51 例(68%)并發腦萎縮;28 例(37.33%)急性硬膜下出血側出現積液。根據創傷性硬膜下積液是否轉化為慢性硬膜下血腫分為轉化組(33例)和未轉化組(42例),轉化組年齡(P=0.050)、應用抗凝藥比例(P=0.014)、積液密度高于腦脊液密度比例(P=0.002)、創傷后達最大積液量時間(P=0.000)、最大積液厚度(P=0.000)和腦萎縮比例(P=0.006)均高于未轉化組,其余指標組間差異無統計學意義(均P>0.05;表1,2)。

表1 轉化組與未轉化組患者一般資料的比較Table 1. Comparison of general data between transformed group and non-transformed group

表2 轉化組與未轉化組患者影像學參數的比較Table 2. Comparison of imaging data between transformed group and non-transformed group
單因素Logistic回歸分析顯示,積液密度高于腦脊液密度比例(P=0.002)、創傷后達最大積液量時間長(P=0.000)、最大積液厚度大(P=0.000)和并發腦萎縮(P=0.008)是創傷性硬膜下積液轉化為慢性硬膜下血腫的危險因素(表3,4)。將上述因素代入多因素Logistic 回歸方程,結果顯示,積液密度高于腦脊液密度(OR=6.021,95%CI:1.047 ~ 34.631;P= 0.044)、創傷后達最大積液量時間長(OR=1.253,95%CI:1.002 ~ 1.568;P=0.048)、最大積液厚度大(OR=2.080,95%CI:1.267 ~ 3.414;P=0.004)和并發腦萎縮(OR=35.392,95%CI:1.397 ~ 896.474;P=0.031)是創傷性硬膜下積液轉化為慢性硬膜下血腫的危險因素(表5;圖1,2)。
討 論
創傷性硬膜下積液最早由 Mayo[5]于 1894 年提出,但其發生機制至今仍未闡明,大多數學者頃向于蛛網膜破裂和活瓣形成學說、血腦屏障破壞學說或腦萎縮學說等[6-8],其中以蛛網膜破裂和活瓣形成學說較被推崇[3]。創傷性硬膜下積液轉化為慢性硬膜下血腫可能與以下原因有關[9-10]:(1)不斷增加的硬膜下積液使硬膜下腔間隙不斷擴大,導致橋靜脈和蛛網膜顆粒靜脈不同程度破裂或局部毛細血管破裂出血,逐漸形成慢性硬膜下血腫。(2)長期積液使積液周圍形成包膜,而包膜內新生的毛細血管內皮不完整,同時積液腔內處于纖維蛋白溶解亢進狀態,新生毛細血管持續滲血,從而導致慢性硬膜下血腫。(3)硬膜下積液性狀不同,混有血液成分或蛋白質含量較高的積液,易轉化為慢性硬膜下血腫。既往研究顯示,創傷性硬膜下積液轉化為慢性硬膜下血腫的概率為2.4% ~ 60.8%[1,7,11-13]。本研究75例患者中33例于傷后恢復期轉化為慢性硬膜下血腫,轉化率為44%,與既往研究相一致。然而,臨床上究竟何種創傷性硬膜下積液更易轉化為慢性硬膜下血腫?長期以來一直是神經外科醫生廣為探討且頗具臨床意義的研究課題。
在本研究中,根據創傷性硬膜下積液是否轉化為慢性硬膜下血腫分為轉化組和未轉化組,轉化組患者年齡、應用抗凝藥比例、積液密度高于腦脊液密度比例、創傷后達最大積液量時間、最大積液厚度和腦萎縮比例均高于未轉化組。進一步的單因素和多因素逐步法Logistic回歸分析顯示,積液密度高于腦脊液密度比例、創傷后達最大積液量時間長、最大積液厚度大和并發腦萎縮是創傷性硬膜下積液轉化為慢性硬膜下血腫的危險因素。積液密度高于腦脊液密度,提示積液中血液成分和蛋白質含量較高,其分解后形成的小分子炎性介質可以刺激硬腦膜邊緣層的纖維母細胞分泌IL-6和IL-8等細胞因子,這些細胞因子具有促進蛛網膜和硬腦膜生發層細胞增生的作用,進而逐漸形成積液包膜;同時,IL-8還可以誘導血管增生和促進炎性細胞浸潤、趨化,由于新生血管內皮尚不完整,而炎性細胞的浸潤使其通透性增加,從而導致包膜不斷滲血,逐漸形成慢性硬膜下血腫[14-15]。積液厚度越大、自然吸收時間越長,即可有充足的時間形成積液包膜,在積液包膜向血腫包膜移行過程中包膜表面新生毛細血管壁不完整,通透性增加,質地較脆,不斷滲血,逐漸形成慢性硬膜下血腫;同時,積液厚度越大、硬膜下腔間隙也越大、橋靜脈和蛛網膜顆粒靜脈受到的牽拉也越大,導致靜脈破裂出血,從而形成慢性硬膜下血腫。積液達最大量時距創傷時間越長,表明創傷性硬膜下積液長期處于進展期,蛛網膜破裂形成的活瓣缺口修復較慢,可有充足的時間形成包膜,包膜新生血管不斷滲血,從而形成慢性硬膜下血腫。創傷性硬膜下積液并發腦萎縮時,硬膜下腔間隙增大,使橋靜脈等的易損性增加,加之腦移動范圍增大,易引起蛛網膜撕裂和血管撕裂,從而形成慢性硬膜下血腫[16]。郭振宇等[17]認為,積液密度和積液厚度是創傷性硬膜下積液轉化為慢性硬膜下血腫的重要危險因素,與本研究結果相一致。有研究顯示,年齡也是創傷性硬膜下積液轉化為慢性硬膜下血腫的危險因素,這是由于高齡患者大多存在腦萎縮,使硬膜下腔間隙增大,橋靜脈和蛛網膜顆粒靜脈易牽拉出血[18];亦有研究顯示,創傷性硬膜下積液轉化為慢性硬膜下血腫的患者年齡跨度較大,年齡可能并非決定因素[17]。本研究單因素和多因素逐步法Logistic回歸分析亦證實,年齡并非創傷性硬膜下積液轉化為慢性硬膜下血腫的危險因素。
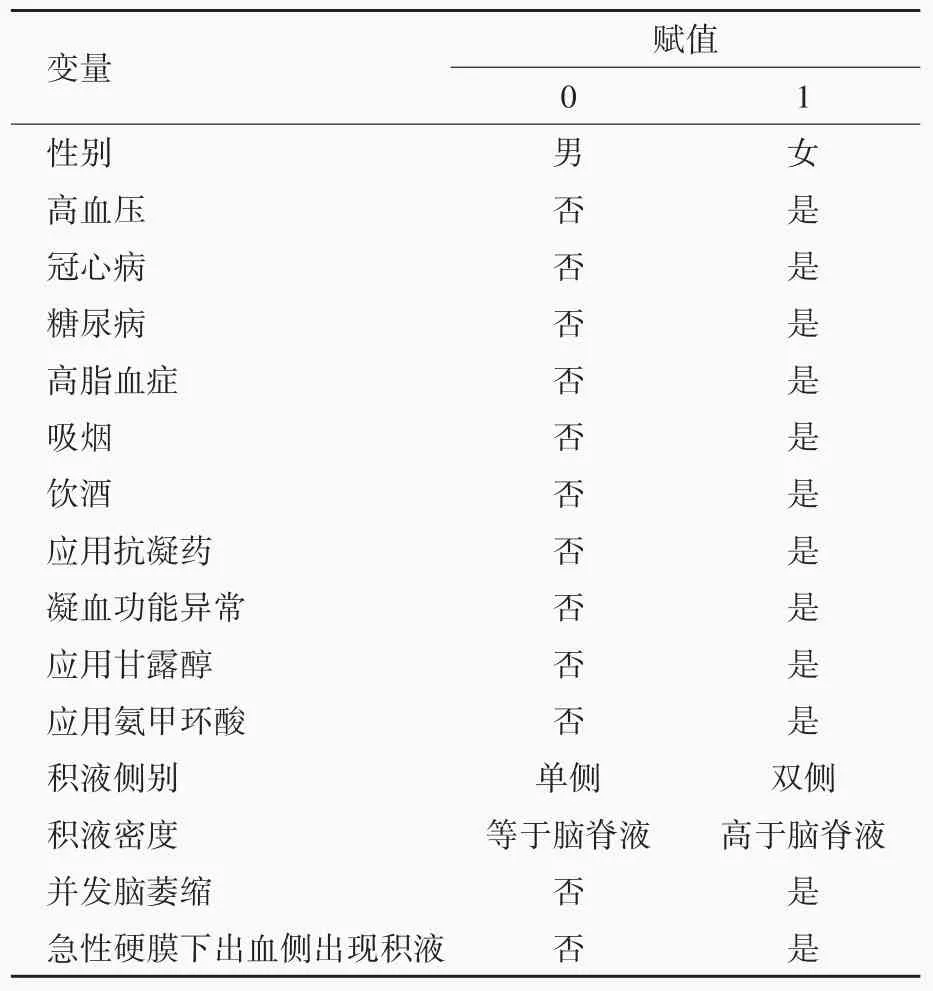
表3 創傷性硬膜下積液轉化為慢性硬膜下血腫相關危險因素的變量賦值表Table 3. Variable assignment table of risk factors related to the transformation of TSE into CSDH
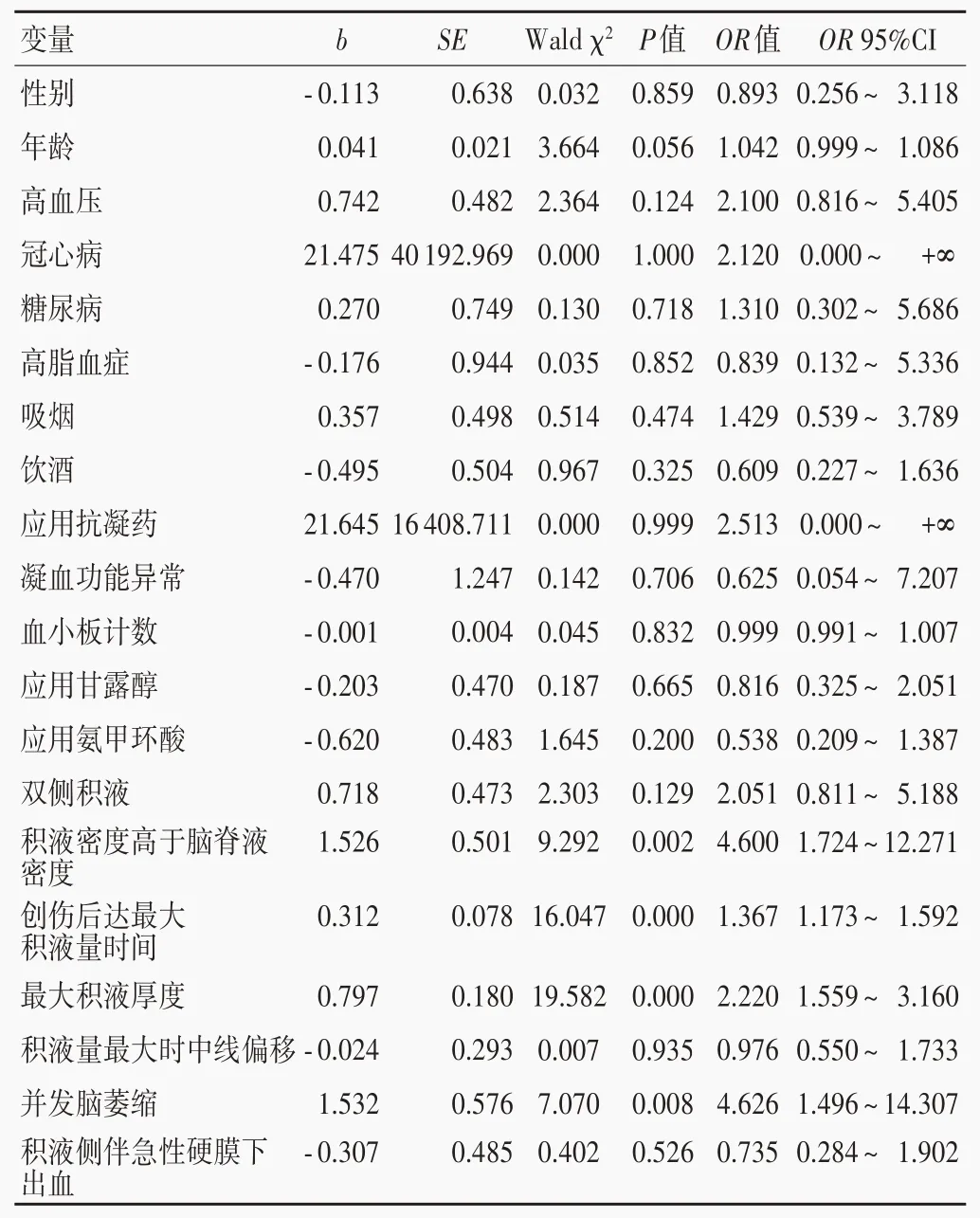
表4 創傷性硬膜下積液轉化為慢性硬膜下血腫相關危險因素的單因素Logistic回歸分析Table 4. Univariate Logistic regression analysis of the risk factors for the transformation of TSE into CSDH

表5 創傷性硬膜下積液轉化為慢性硬膜下血腫相關危險因素的多因素逐步法Logistic回歸分析Table 5. Multivariate stepwise Logistic regression analysis of the risk factors for the transformation of TSE into CSDH
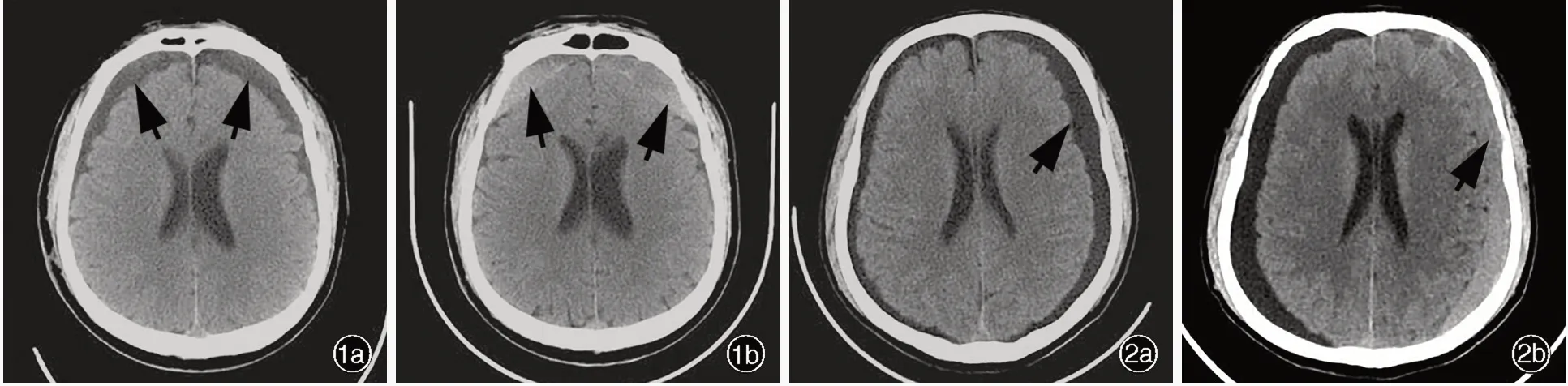
圖1 男性患者,60 歲。臨床診斷為顱腦創傷伴創傷性硬膜下積液,硬膜下積液量于創傷后第12 天達峰值。頭部CT 檢查所見1a 雙側額葉積液密度高于腦脊液(箭頭所示) 1b 創傷后第69天雙側額葉硬膜下可見高密度影(箭頭所示),提示積液轉化為慢性硬膜下血腫 圖2 男性患者,67 歲。臨床診斷為顱腦創傷伴創傷性硬膜下積液,硬膜下積液量于創傷后第10天達峰值。頭部CT 檢查所見 2a 左側額顳頂葉積液厚度為16 mm(箭頭所示) 2b 創傷后第63 天左側額顳頂葉積液轉化為慢性硬膜下血腫(箭頭所示)Figure 1 A 60-year-old male patient was clinically diagnosed with TSE after TBI, and the volume of subdural effusion reached its maximum on the 12th day after TBI. Head CT findings The density of bilateral frontal subdural effusion was higher than that of CSF(arrows indicate, Panel 1a). The subdural effusion transformed into CSDH on the 69th day after TBI (arrows indicate, Panel 1b).Figure 2 A 67-year-old male patient was clinically diagnosed with TSE after TBI, and the volume of subdural effusion reached its maximum on the 10 day after TBI. Head CT findings The thickness of subdural effusion in the left frontotemporal and parietal lobes was about 16 mm (arrow indicates, Panel 2a). The subdural effusion transformed into CSDH on the 63th day after TBI (arrow indicates,Panel 2b).
綜上所述,創傷性硬膜下積液易轉化為慢性硬膜下血腫,積液密度高于腦脊液密度比例、創傷后達最大積液量時間長、最大積液厚度大和并發腦萎縮是創傷性硬膜下積液轉化為慢性硬膜下血腫的危險因素。因此,積液長期處于進展期、積液密度高于腦脊液密度、最大積液厚度較大、并發腦萎縮的創傷性硬膜下積液更易轉化為慢性硬膜下血腫,對于此類患者應指導其做好定期復查和隨診,做到早期診斷、及時治療。
利益沖突無

