基于化學核心素養的模型建構研究
——以原電池的工作原理為例
鄭曉爍, 林曉明,覃路珠
(1.汕頭市潮師高級中學,廣東 汕頭515154; 2.華南師范大學, 廣州510006)
1 設計思想
1.1 觀念取向
在原電池工作原理的學習中主要體現了實驗觀和模型觀。
1.2 對核心素養的看法
《普通高中化學課程標準(2017年版)》(以下簡稱新課標)指出證據推理與模型認知是高中化學的五大核心素養之一。本節課是基于證據推理與模型認知的視角認識原電池工作的本質特征,探究銅鋅原電池電流的形成過程,認識到原電池中微粒運動和物質變化的內在聯系。在探究過程中建立了實驗模型(宏觀模型)、符號模型以及微觀模型,并運用三大模型解釋原電池工作原理的本質和規律,幫助學生建立認知模型,鍛煉學生觀察實驗現象、分析實驗、歸納總結實驗以及對模型的認知能力,培養學生的創新精神。
2 教材分析
2.1 教材知識體系分析
原電池的工作原理是高中化學人教版必修2第二章第二節化學能與電能的內容,其他兩節分別是化學能與熱能、化學反應的速率和限度。教材先學習化學能與熱能,再學習化學能與電能,符合由易到難,由簡單到復雜的過程,也符合學生的認知水平[1]。
第二節化學能與電能又包括化學能與電能的相互轉化以及化學發展中的化學電源這兩部分內容,先學習原理,再學習原理的應用,將理論應用于實踐,符合社會價值觀,體現出了具有科學態度與社會責任的化學核心素養。人教版第二章教材知識體系以及人教版第二章第二節教材知識體系分別如圖1、圖2所示。
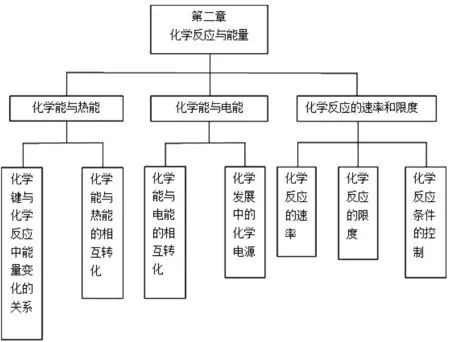
圖1 人教版第二章教材知識體系Fig.1 Knowledge system of the second chapter of PEP teaching materials
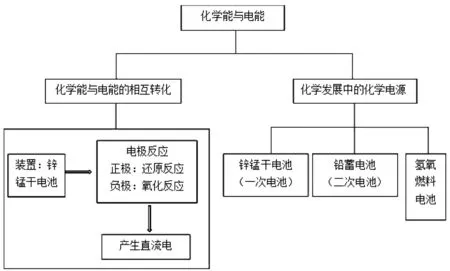
圖2 人教版第二章第二節教材知識體系Fig.2 Knowledge system of the second section in the second chapter of PEP teaching materials
2.2 課標分析
課程目標:能用符號表征物質及其變化;能認識化學現象與模型之間的關系[2]。課程內容:意識到化學科學研究需要實證與推理,注重宏觀與微觀的聯系;以原電池為例知曉化學能可以轉化為電能,從氧化還原反應的角度初步認識原電池的工作原理。
3 學生情況分析
通過初中化學、必修一、必修二第一章、必修二第二章第一節的學習,學生已經了解了氧化還原反應、物質的反應、微粒的運動、能量的轉化等知識點,為原電池的學習奠定了基礎。圍繞學生已有的對氧化還原反應知識的了解開展應用性探究更符合學生認知的螺旋式發展規律[3]。
4 教學與評價目標
4.1 教學目標
(1)了解原電池原理,能寫出簡單原電池的電極反應式和電池反應式。(2)通過探究銅鋅原電池電流的形成過程,認識到原電池中的微粒運動和物質變化之間的內在聯系,逐漸滲透模型觀。(3)通過學習原電池的功能,讓學生體會原電池的工作原理對于解決問題的意義,提高學生聯系生活學習化學并將化學應用于生活的意識。
4.2 評價目標
(1)通過書寫原電池的電極反應式和電池反應式診斷并發展學生對原電池工作原理的認知水平。(2)通過分析原電池中微粒運動和物質變化之間的內在聯系診斷并發展學生的模型認知水平[4]。(3)通過運用原電池的工作原理解決實際問題診斷并發展學生聯系生活學習化學并將化學應用于生活的能力。
5 教學重點與難點
教學重點:了解原電池的工作原理,學會書寫相應的電極反應式及電池反應方程式[5]。
教學難點:解釋原電池工作的微觀原理。
6 教學流程
6.1 新課導入
教師:我們先來觀看一個奧斯卡最佳短片《更換電池》的小片段。在視頻中,陪伴老奶奶吃飯的機器人突然停止工作了,為什么老奶奶換上電池后機器人就滿血復活了呢?
學生:因為電池有電。
教師:嗯,對,其實是因為電池中的化學能轉化為電能,為機器人提供了能量。那么原電池是如何工作的呢?本節課讓我們圍繞電池的化學能是如何轉化為電能這個核心問題來探究原電池的工作原理。
設計意圖;讓學生了解電源在生活中的應用,引入新課,提高學生的學習興趣,激發學生的學習熱情。
6.2 模型準備
教師:先是進行模型準備,老師事先已經準備好了儀器和試劑。從老師的左邊往右數分別是鋅片、銅片、導線、賀卡、水槽、稀硫酸以及小支架。老師先連接實驗裝置,往水槽中導入稀硫酸溶液,接著用導線連接銅、鋅電極以及賀卡。現在,老師把兩個電極放入稀硫酸溶液中,請同學們認真觀察實驗現象。實驗模型見圖3。

圖3 實驗模型Fig.3 Experiment model
設計意圖:通過實驗和科學探究過程使學生增強探索化學反應原理的興趣[6],并逐漸滲透實驗觀。
6.3 模型設疑
教師:現在有請一位同學回答看到什么現象。
學生:賀卡響了,銅片上和鋅片上有氣泡產生。
教師:嗯,很棒,請坐。賀卡響了,說明有什么產生呀?
學生:電流。
教師:看來同學們都非常認真思考。現在老師就有幾個疑問了,導線中為什么會產生電流呢?鋅片和銅片上產生的氣體又是什么呢?根據金屬活潑性順序,銅排在氫離子后面,并不能和氫離子反應生成氫氣,那么銅片上產生的氣體是什么呢?
設計意圖:(1)通過實驗培養學生的觀察能力與分析思維能力。(2)引導學生以問題為中心,學會發現問題并解決問題。
6.4 模型求解
教師:有請一位同學回答第一個問題,導線中為什么會產生電流呢?
學生:由于原電池發生了氧化還原反應,有電子轉移,所以產生了電流。
教師:謝謝,請坐。更加準確來說是因為原電池發生了氧化還原反應,有電子轉移,電子定向移動,所以產生了電流。第一個問題我們已經順利解決了,那第二個問題來了,鋅片上產生的氣體是什么呢?
學生:H2。
教師:我們知道,根據金屬活潑性順序,鋅排在氫離子前面,因此,鋅可以和氫離子反應生成氫氣。可是,根據金屬活潑性順序,銅排在氫離子后面,并不能和氫離子反應生成氫氣,那么銅片上產生的氣體又是什么呢?
學生:H2、O2、SO2。
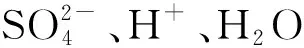
學生:書寫方程式。
鋅片(負極):Zn-2e-=Zn2+(氧化反應)
銅片(正極):2H++2e-=H2↑(還原反應)
總:Zn+2H+=Zn2++H2↑
教師:同學書寫正確,看來同學們都能從氧化還原反應的角度分析兩極的反應情況以及原電池的總反應。通過觀察兩個電極的反應方程式我們可以發現,銅片上產生的氣體是溶液中的H+被還原生成的H2。接下來,我們來觀看一個模擬動畫,一起來分析原電池工作的微觀原理。觀看動畫,我們可以發現,鋅極失去電子,發生氧化反應,生成鋅離子,銅極的氫離子得到電子,發生還原反應,生成氫氣,電子由鋅極流向銅極,電流由銅極流向鋅極,形成外電路。由于鋅極失去電子后,電極表面帶正電荷,銅極得到電子后,電子表面帶負電荷。由于異性電荷相互吸引,所以陽離子向銅極移動,陰離子向鋅極移動,形成內電路,從而形成閉合回路,將化學能轉化為電能。在這里需要注意的是,電子只能在導線中移動,不能在溶液中移動,而離子只能在溶液中移動,不能在導線中移動,即電子不下水,離子不上岸。
設計意圖:(1)知道化學反應可以實現化學能與其他能量形式的轉化,以原電池為例認識化學能可以轉化為電能,從氧化還原反應的角度初步認識原電池的工作原理。(2)能用符號表征物質及其變化。(3)通過書寫原電池的電極反應式和電池反應式診斷并發展學生對原電池工作原理的認知水平。(4)通過分析原電池工作的微觀原理,認識到原電池中的微粒運動和物質變化之間的內在聯系,逐漸滲透模型觀。
6.5 模型認知
教師:在前面的學習中我們建立了三種模型,先在模型準備環節建立了實驗模型,觀察實驗現象,發現賀卡響了,鋅片上和銅片上都有氣體產生,分析了電流產生的原因以及銅片上產生的氣體是何種物質。實驗模擬模型見圖4。
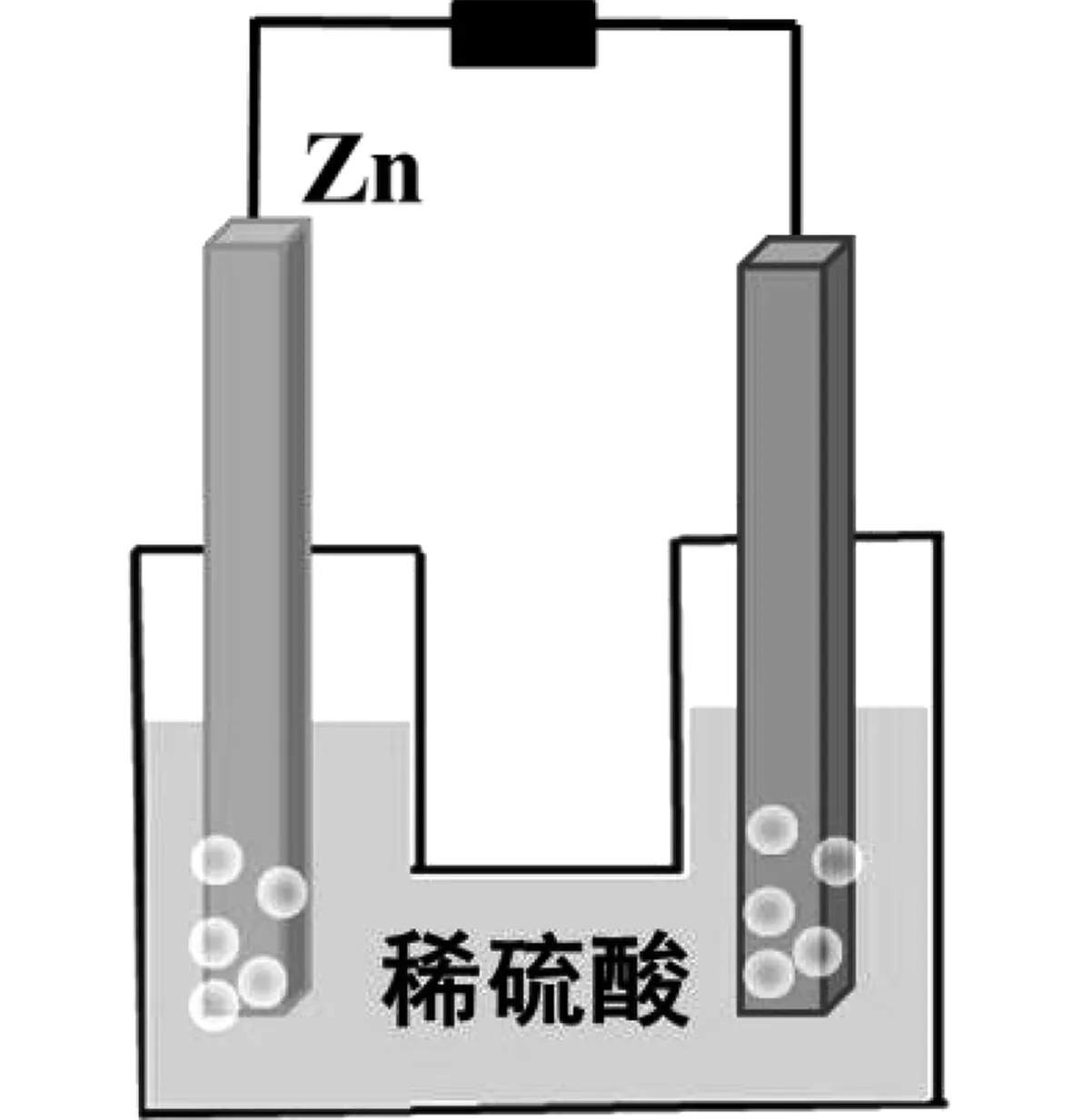
圖4 實驗模擬模型Fig.4 Experiment simulation model
接著在模型求解環節從氧化還原反應的角度分析銅鋅兩個電極的反應以及原電池的總反應,并書寫相應的方程式,建立了符號模型:
鋅片(負極):Zn-2e-=Zn2+(氧化反應)
銅片(正極):2H++2e-=H2↑(還原反應)
總:Zn+2H+=Zn2++H2↑
建立符號模型后,通過觀看模擬動畫分析體系中的微粒移動情況,即外電路的電子移動情況和內電路的離子移動情況,并建立微觀模型,見圖5。
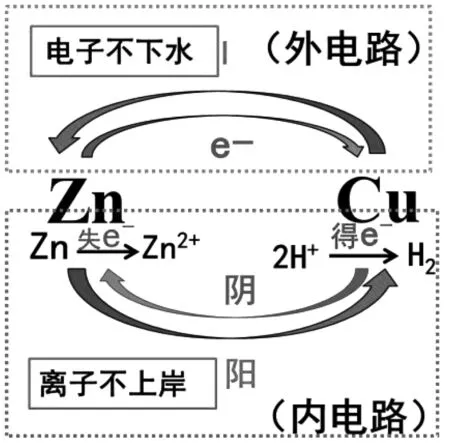
圖5 微觀模型Fig.5 Micro model
設計意圖:(1)幫助學生認識化學現象與模型之間的關系,培養學生的模型認知能力。(2)學會用三重表征策略學習電化學知識,樹立正確的電化學問題分析思維方法。
6.6 課堂小結
教師:現在,讓我們對本節課所學習的知識點進行總結。本節課我們圍繞化學能如何轉化為電能這一核心問題展開學習,并運用模型構建的思想在四個教學環節中建立了實驗模型、符號模型以及微觀模型這三種模型,然后進行三重表征,解釋了原電池的工作原理,即原電池工作的本質是發生氧化還原反應。鋅極失去電子,發生氧化反應,生成鋅離子,發生氧化反應的一極是負極。銅片附近的氫離子得到電子,發生還原反應,生成氫氣,發生還原反應的一極是正極。導線中的電子定向移動,電子由鋅極流向銅極,電流由銅極流向鋅極,形成外電路。溶液中的陰、陽離子也發生定向移動,陽離子由鋅極流向銅極,陰離子由銅極流向鋅極,形成內電路,從而形成閉合回路,將化學能轉化為電能。課堂小結思維導圖見圖6。
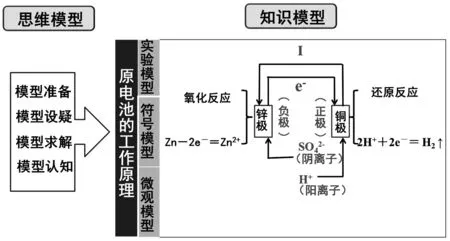
圖6 課堂小結的思維導圖Fig.6 Mind mapping of class summary
7 課后習題
牛刀小試:請寫出圖示原電池的電極反應方程式以及總反應方程式。
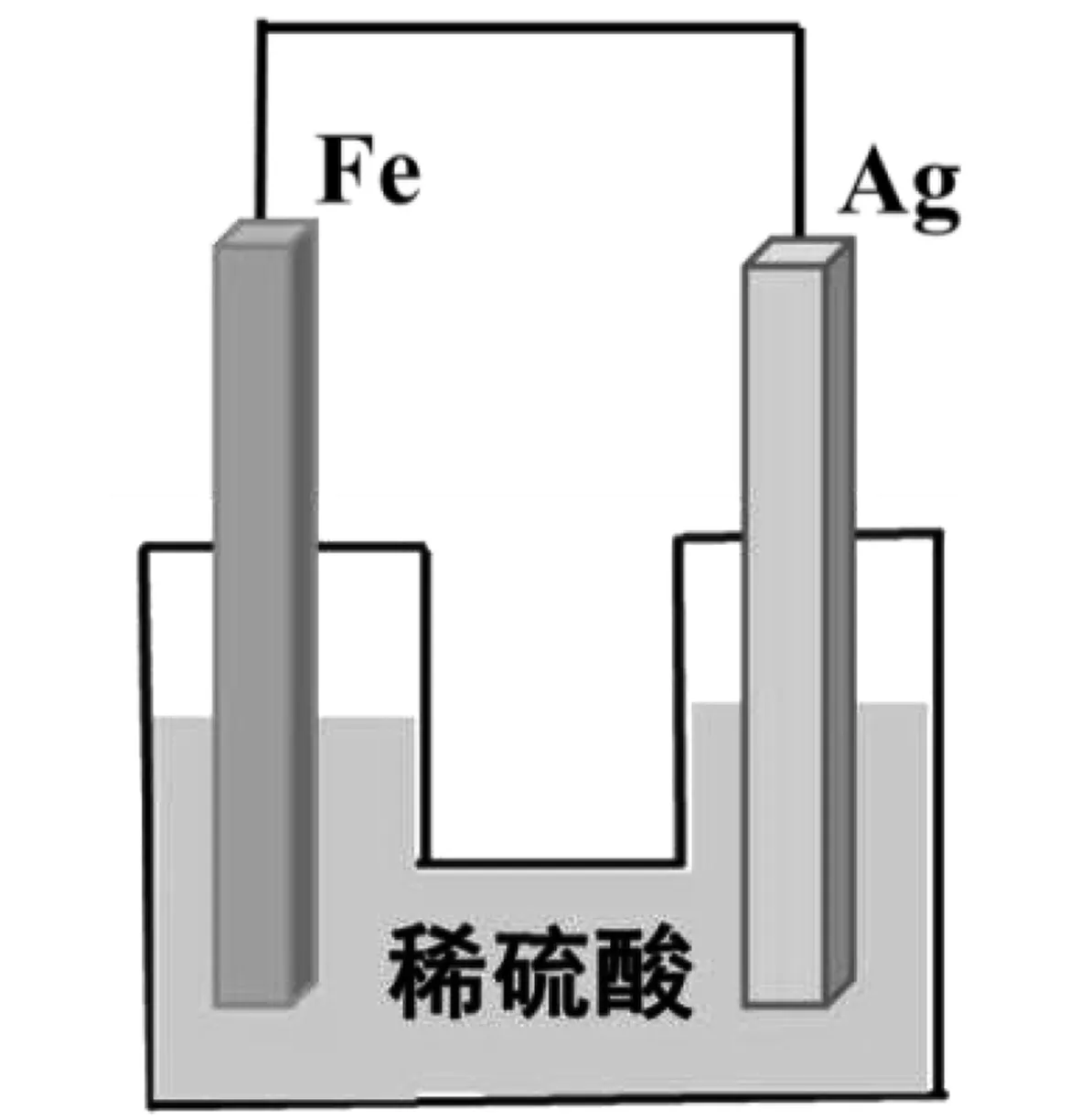
圖7 牛刀小試題目Fig.7 Quiz
知識提升:我們學習知識不僅要會解決課堂上的問題,還要會解決生活中的問題。現在,實驗室有兩片未知的金屬片a和b,請問如何應用原電池原理比較兩種未知金屬a和b的活動性強弱?
設計意圖:應用課堂所學的知識讓學生體會原電池的工作原理對于解決問題的意義,提高學生聯系生活學習化學并將化學應用于生活的意識。
8 流程思路與亮點特色
本節課以新課標為標準,滲透證據推理與模型認知的化學核心素養。本節課設有新課導入、模型準備、模型設疑、模型求解、模型認知、課堂小結以及模型應用七個教學環節,在七個教學環節中運用了模型認知教學策略以及三重表征教學策略;在學習過程中滲透實驗觀及模型觀;在模型求解環節提升證據推理與模型認知的化學核心素養;在多個環節設計問題情境,引導學生分析問題、解決問題,培養學生觀察、發現問題、分析問題和解決問題的能力。

