肺磨玻璃結節患者浸潤性病變及間變性淋巴瘤激酶基因突變的影響因素分析


[摘要]目的 分析肺磨玻璃結節(GGN)患者浸潤性病變及間變性淋巴瘤激酶(ALK)基因突變的影響因素。方法 選取我院腫瘤科2015年1月~2018年1月收治的80例疑似ALK基因突變肺GGN患者作為研究對象,其中浸潤前病變30例,浸潤性病變50例;ALK基因正常組患者36例,基因突變組患者44例,以病理結果作為金標準,分析浸潤前病變、浸潤性病變患者的病理狀態以及ALK基因突變之間的差異,研究GGN侵襲性、ALK基因突變的影響因素。結果 浸潤前病變和浸潤性病變的形態(毛刺征、分葉征、胸膜凹陷或牽拉征、支氣管充氣征或空泡征)、GGN大小、相對CT值、CT值、體積和質量比較,差異有統計學意義(P<0.05);Logistic回歸分析顯示,GGN質量(β=2.190,OR=8.935,95%CI:7.446~10.722)、體積(β=1.781,OR=5.936,95%CI:4.841~7.278)、CT值(β=1.709,OR=5.523,95%CI:4.694~6.499)、相對CT值(β=1.684,OR=5.387,95%CI:3.690~7.864)、大小(β=1.762,OR=5.824,95%CI:5.264~6.324)、毛刺征(β=1.594,OR=4.923,95%CI:4.184~5.793)、分葉征(β=1.665,OR=5.286,95%CI:4.153~6.727)、胸膜凹陷或牽拉征(β=1.606,OR=4.983,95%CI:4.413~5.627)、支氣管充氣征或空泡征(β=1.794,OR=6.013,95%CI:5.191~6.966)是浸潤性病變的影響因素(P<0.05);ROC曲線顯示,病灶質量≥0.276 g診斷GGN浸潤性敏感度為80.0%(24/30),特異性為94.0%(47/50),ROC曲線下面積為0.872。基因突變組和基因正常組的GGN大小、體積、質量和侵襲性比較,差異有統計學意義(P<0.05);Logistic回歸分析顯示,質量(β=2.059,OR=7.838,95%CI:5.380~11.419)、體積(β=1.936,OR=6.931,95%CI:5.036~9.540)、大小(β=1.781,OR=5.936,95%CI:4.450~7.918)、侵襲性(β=1.635,OR=5.129,95%CI:4.031~6.528)是ALK基因突變的影響因素(P<0.05);GGN質量、體積和大小診斷ALK基因突變的最佳臨界值分別為0.256 g、565.6 mm3、10.4 mm,ROC曲線下面積為0.803、0.781、0.755。結論 ALK基因突變是肺GGN的侵襲的重要影響因素,高分辨率CT(HRCT)征象對于輔助預測GGN侵襲性、ALK基因突變具有重要價值。
[關鍵詞]肺磨玻璃結節;肺腺癌;侵襲性;高分辨率CT;間變性淋巴瘤激酶;診斷;影響因素
[中圖分類號] R814.42? ? ? ? ? [文獻標識碼] A? ? ? ? ? [文章編號] 1674-4721(2020)5(c)-0015-05
Influencing factors analysis of infiltrative lesion and anaplastic lymphoma kinase gene mutation in patients with lung ground glass nodule
LIU Ning
Department of Radiology, Northern District General Hospital, Liaoning Province, Shenyang? ?110016, China
[Abstract] Objective To analyze the influencing factors of infiltrative lesion and anaplastic lymphoma kinase (ALK) gene mutation in patients with lung ground glass nodule (GGN). Methods A total of 80 lung GGN patients suspected with ALK gene mutation admitted to oncology department of our hospital from January 2015 to January 2018 were selected as the research objects, including 30 cases with pre-infiltration lesions and 50 cases with infiltration lesions, 36 patients in normal ALK gene group, 44 patients in the gene mutation group. The pathological results were used as the gold standard to analyze the differences between the pathological status of patients with pre-infiltration lesions and infiltration lesions, as well as ALK gene mutations, and to study the influencing factors of GGN invasion and ALK gene mutations. Results There were statistically significant differences in morphology (hair prick sign, lobular sign, pleural indentation or stretch sign, bronchial inflation sign or vacuole sign), size, relative CT value, CT value, volume and mass between pre-infiltration lesions and infiltration lesions (P<0.05). Logistic regression analysis showed that GGN mass (β=2.190, OR=8.935, 95%CI: 7.446-10.722), volume (β=1.781, OR=5.936, 95%CI: 4.841-7.278), CT value (β=1.709, OR=5.523, 95%CI: 4.694-6.499), relative CT value (β=1.684, OR=5.387, 95%CI: 3.690-7.864), size (β=1.762, OR=5.824, 95%CI: 5.264-6.324), hair prick sign (β=1.594, OR=4.923, 95%CI: 4.184-5.793), lobular sign (β=1.665, OR=5.286, 95%CI: 4.153-6.727), pleural indentation or stretch sign (β=1.606, OR=4.983, 95%CI: 4.413-5.627), bronchial inflation sign or vacuole sign (β=1.794, OR=6.013, 95%CI: 5.191-6.966) were influencing factors of infiltrative lesions (P<0.05). The ROC curve showed that the sensitivity of lesions ≥0.276 g to diagnose GGN infiltration was 80.0% (24/30), the specificity was 94.0% (47/50), and the area under the ROC curve was 0.872. There were statistically significant differences in GGN size, volume, mass, and invasion between the gene mutation group and the normal gene group (P<0.05). Logistic regression analysis showed that mass (β=2.059, OR=7.838, 95%CI: 5.380-11.419), volume (β=1.936, OR=6.931, 95%CI: 5.036-9.540), size (β=1.781, OR=5.936, 95%CI: 4.450-7.918), and invasion (β=1.635, OR=5.129, 95%CI: 4.031-6.528) were the influencing factors of ALK gene mutation (P<0.05). The optimal cut-off values for ALK gene mutations diagnosed by GGN mass, volume and size were 0.256 g, 565.6 mm3 and 10.4 mm, respectively, and the areas under the ROC curve were 0.803, 0.781 and 0.755. Conclusion The mutation of ALK gene is an important factor affecting the invasion of GGN. High-resolution CT (HRCT) signs are of great value in the prediction of the invasion of GGN and the mutation of ALK gene.
[Key words] Lung ground glass nodule; Lung adenocarcinoma; Invasive; High-resolution CT; Anaplastic lymphoma kinase; Diagnosis; Influencing factors
肺癌是死亡率最高的惡性腫瘤,肺磨玻璃結節(ground glass nodule,GGN)是肺腺癌的主要CT征象[1]。隨著肺癌CT篩查的廣泛應用及人類健康意識的提高,肺GGN的檢出率增加[2],患者心理負擔加重。事實上,GGN進展由非典型腺瘤性增生(atypical adenomatous hyperplasia,AAH)、原位腺癌(adenocarcinoma in situ,AIS)、微浸潤腺癌(microinvasive adenocarcinoma,MIA)向浸潤性腺癌(invasive adenocarcinoma,IA)方向演變,侵襲性和惡性程度增加,而浸潤前病變(AAH/AIS)手術治愈率接近100%[3],因此,若術前CT征象能夠有效評估GGN的浸潤性,對于治療方案選擇、療效評估和改善預后具有重要作用。然而,無論AAH-AIS-MIA-IA,影像學上均表現為部分實性結節或純磨玻璃結節(pure ground glass nodule,pGGN),單靠形態學診斷較為困難[4]。隨著醫學影像學技術的發展,尤其是高分辨率CT(high-resolution CT,HRCT)逐漸用于肺部疾病診斷,GGN的浸潤性診斷已成為GGN病理學亞型診斷研究熱點。間變性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)是肺腺癌的主要突變基因,可促進AAH-AIS-MIA-IA過程的演變[5]。本研究分析肺GGN中ALK突變的影響因素,探討HRCT征象在肺GGN侵襲性診斷中的價值,現報道如下。
1資料與方法
1.1一般資料
選取我院腫瘤科2015年1月~2018年1月收治的80例疑似ALK基因突變肺GGN患者作為研究對象,男43例,女37例,年齡37~70歲,平均(54.3±3.2)歲;GGN直徑3.5~22.3 mm,平均(10.5±3.6)mm;單發結節62例,多發結節18例(僅納入1個結節);15例有吸煙史,65例無吸煙史;依據國際肺腺癌分類標準[6],浸潤前病變30例,包括7例AAH,23例AIS。浸潤性病變50例,包括18例MIA,32例IA;臨床表現:28例體檢意外發現,34例咳嗽/咳痰,41例胸痛或不適,2例咯血。本研究經我院醫學倫理委員會批準。
納入標準:①經肺葉切除術、楔形切除術或肺段切除術;②經術后病理證實;③實性成分最大徑<5 mm的部分實性結節或最大徑<3 cm的pGGN;④自愿參與本研究,并簽署知情同意書。
排除標準:①合并其他惡性腫瘤;②囊腔樣的GGN型肺癌;③慢性炎癥或纖維化病變;④彌漫性肺磨玻璃影;⑤GGN無薄層圖像;⑥術前行穿刺活檢或放化療。
1.2方法
1.2.1 HRCT掃描? 患者一次屏氣,采用64層螺旋CT掃描儀(型號:Discovery CT750 HD,美國GE公司)全胸部掃描,從肺尖掃至腎上腺水平,掃描參數:管電壓/管電流為120 kV/270 mAs,螺距0.984,機架旋轉時間0.6 s/rots,層厚1.25 mm,層間距0.8 mm。以碘海醇(濃度為300 mg/ml)為對比劑,按1.5 ml/kg劑量注射,采用壓力注射器經肘靜脈注射,速度為3 ml/s,采用高分辨率和標準算法重建,并進行多平面重組。肺窗的窗位/窗寬為-550 HU/1500 HU,縱隔窗的窗位/窗寬為50 HU/350 HU,記錄原始圖像。
將原始圖像導入PACS圖像處理系統(柯達公司),由兩名5年以上胸部疾病影像診斷的醫生閱片,測量病灶大小、邊緣形態、內部結構、鄰近結構和相對CT值。然后再將圖像導入CT工作站,由兩名經驗豐富的放射科醫生采用LungV-CAR標記GGN,依據圖像上GGN周圍情況確定邊緣清晰情況,是否貼近胸膜或緊鄰血管,由軟件自動分割和顯示GGN圖像,記錄體積。采用質量=體積×(1100+CT值)/106計算GGN質量。
1.2.2 ALK基因檢測? 取手術切除的病灶,甲醛固定,石蠟包埋,切片。從切片中提取DNA,采用NanoDrop2000分光光度計檢測DNA濃度,達到50 mg/L時,經PCR擴增,在PyroMark焦磷酸測序儀上測序分析,檢測ALK基因突變情況。
1.3觀察指標及評價標準
1.3.1浸潤性病變單因素分析? 分別對浸潤前病變和浸潤性病變的形態(毛刺征、分葉征、胸膜凹陷或牽拉征、支氣管充氣征或空泡征)、GGN大小、相對CT值、CT值、體積和質量的差異進行比較。
1.3.2浸潤性病變二元Logistic回歸及ROC曲線分析? 分別對以上差異性指標進行多因素分析,同時采用ROC曲線對患者的診斷效能進行分析。
1.3.3 ALK基因突變檢測結果分析? 分別對浸潤前病變和浸潤性病變的ALK基因突變情況進行對比分析。
1.3.4 ALK基因突變單因素分析? 分別對基因突變組和基因正常組的GGN大小、體積、質量和侵襲性進行對比分析。
1.3.5 ALK基因突變二元Logistic回歸及ROC曲線分析? 采用二元Logistic回歸及ROC曲線對ALK基因突變的因素進行分析。
1.4統計學方法
采用SPSS 19.0統計學軟件進行數據分析,計量資料用均數±標準差(x±s)表示,兩組間比較采用t檢驗;計數資料采用率表示,組間比較采用χ2檢驗;采用二元Logistic回歸分析研究浸潤性病變、ALK基因突變的影響因素,采用ROC曲線分析各因素對侵襲性、ALK基因突變的預測效果,以P<0.05為差異有統計學意義。
2結果
2.1浸潤性病變的單因素分析
浸潤前病變和浸潤性病變的性別、年齡、病灶位置、邊緣限制征形態比較,差異無統計學意義(P>0.05);浸潤前病變和浸潤性病變的形態(毛刺征、分葉征、胸膜凹陷或牽拉征、支氣管充氣征或空泡征)、GGN大小、相對CT值、CT值、體積和質量比較,差異有統計學意義(P<0.05)(表1)。
2.2浸潤性病變的二元Logistic回歸分析
以浸潤性病變為因變量,以毛刺征、分葉征、胸膜凹陷或牽拉征、支氣管充氣征或空泡征、大小、相對CT值、CT值、體積和質量為協變量,進行二元Logistic回歸分析,結果顯示,質量、體積、CT值、相對CT值、GGN大小、毛刺征、分葉征、胸膜凹陷或牽拉征、支氣管充氣征或空泡征是鑒別浸潤前病變和浸潤性病變重要的因素(P<0.05)(表2)。
2.3浸潤性病變ROC的曲線分析
ROC曲線分析顯示,病灶質量≥0.276 g診斷肺GGN浸潤性敏感度為80.0%(24/30),特異性為94.0%(47/50),ROC曲線下面積為0.872(圖1,封三)。
2.4 ALK基因突變檢測結果
ALK基因檢測顯示,ALK基因突變44例,浸潤性病變42例,浸潤前病變2例;ALK基因正常36例,浸潤性病變8例,浸潤前病變28例。ALK基因突變患者中,外顯子23突變34例,外顯子24突變14例。
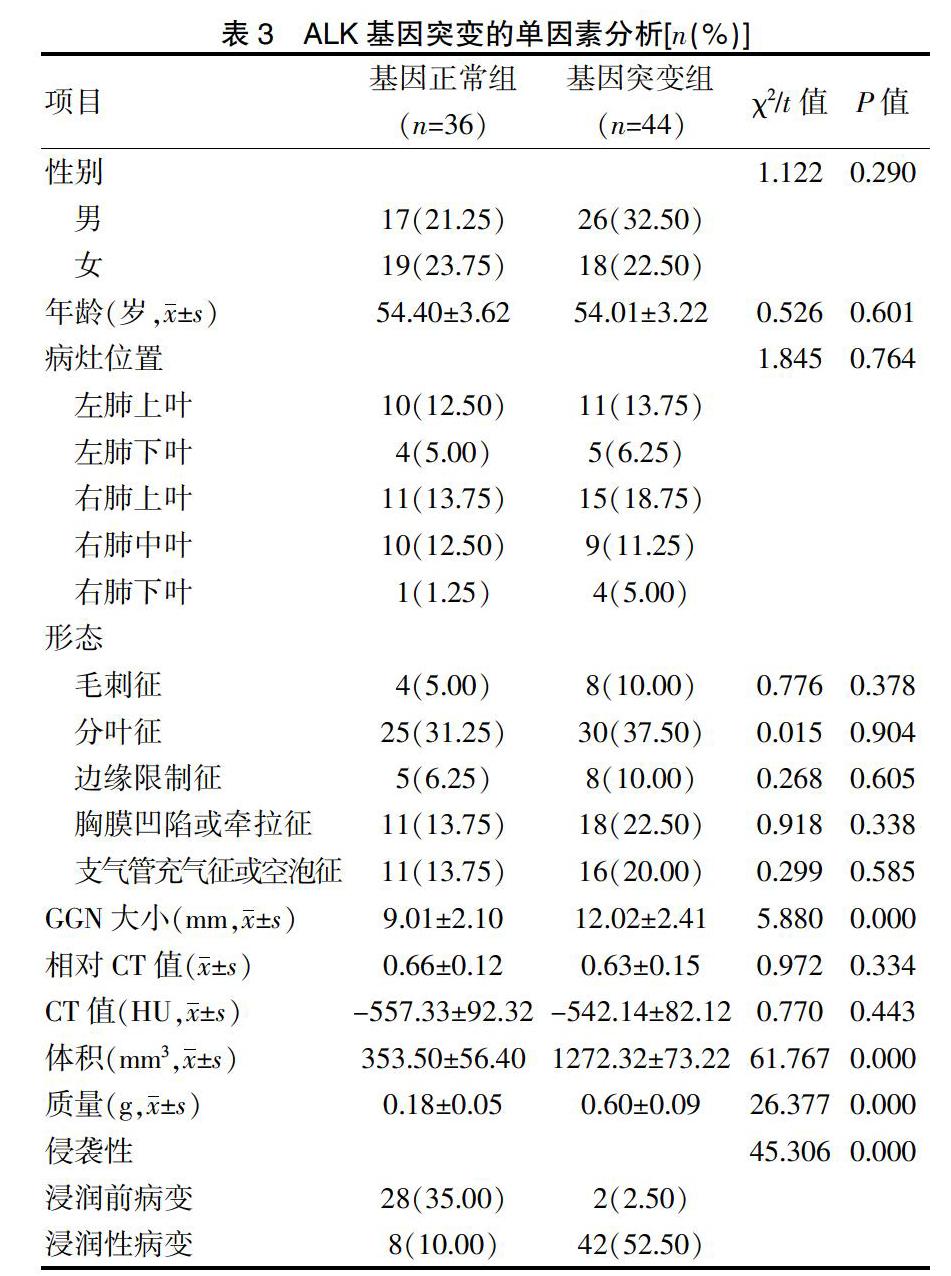
2.5 ALK基因突變的單因素分析
基因突變組和基因正常組的年齡、性別、病灶位置、形態、相對CT值、CT值比較,差異無統計學意義(P>0.05);基因突變組和基因正常組的GGN大小、體積、質量和侵襲性比較,差異有統計學意義(P<0.05)(表3)。
2.6 ALK基因突變的二元Logistic回歸分析
以基因突變為因變量,以GGN大小、體積、質量和侵襲性為協變量,進行二元Logistic回歸分析,結果顯示,GGN大小、體積、質量和侵襲性與ALK基因突變密切相關(P<0.05)(表4)。
2.7 ALK基因突變的ROC曲線分析
ROC曲線分析表明,病灶質量≥0.256 g診斷ALK基因突變敏感度為72.7%(32/44),特異性為77.8%(28/36),ROC曲線下面積為0.803;病灶體積≥565.6 mm3診斷ALK基因突變敏感度為65.9%(29/44),特異性為66.8%(24/36),ROC曲線下面積為0.781;病灶大小≥10.4 mm診斷ALK基因突變敏感度為61.3%(27/44),特異性為61.1%(22/36),ROC曲線下面積為0.755(圖2,封三)。
3討論
肺腺癌存在異質性,不同病理和分期患者治療方式不同。研究顯示,肺腺癌的侵襲性與肺GGN的良惡性密切相關,因此,診斷肺腺癌GGN的侵襲性是肺癌診治中的關鍵環節[7]。
3.1 HRCT征象預測GGN侵襲性的價值
GGN從磨玻璃成分向實性成分的演變是一個動態過程,無明確的界限,因此GGN侵襲性診斷較為困難[8]。據報道[9],GGN的浸潤程度與部分HRCT征象相關,包括毛刺征、空氣支氣管征、病灶邊緣特征等。有研究[10]認為病灶邊緣征象能夠反映病灶潛在的病理特性,其中毛刺征是腫瘤向血管、支氣管或小葉間隔浸潤所致,分葉征是由病灶各部分生長速度不均勻所致,分葉征、毛刺征出現提示惡性程度增高。此外,胸膜凹陷征的病理學機制與病灶內纖維組織收縮和胸腔積液形成所致有關[11],支氣管充氣征的病理基礎為GGN內含氣和擴張的細支氣管。本研究中,單因素和Logistic回歸分析結果證實了上述觀點。
GGN病灶直徑/體積是評估腫瘤T分期的關鍵指標,直徑/體積越大,分期越晚,IA的可能性越高[12]。相關文獻[13]顯示非浸潤性腺癌的CT值顯著低于浸潤性病變,提示高CT值病變侵襲性和惡性程度增強。Kim等[14]報道病灶質量0.472 g是作為IAC、AIS/MIA區分的臨界值;本研究中,GGN質量診斷侵襲性的臨界值為0.276 g,OR值為8.935,ROC曲線下面積為0.872,提示GGN質量診斷病灶侵襲性效果良好。本研究臨界值較低,可能與納入病例不限定GGN的最小徑有關。
3.2 GGN侵襲性與ALK基因突變的關系
基因突變與影像學結合能解釋腫瘤影像學的復雜性和多樣性,并可預測某些影像特征與基因的關系。ALK基因是目前已知的肺腺癌的主要突變基因,在肺腺癌發病機制中扮演著重要角色,但國內關于肺腺癌與ALK基因突變的關系較少。有研究[15]顯示,ALK基因抑制劑能夠有效延長患者生存期,是肺腺癌進展的驅動基因,可作為肺腺癌浸潤性評估的分子生物標志。本研究中,ALK基因突變和正常患者的肺腺癌浸潤性比較,差異有統計學意義(P<0.05),提示ALK基因突變與肺腺癌浸潤性相關,ALK基因突變可促進GGN的生長,導致GGN的侵襲性增加。
3.3 HRCT征象預測ALK基因突變的價值
HRCT征象與EGFR基因突變密切相關,但尚無與ALK基因突變的相關性研究報道[16-17]。本研究中,基因突變組和基因正常組的GGN大小、體積、質量比較,差異有統計學意義(P<0.05);GGN質量、體積和GGN大小診斷ALK基因突變的最佳臨界值分別為0.256 g、565.6 mm3、10.4 mm,ROC曲線下面積為0.803、781、0.755,提示GGN大小、體積、質量可反映ALK基因突變情況,預測GGN的惡性程度。有研究[18-20]顯示,浸潤性病變的ALK突變率高于非浸潤性病變,ALK基因突變病灶有乳頭狀、黏液分泌型、篩網狀或腺泡樣等特征,因而具有較大的體積和質量,故可用于ALK基因突變的預測。
綜上所述,GGN的侵襲性以及ALK基因突變與HRCT征象如病灶大小、體積、質量等密切相關,對于輔助預測GGN侵襲性、ALK基因突變具有重要價值。對于臨床不能獲得ALK基因檢測結果的病例,可通過HRCT征象輔助判別。但受樣本量限制,本研究結果有待于前瞻性、擴大化的中心試驗驗證。
[參考文獻]
[1]宋彪,閔旭紅,陳武,等.肺磨玻璃結節早期肺腺癌EGFR相關CT臨床相關分析[J].實用癌癥雜志,2019,34(2):215-218,234.
[2]盧濤,陳韻彬,劉向一.肺磨玻璃結節的HRCT征象及病理分期對比分析[J].中國CT和MRI雜志,2017,15(7):40-43.
[3]李西,肖湘生,于紅,等.CT圖像紋理特征分析對肺部純磨玻璃結節侵襲性的診斷價值[J].山西醫藥雜志,2016, 45(12):1411-1414.
[4]盧俊.肺磨玻璃結節診斷及處理策略研究新進展[J].臨床普外科電子雜志,2019,7(1):25-32.
[5]張緒超,陸舜,張力,等.中國間變性淋巴瘤激酶(ALK)陽性非小細胞肺癌診斷專家共識(2013版)[J].中華病理學雜志,2013,42(6):402-406.
[6]Lee HY,Lee SW,Lee KS,et al.Role of CT and PET imaging in predicting tumor recurrence and survival in patients with lung adenocarcinoma:a comparison with the International Association for the Study of Lung Cancer/American Thoracic Society/European Respiratory Society classification of lung adenocarcinoma[J].J Thorac Oncol,2015,10(12):1785-1794.
[7]李瓊,范麗,顧亞峰,等.三維平均CT值和PET/CT最大標準化攝取值預測磨玻璃密度結節型肺腺癌侵襲性的研究[J].實用放射學雜志,2016,32(6):867-870.
[8]張宏,丁必彪,魏恒樂,等.高分辨率CT對肺純磨玻璃結節侵襲性的預測價值[J].臨床放射學雜志,2019,38(3):436-440.
[9]張海健.探討肺部磨玻璃結節的HRCT征象及其病理分期的關系[J].影像研究與醫學應用,2018,2(22):180-181.
[10]游小風,徐偉華.肺內孤立性磨玻璃密度結節良惡性病灶的MSCT鑒別征象及其病理學基礎[J].中國CT和MRI雜志,2017,15(12):57-59.
[11]褚志慧,牛放,牛玉軍.兩種肺CT磨玻璃結節的特點與肺腺癌病理分型的關系[J].解放軍醫學院學報,2016,37(12):1267-1269.
[12]李雪梅,武剛.肺局灶性磨玻璃結節的高分辨CT表現與病理對照分析[J].哈爾濱醫科大學學報,2016,50(1):67-70.
[13]秦福兵,陸友金.純磨玻璃結節定量CT鑒別肺浸潤性腺癌與浸潤前病變和微浸潤腺癌[J].中國醫學計算機成像雜志,2016,22(1):22-26.
[14]Kim HR,Ahn JR,Lee JG,et al.The impact of cigarette smoking on the frequency of and qualitative differences in KRAS mutations in Korean patients with lung adenocarcinoma[J].Yonsei Med J,2013,54(4):865-874.
[15]吳標,莊武,黃誠,等.ALK融合基因陽性晚期肺腺癌克唑替尼耐藥后治療的效果分析[J].臨床腫瘤學雜志,2018, 23(8):716-720.
[16]婁和南,趙曉丹,張亮,等.周圍型浸潤性肺腺癌EGFR基因突變與CT征象及病理的相關性[J].實用放射學雜志,2016,32(12):1856-1860.
[17]肖旻,徐秋貞.磨玻璃結節肺腺癌CT征象與病理分類及 EGFR,ALK 基因突變相關性的研究進展[J].東南大學學報(醫學版),2017,36(3):500-503.
[18]鄧雙雙,高慧,王錄美,等.肺癌EGFR和EML4-ALK基因突變與臨床病理特征的關系[J].中國腫瘤臨床與康復,2019,26(4):396-400.
[19]譚培蘭,張曉林,柏輝,等.計算機輔助CT圖像特征在磨玻璃結節早期肺癌診斷中的應用[J].癌癥進展,2019,17(16):1946-1948,1952.
[20]王煒華,孫希文,袁明遠.高端高分辨薄層CT在早期肺腺癌診斷篩查中的應用[J].檢驗醫學與臨床,2019,16(7):865-869,873.
(收稿日期:2020-01-17? 本文編輯:任秀蘭)
[作者簡介]劉寧(1984-),女,遼寧彰武人,碩士,主治醫師,研究方向:放射影像診斷

