間充質(zhì)干細(xì)胞來源外泌體促心肌梗死血管新生及其機制研究進展
張 燁,肖 軼,余國龍
(中南大學(xué)湘雅醫(yī)院心血管內(nèi)科,中國湖南長沙410008)
血管新生(angiogenesis)是生長發(fā)育、傷口愈合、腫瘤生長與轉(zhuǎn)移的重要機制,也是腦梗死、心肌梗死、周圍血管疾病等缺血性疾病的重要治療方法。間充質(zhì)干細(xì)胞(mesenchymal stem cells,MSCs)廣泛存在于骨髓、脂肪、臍帶血、外周血、尿液等多種組織和體液中,具有多向分化及自我更新潛能,同時可分泌多種營養(yǎng)因子。在心肌梗死促血管新生治療方面,MSCs等干細(xì)胞移植被認(rèn)為是一項非常有前景的治療措施。但目前MSCs等干細(xì)胞移植治療心肌梗死面臨諸多難以克服的問題,例如:移植的干細(xì)胞在宿主體內(nèi)存活率很低;在靶區(qū)域僅發(fā)現(xiàn)極少部分移植的干細(xì)胞;MSCs等干細(xì)胞移植存在潛在的免疫排斥風(fēng)險;經(jīng)冠脈或靜脈大劑量移植干細(xì)胞有血栓栓塞風(fēng)險。盡管如此,實驗與臨床研究顯示MSCs等干細(xì)胞移植對心肌梗死仍有明顯的治療效應(yīng)[1]。近期研究發(fā)現(xiàn)MSCs可能主要通過分泌外泌體,促進心肌梗死后血管新生,從而改善心肌梗死后心肌缺血缺氧微環(huán)境[2]。外泌體(exosome)是由細(xì)胞分泌的具有雙層膜結(jié)構(gòu)的直徑40~150 nm的小囊泡,通過向相鄰細(xì)胞或者遠端靶組織傳遞微RNA(microRNA,miRNA)、蛋白質(zhì)等生物活性物質(zhì),介導(dǎo)細(xì)胞間信號傳遞,從而發(fā)揮心臟保護作用[3~4]。多項實驗研究發(fā)現(xiàn)外泌體通過促血管新生、抗炎作用、抑制細(xì)胞凋亡、減少細(xì)胞自噬等多種機制,改善心肌梗死后心功能[2,5~6]。外泌體的低毒性、高度穩(wěn)定性、低免疫原性、高效轉(zhuǎn)運性、與MSCs治療的等效性,以及納米級大小、雙層膜結(jié)構(gòu)、易制取儲存等特性,使其成為極有潛力的心肌梗死后促血管新生的新治療手段或藥物轉(zhuǎn)運載體。本文主要對MSCs來源外泌體促進心肌梗死區(qū)域血管新生,以及其相關(guān)機制和國內(nèi)外研究現(xiàn)狀作一綜述。
1 血管新生
血管新生是機體內(nèi)一個復(fù)雜的過程,需要內(nèi)皮細(xì)胞與周圍細(xì)胞、微環(huán)境的相互作用。病理狀態(tài)下,血管新生功能紊亂,可造成血管滲漏或新生血管成熟障礙。血管新生的機制包括血管生成(angiogenesis)、動脈生成(arteriogenesis)和血管發(fā)生(vasculogenesis)。狹義的血管新生過程指血管生成。血管生成是指從已有的毛細(xì)血管或毛細(xì)血管后微靜脈發(fā)展而形成新的血管,主要包括:激活期血管基底膜降解;血管內(nèi)皮細(xì)胞的激活、增殖、遷移;重建形成新的血管和血管網(wǎng),是一個涉及多種細(xì)胞、多種分子的復(fù)雜過程[7]。血管生成細(xì)胞因子,如血管內(nèi)皮生長因子(vascular endothelial growth factor,VEGF)、成纖維細(xì)胞生長因子(fibroblast growth factor,FGF)和血小板衍生生長因子(platelet-derived growth factor,PDGF)等,可直接與受體結(jié)合或間接啟動受體激活,進而激活下游信號通路以形成新的毛細(xì)血管[8]。動脈生成是由已存在的小動脈互相吻合重建為功能性動脈,建立側(cè)支循環(huán),繞過血運中斷部位以改善遠端缺血組織血供。這一過程由狹窄血管處變化的流體剪切力觸發(fā)[9]。血管發(fā)生是指由內(nèi)皮祖細(xì)胞(endothelial progenitor cells)分化、結(jié)合形成新的血管叢。在胚胎發(fā)育時期,內(nèi)皮祖細(xì)胞遷移、分化并結(jié)合成簇,形成血島(blood islands),血島的外層細(xì)胞稱為成血管細(xì)胞(angioblasts),可進一步分化成內(nèi)皮細(xì)胞,形成原始血管叢[10]。缺血環(huán)境可以觸發(fā)出生后的血管發(fā)生,動員內(nèi)皮祖細(xì)胞,隨后內(nèi)皮祖細(xì)胞滲入損傷部位,分化為成熟的內(nèi)皮細(xì)胞或通過旁分泌信號調(diào)控預(yù)先存在的內(nèi)皮細(xì)胞,最終在損傷部位形成新生毛細(xì)血管網(wǎng)[11]。
2 外泌體傳遞生物活性物質(zhì)促心肌梗死區(qū)域血管新生機制
近期研究顯示,MSCs來源的外泌體主要通過傳遞促血管新生相關(guān)miRNA、蛋白質(zhì)等生物活性物質(zhì),調(diào)控下游血管新生相關(guān)通路的基因表達,增強內(nèi)皮細(xì)胞的增殖、遷移和成管能力(詳見表1)[12~18],促進心肌梗死區(qū)域血管新生,增加心肌缺血處營養(yǎng)物質(zhì)和氧氣的供應(yīng),從而改善心肌缺血區(qū)域血流灌注[12~14,16~17]。
2.1 促血管新生相關(guān)miRNA
miRNA是一類小的非編碼RNA,其通過與蛋白質(zhì)編碼相關(guān)的mRNA的3′端非編碼區(qū)中的互補序列相互作用,抑制蛋白質(zhì)翻譯或mRNA降解[19]。外泌體通過傳遞與血管新生相關(guān)miRNA,促進下游通路中血管新生相關(guān)的基因表達,或間接增強促血管新生相關(guān)蛋白質(zhì)的表達,從而促進心肌梗死區(qū)域血管新生[12~14]。
2.1.1 miRNA-21
miRNA-21是研究證據(jù)較多的具有心臟保護作用的miRNA,可以通過促血管新生、抗氧化應(yīng)激、抗細(xì)胞凋亡來保護心臟[20]。Wang等[12]研究發(fā)現(xiàn)MSCs來源的外泌體通過傳遞miRNA-21,調(diào)控多種與細(xì)胞凋亡/存活相關(guān)的靶基因的表達,包括抑制Peli1(pellino 1)、程序性細(xì)胞死亡因子4(programmed cell death factor 4,PDCD4)、FasL(Fas ligand)、第10號染色體缺失的磷酸酶及張力蛋白同源基因(phosphatase and tensin homologue deleted on chromosome ten,PTEN)等基因的表達,發(fā)揮抗心肌細(xì)胞凋亡的作用。在大鼠心肌梗死模型中,人子宮內(nèi)膜MSCs來源的外泌體通過傳遞miRNA-21,在降低PTEN表達的同時增強Akt表達,從而影響靶細(xì)胞內(nèi)PTEN/Akt信號通路,促進心肌梗死區(qū)域血管新生和心肌細(xì)胞存活。同時,該研究發(fā)現(xiàn)人子宮內(nèi)膜MSCs的促血管新生作用優(yōu)于骨髓MSCs(bone marrow MSCs,BMMSCs)、脂肪MSCs(adipose-derived MSCs,AdMSCs)。Qiao等[21]將來源于心力衰竭患者心肌細(xì)胞的外泌體(exosomes derived from the cardiac cells of patients with heart failure,FEXO)與正常心臟心肌細(xì)胞來源的外泌體進行比較,發(fā)現(xiàn)心力衰竭病理狀態(tài)改變了FEXO轉(zhuǎn)運的miRNA,同時FEXO內(nèi)miRNA-21-5p的含量明顯減少,而且FEXO促進內(nèi)皮細(xì)胞成管的能力明顯下降。有意思的是,FEXO的再生功能障礙可以通過過表達miRNA-21-5p來挽救,這對基因修飾工程外泌體的臨床運用具有指導(dǎo)意義。
2.1.2 miRNA-210
miRNA-210現(xiàn)已被證實是與血管新生相關(guān)的miRNA[13,22~24],可以促進心肌梗死區(qū)域血管新生,改善缺血心肌氧供[13,22]。持續(xù)表達miRNA-210的C57小鼠通過上調(diào)VEGF表達促進心肌梗死區(qū)域血管新生,且miRNA-210基因修飾小鼠在1年內(nèi)未觀察到致癌副作用[22]。缺氧環(huán)境中的MSCs來源的外泌體通過miRNA測序發(fā)現(xiàn),其miRNA-210含量較正常氧環(huán)境中的外泌體明顯增多,同時缺氧環(huán)境下機體可能通過缺氧誘導(dǎo)因子α(hypoxia inducible factor-1,HIF-α)活化中性鞘磷脂酶2(neutral sphingomyelinase 2,nSMase2),以提高外泌體分泌,從而顯著提高MSCs來源的外泌體的促血管新生能力[13]。此外,miRNA-210在外周動脈疾病、缺血性腦卒中等缺血性疾病中也具有促進血管新生的作用[23~24]。
2.1.3 miRNA-132
研究表明miRNA-132通過抑制p120RasGTP蛋白酶(p120 Ras GTPase)活化,促進cAMP應(yīng)答元件結(jié)合蛋白(cAMP response element binding protein,CREB)磷酸化,進而引起Ras蛋白(Ras protein)激活及促血管新生[25~26]。Ma 等[14]研究發(fā)現(xiàn)通過電穿孔技術(shù)將miRNA-132與外泌體結(jié)合后,miRNA-132可通過下調(diào)Ras p21蛋白活化子1(Ras p21 protein activator 1,RASA1)的表達,促進人臍靜脈血管內(nèi)皮細(xì)胞(human umbilical vein endothelial cells,HUVECs)及心肌梗死區(qū)域血管形成。
2.2 促血管新生相關(guān)蛋白質(zhì)
MSCs來源的外泌體除了可以向靶細(xì)胞傳遞miRNA,還可以傳遞具有促血管新生功能的蛋白質(zhì)。這些外泌體通過直接傳遞或者間接調(diào)控血管新生相關(guān)蛋白質(zhì)的表達[15~18],促進心肌梗死區(qū)域血管新生,從而改善缺血缺氧環(huán)境[16~17]。
2.2.1 促血管生成因子
缺氧狀態(tài)下人脂肪MSCs來源的外泌體可傳遞多種促血管生成因子(pro-angiogenic factors),如VEGF、表皮生長因子(epidermal growth factor,EGF)、堿性成纖維細(xì)胞生長因子(basic fibroblast growth factor,bFGF)、血管內(nèi)皮生長因子受體2/3(vascular endothelial growth factor receptor 2/3,VEGFR2/3)、單核細(xì)胞趨化蛋白2/4(monocyte chemotactic protein 2/4,MCP-2/4),促進體內(nèi)和體外的血管新生,其作用主要通過調(diào)節(jié)VEGF/VEGF-R信號通路完成。VEGF/VEGF-R信號通路可誘導(dǎo)血管新生相關(guān)基因表達,調(diào)節(jié)血管通透性,促進內(nèi)皮細(xì)胞遷移、增殖和存活,在調(diào)節(jié)血管新生中發(fā)揮關(guān)鍵作用[15]。
2.2.2 基質(zhì)衍生因子1
基質(zhì)衍生因子1(stromal-derived factor 1,SDF1)是組織修復(fù)和血管新生的關(guān)鍵趨化因子[27],在心肌梗死后起心臟修復(fù)作用[28]。在缺血缺氧環(huán)境下,SDF1/CXCR4通路相關(guān)蛋白質(zhì)表達增加,使基質(zhì)金屬蛋白酶9(matrix metalloproteinase 9,MMP9)的表達上調(diào),進而引起胞外信號調(diào)節(jié)激酶1/2(extracellular signal-regulated kinase 1/2,ERK 1/2)和PI3K/Akt通路相關(guān)蛋白質(zhì)的表達增加,最終促進缺血性腦卒中神經(jīng)元細(xì)胞恢復(fù)、內(nèi)皮細(xì)胞血管新生[29]。人臍帶血MSCs通過分泌外泌體傳遞SDF1,激活PI3K信號通路,促進內(nèi)皮細(xì)胞及心肌梗死周圍區(qū)域微血管生成[16]。
2.2.3 血小板衍生生長因子D
血小板衍生生長因子D(platelet-derived growth factor D,PDGF-D)主要在內(nèi)皮細(xì)胞和平滑肌細(xì)胞中表達,可促進內(nèi)皮細(xì)胞的增殖、遷移和血管生成[30]。甲狀腺激素T3通過上調(diào)PDGF/PDGFR-β表達,激活A(yù)kt通路,促進甲狀腺功能減退小鼠的心臟血管新生[31]。將Akt修飾的外泌體(Akt-Exo)與正常外泌體(Exo)進行比較發(fā)現(xiàn),Akt-Exo中PDGF-D蛋白的表達顯著增多,而VEGF、CD31和轉(zhuǎn)化生長因子-β(transforming growth factor-β,TGF-β)等蛋白質(zhì)的表達并無明顯差異,同時Akt-Exo中傳遞的PDGF-D通過與PDGFR-β受體結(jié)合促進心肌梗死區(qū)域血管新生,而且Akt-Exo在體外可促進內(nèi)皮細(xì)胞增殖、遷移和血管形成,并增加血管內(nèi)膜的形成[17]。
2.2.4 惡性腦腫瘤缺失蛋白1
惡性腦腫瘤缺失蛋白1(deleted in malignant brain tumors 1,DMBT1)是一種重要的細(xì)胞外基質(zhì)蛋白質(zhì),可與半乳糖凝集素-3(galectin-3)、EGF、VEGF和Dll4(delta-like 4)相互作用并調(diào)節(jié)Notch信號通路差異表達,從而促進內(nèi)皮細(xì)胞黏附、遷移、增殖和血管生成[32]。Chen等[18]研究發(fā)現(xiàn)人尿源性MSCs來源的外泌體(USC-Exos)通過傳遞DMBT1,增加內(nèi)皮細(xì)胞中VEGF-A和磷酸化Akt蛋白的表達,從而促進內(nèi)皮細(xì)胞及糖尿病小鼠皮膚傷口處的血管新生。
綜上所述,MSCs來源外泌體通過傳遞具有促內(nèi)皮細(xì)胞增殖、遷移和血管形成功能的miRNA或蛋白質(zhì)至心肌梗死區(qū)域,促進心肌梗死區(qū)域的血管新生。為了驗證外泌體傳遞的與促血管新生效應(yīng)相關(guān)的可能功能分子,利用基因干擾技術(shù)沉默親本細(xì)胞MSCs內(nèi)與血管新生相關(guān)的miRNA-21[12]、miRNA-21-3p[33]或蛋白質(zhì) PDGF-D[17]、DMBT1[18],結(jié)果發(fā)現(xiàn)外泌體介導(dǎo)的促血管新生作用僅部分減弱,并未完全消失,這說明外泌體可能通過傳遞多種促血管新生功能分子共同促進血管新生,并非轉(zhuǎn)運單一miRNA或蛋白質(zhì)促血管新生。目前,外泌體促心肌梗死血管新生的具體機制仍需進一步探究。
3 外泌體促血管新生功能在心肌梗死治療中的研究現(xiàn)狀
MSCs通過分泌外泌體的形式向心肌細(xì)胞或內(nèi)皮細(xì)胞傳遞生物活性物質(zhì),促進心肌梗死區(qū)域的血管新生,改善心肌梗死后的缺血缺氧微環(huán)境[2]。通過基因修飾手段增強外泌體介導(dǎo)的心臟修復(fù)作用[34~35],或?qū)⑼饷隗w與生物活性肽結(jié)合形成工程外泌體以靶向缺血心肌治療[36~40],是目前外泌體在心血管領(lǐng)域的熱點研究方向。
3.1 通過基因修飾增強外泌體促血管新生及心臟修復(fù)作用
外泌體可通過促進心肌梗死區(qū)域血管新生、抑制炎癥反應(yīng)、抗細(xì)胞凋亡、減少細(xì)胞自噬等多種機制減輕心肌梗死后的心肌纖維化,改善心臟功能。缺血缺氧等病理條件可以改變外泌體傳遞的內(nèi)容物并損害其再生能力[21]。通過基因修飾手段過表達外泌體中具有心臟保護作用的生物活性物質(zhì),如前文所述的miRNA或蛋白質(zhì),可增強外泌體介導(dǎo)的心臟保護作用,逆轉(zhuǎn)病理環(huán)境對外泌體再生能力的影響。Ni等[34]發(fā)現(xiàn)組織型基質(zhì)金屬蛋白酶抑制劑2(tissue matrix metalloproteinase inhibitor 2,TIMP2)修飾的人臍帶血MSCs來源的外泌體(exosomes derived from TIMP2-overexpressing human umbilical cord MSCs,huc-exoTIMP2)通過激活A(yù)kt/Sfrp2通路,可以抑制心肌細(xì)胞凋亡,促進血管生成,改善細(xì)胞外基質(zhì)重塑,從而改善心肌缺血。與正常huc-exo相比,huc-exoTIMP2增加了心肌梗死大鼠心肌中CD31+和凝集素免疫活性細(xì)胞的數(shù)量,促進了心肌梗死區(qū)域的血管新生。Wang等[35]發(fā)現(xiàn)熱休克蛋白20(heat shock protein 20,Hsp20)修飾的外泌體可以通過傳遞細(xì)胞保護性蛋白質(zhì),如磷酸化的Akt、超氧化物歧化酶1(superoxide dismutase 1,SOD1)和存活蛋白,減輕心肌氧化應(yīng)激反應(yīng),減少心肌纖維化,促進心臟血管新生,從而改善糖尿病性心肌病的心室重構(gòu),而且過表達的Hsp20還可以與腫瘤易感基因101(tumor susceptibility gene 101,Tsg101)蛋白直接相互作用,以促進心肌細(xì)胞中的外泌體生成。Ma等[17]研究發(fā)現(xiàn)與正常外泌體(Exo)相比,Akt修飾的外泌體(Akt-Exo)在體外可增強內(nèi)皮細(xì)胞的增殖、遷移、成管能力,在體內(nèi)也可明顯提高心肌梗死動物模型的左心室射血分?jǐn)?shù),改善心臟功能。
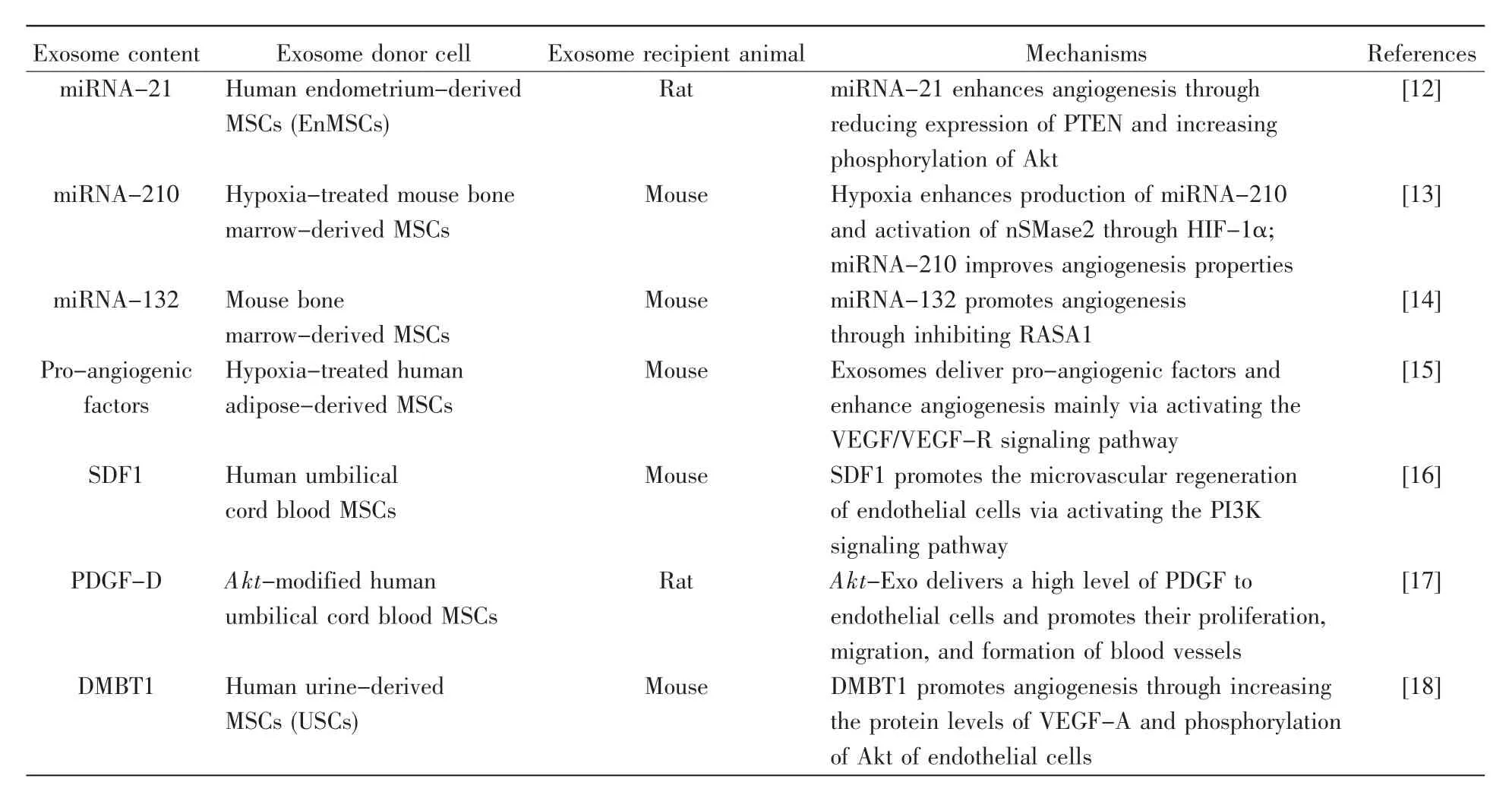
表1 MSCs來源外泌體促血管新生及機制Table 1 Exosomes derived from mesenchymal stem cells promote angiogenesis and its mechanisms
3.2 靶向心臟的工程外泌體促進血管新生
目前已有多項研究證明外泌體可以有效促進心肌梗死后血管新生。既往動物實驗多采用直接心內(nèi)注射或尾靜脈注射等方法傳遞外泌體。直接心內(nèi)注射需要嚴(yán)格的無菌環(huán)境及繁瑣的操作過程,臨床應(yīng)用困難。而且,相關(guān)研究報道心內(nèi)注射外泌體3 h后在心肌梗死區(qū)域很難檢測到熒光標(biāo)記的外泌體信號[36]。現(xiàn)有研究表明,經(jīng)尾靜脈注射傳遞的外泌體大部分經(jīng)肝臟攝取代謝[41],而通過靜脈注射大劑量外泌體來提高心臟攝取量的方法具有潛在的致血栓栓塞風(fēng)險。因此,如何有效傳遞外泌體及提高心臟靶器官對外泌體的攝取是目前外泌體實際臨床運用前急需解決的問題。
通過修飾親本細(xì)胞或分離后修飾組裝成工程外泌體,可有效靶向運輸外泌體至缺血心臟組織。PGN水凝膠(PGN hydrogel)可通過增強外泌體在心臟的保留和表達來促進心臟修復(fù)。與單純的外泌體相比,Exo-PGN水凝膠治療組在心梗后21 d仍能在缺血心臟組織中檢測到PKH-26標(biāo)記的外泌體信號,顯著提高了外泌體在心臟中的持續(xù)穩(wěn)定表達[36]。缺血心肌靶向肽(ischemic myocardiumtargeted peptide,IMTP)的肽段序列(CSTSMLKAC)可特異性與缺血心肌細(xì)胞結(jié)合[42],將IMTP與外泌體結(jié)合,可靶向運輸外泌體至缺血心臟[37~39],增強缺血心臟對外泌體的攝取,從而促進心肌梗死區(qū)域血管新生[37~38]。血小板納米囊泡或抗肌鈣蛋白I(cardiac troponin I,cTnI)抗體可靶向缺血損傷心肌[43~44],將其與外泌體結(jié)合形成工程外泌體,有助于外泌體靶向缺血心臟治療。RGD生物活性肽(Arg-Gly-Asp peptide)可以與位于血管腔表面的重要血管外基質(zhì)蛋白整合素 αvβ3(integrin αvβ3)特異性結(jié)合,Wang等[40]將外泌體與RGD生物活性肽結(jié)合形成工程外泌體,靶向運輸外泌體至血管腔表面,不僅可提高HUVECs對外泌體的攝取量,而且可增強VEGF分泌,從而促進HUVECs的增殖、血管形成能力。同時,將其與仿生納米顆粒SPIONs(superparamagnetic iron oxide nanoparticles)、糖代謝前體Ac4ManNAz(tetraacetylated N-azidoacetyl-D-mannosamine)結(jié)合,采用聚糖成像檢測技術(shù),成功追蹤到工程外泌體 (RGD-Ac4ManNAzexosomes)在體內(nèi)的促血管新生效應(yīng),即與未注射組相比,RGD-Ac4ManNAz-exosomes組體內(nèi)的新生血管長度明顯增加。
4 小結(jié)與展望
綜上所述,MSCs來源的外泌體通過傳遞miRNA、蛋白質(zhì)等生物活性物質(zhì),調(diào)控血管新生相關(guān)通路蛋白質(zhì)的表達,增強內(nèi)皮細(xì)胞的增殖、遷移和成管能力,促進心肌梗死區(qū)域血管新生,改善心肌梗死后缺血缺氧微環(huán)境,促進心肌梗死后心臟功能的恢復(fù)。基因修飾可有效增強外泌體的促血管新生及心臟保護作用,靶向缺血心肌的工程外泌體也可有效提高外泌體在心肌梗死區(qū)域的攝取及停留,從而增強外泌體的促血管新生作用。
MSCs來源外泌體作為無細(xì)胞性促血管新生治療手段,既保留了親本MSCs細(xì)胞的促血管新生特性,又成功避免了前文所述MSCs細(xì)胞移植治療的諸多困難。利用基因手段過表達外泌體傳遞的功能物質(zhì)或靶向缺血心臟治療,可以明顯增強外泌體的促血管新生及心臟保護作用。為了更好地利用外泌體的促血管新生功能,應(yīng)進一步研究外泌體傳遞的內(nèi)容物及其介導(dǎo)的分子生物學(xué)機制。同時,外泌體作為促血管新生藥物進入臨床試驗之前,仍有許多方面需要進一步完善和探究,例如:發(fā)掘新型材料進一步提高外泌體對缺血心臟的靶向性和促血管新生效應(yīng),延長外泌體在缺血心臟的停留時間;開發(fā)更高效、簡便的外泌體提取方法;運用聚糖成像[40]、磁共振成像[45]等高科技檢測技術(shù)在心肌梗死動物模型體內(nèi)進一步評估外泌體的促血管新生效應(yīng);評估MSCs來源外泌體長期促血管新生治療的有效性及是否存在潛在的致癌風(fēng)險等。盡管面臨許多挑戰(zhàn),但是外泌體仍然是極具潛力的促心肌梗死血管新生的治療手段。