柑橘潰瘍病抗性相關轉錄因子CitMYB20的功能
姚利曉,范海芳,張慶雯,何永睿,許蘭珍,雷天剛,彭愛紅,李強,鄒修平,陳善春
(西南大學/中國農業科學院柑桔研究所國家柑桔品種改良中心,重慶400712)
0 引言
【研究意義】柑橘潰瘍病(citrus bacterial canker,CBC)是一種由柑橘黃單胞桿菌柑橘亞種(Xanthomonas citrisubsp.citri,Xcc)引起的嚴重威脅我國柑橘產業的檢疫性細菌病害[1]。該病可引起柑橘落葉、落果和枯枝,降低果實的商品價值,給柑橘產業帶來巨大的經濟損失。篩選抗柑橘抗潰瘍病關鍵基因、利用基因工程培育抗病品種是一種從根本上解決柑橘病害的有效途徑[2]。【前人研究進展】柑橘轉基因抗潰瘍病育種有兩種策略,一種策略是通過敲除宿主植物的柑橘潰瘍病菌敏感基因以防止病原的侵染[3];另外一種方法是在柑橘中過表達外源抗性基因,使用的外源基因主要有昆蟲抗菌肽基因[4]、植物抗性基因[5-7]和轉錄因子[8-10]等。轉錄因子通過激活或抑制其他轉錄因子和下游基因的表達影響植物對病原的敏感性和抗性。R2R3-MYB轉錄因子家族含有2個保守的MYB結構域,是植物界最大的轉錄因子家族之一。植物基因組中含有多個R2R3-MYB成員,如地錢中21個、擬南芥中126個、楊樹中192個、蘋果中222個[11-14]。MYB基因在植物抵御有害昆蟲、真菌、細菌和病毒侵染的過程中具有重要作用。小麥 MYB基因TaMYB19、TaMYB29和TaMYB44在蚜蟲取食時表達量顯著上升,通過調控韌皮部防衛反應抵抗蚜蟲的危害[15];而另一種小麥 MYB基因TaPIMP2通過調控植物抗性基因PR1a、PR2、PR5和PR10的表達,對麥根腐平臍蠕孢(Bipolaris sorokiniana)具有抗性[16];楊樹MYB115激活原花青素合成基因,增加次生代謝物含量,從而增強植物對楊樹潰瘍病菌(Dothiorella grefaria)的抗性[17];甜櫻桃PacMYBA在擬南芥中異源表達,可增強轉基因株系對丁香假單胞菌番茄致病變種(Pseudomonas syringaepv.tomato,Pst)DC3000 的抗性[18];SlMYB28被干擾株系中番茄黃化曲葉病毒(Tomato yellow leaf curl virus,TYLCV)含量降低,表明SlMYB28負調控 TYLCV的侵染過程[19]。【本研究切入點】柑橘中存在100多個R2R3-MYB轉錄因子基因[20-21],對其功能研究結果顯示,柑橘MYB轉錄因子調控花青素、木質素、類黃酮和黃酮醇等次生代謝產物的合成[22-25],在擬南芥中異源表達可增強轉基因植株的抗旱性[26]。但尚未見柑橘MYB基因參與生物學脅迫的相關報道。筆者所在實驗室前期轉錄組測序結果表明,柑橘 R2R3-MYB基因CitMYB20(Ciclev10005629m)在感染柑橘潰瘍病菌的甜橙中上調表達。【擬解決的關鍵問題】克隆不同柑橘品種CitMYB20基因序列和啟動子序列,分析CitMYB20在柑橘潰瘍病菌和不同外源植物激素誘導下的表達水平,并構建過表達載體和干擾載體,對轉基因株系進行抗病性評價,以期獲得新的抗潰瘍病相關候選基因。
1 材料與方法
試驗于2017年3月至2019年3月在國家柑桔品種改良中心完成。
1.1 材料與試劑
供試棗陽小葉枳(Poncirus trifoliata)、金彈金柑(Fortunella japonica)和晚錦橙(Citrus sinensis)均取自國家果樹種質重慶柑橘圃。柑橘潰瘍病菌由中國農業科學院柑桔研究所胡軍華博士提供。根癌農桿菌(Agrobacterium tumefaciens)感受態細胞EHA105、植物表達載體pLGNe、抑制表達中間載體pUCRNAi由筆者實驗室制備和保存。大腸桿菌(Escherichia coli)感受態細胞DH5α、T克隆載體pGEM-T Easy、DNaseI(RNase-free)和反轉錄試劑盒購自TaKaRa公司。植物總RNA提取試劑盒和植物DNA快速提取試劑盒購自北京艾德萊生物科技有限公司。NovoStart?SYBR qPCR SuperMix Plus試劑盒購自NovoProtein公司。
1.2 CitMYB20基因序列克隆
按照植物 RNA快速提取試劑盒說明書提取晚錦橙、棗陽小葉枳和金彈金柑成熟葉片的總RNA,進行反轉錄獲得 cDNA模板。使用 CitMYB20-F和CitMYB20-R引物對(表1),在高保真酶PrimeSTAR?Max DNA Polymerase作用下,94℃ 3 min;94℃ 30 s,58℃ 30 s,72℃ 1 min,35個循環;72℃延伸3 min獲得PCR產物。經加poly(A)尾,膠純化回收等操作后,將PCR產物與T載體連接,熱擊法轉化感受態DH5α。挑選菌液PCR檢測陽性的克隆送至擎科生物技術有限公司測序。
1.3 CitMYB20啟動子序列克隆
利用植物 DNA快速提取試劑盒從棗陽小葉枳和金彈金柑成熟葉片中提取DNA。PCR擴增體系同1.2,所用引物對為CitMYB20-F (P)和CitMYB20-R (P)(表1),退火溫度為 53℃, 延伸時間為 1.5 min。利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在線軟件對啟動子序列進行分析。
1.4 柑橘潰瘍病菌和外源激素對CitMYB20的誘導表達
選取棗陽小葉枳和金彈金柑的成熟葉片,在75%的酒精中消毒3—5 s,再用無菌水清洗3次,無菌脫脂棉將葉片擦干,無菌針在葉片表面刺孔形成傷口,在傷口處接種柑橘潰瘍病菌,對照組用水處理,28℃培養0、1、3、5 d,切取接種孔附近的葉片提取RNA。
用打孔器在消毒葉片上打孔,取葉圓片分別浸泡在 10 μmol·L-1水楊酸溶液、100 μmol·L-1茉莉酸甲酯溶液、10 μmol·L-1乙烯利溶液中,無菌水處理做對照。28℃下處理0、12、24、36、48 h收集葉圓片。
1.5 實時熒光定量PCR(qRT-PCR)分析
qRT-PCR 利用 NovoStart?SYBR qPCR SuperMix Plus試劑盒,所用引物為 CitMYB20-F (q)和CitMYB20-R (q),反應體系為12 μL,在ABI 7500熒光定量PCR儀上進行。反應條件為95℃ 1 min;95℃15 s,60℃ 1 min,40個循環。采用2-ΔΔCt(ΔCt=CtCitMYB20-Ctactin)方法計算相對表達量。
1.6 過表達載體構建
對連接有CitMYB20的T載體和植物雙元表達載體pLGNe進行BamH I和EcoR I雙酶切,膠回收酶切產物,16℃連接過夜,將連接產物pLGNe-CitMYB20轉化感受態DH5α。隨機挑選克隆經PCR、雙酶切驗證正確后,提取過表達載體pLGNe-CitMYB20,利用電轉化法轉化感受態農桿菌EHA105備用。
1.7 干擾載體構建
利用引物對 CitMYB20-F (g)和 CitMYB20-R (g)(表1)擴增CitMYB20基因干擾片段。利用限制性內切酶AscI和SwaI對PCR產物和中間載體pUCRNAi進行雙酶切,連接后將干擾片段正向插入中間載體生成pUCRNAi1-CitMYB20。將干擾片段的PCR產物和pUCRNAi1-CitMYB20同時用BamH I和XbaI雙酶切,連接后將干擾片段反向插入,構建載體pUCRANi-CitMYB20。將 pUCRANi-CitMYB20和 pLGNe用KpnI和SalI雙酶切,將干擾片段插入pLGNe成功構建干擾載體 pLGNe-pUCRANi-CitMYB20,并轉入根癌農桿菌EHA105備用。
1.8 根癌農桿菌法轉化和轉基因植株檢測
在無菌條件下去掉棗陽小葉枳種子表皮,放置于MS固體培養基上28℃暗培養。待外植體生長到一定高度后,將上胚軸切成1 cm左右的莖段。將含有過表達載體 pLGNe-CitMYB20的根癌農桿菌菌液和含有干擾載體 pLGNe-pUCRANi-CitMYB20的根癌農桿菌菌液及空載體菌液分別侵染上胚軸莖段。用無菌濾紙將莖段擦干,擺放在MS固體共培養基上,置于26℃培養箱中暗培養3 d,轉到MS固體篩選培養基中,28℃暗培養7 d左右,隨后轉移至光照培養箱中28℃培養。待新芽長出后,切取少量組織進行 GUS染色。將GUS染色陽性芽嫁接到網室的資陽香橙砧木上。提取轉基因植株葉片DNA進行PCR檢測,驗證CitMYB20是否整合到柑橘基因組中。提取轉基因植株葉片RNA進行qRT-PCR,檢測CitMYB20的表達量。
1.9 柑橘潰瘍病抗性評價
按照賈瑞瑞等[27]的描述,采用體外接種法對轉基因植株進行柑橘潰瘍病抗性評價。從每株轉基因植株上選取9張葉片,在75%的酒精中消毒3—5 s,再用無菌水清洗 3次,無菌脫脂棉擦干葉片,用無菌針在葉片表面刺14—20個小孔,移液器吸取1 μL柑橘潰瘍病菌懸浮液(1×105cfu/mL)滴加在小孔處。對照組為非轉基因植株,28℃條件下培養10 d,拍照,用ImageJ Launcher軟件統計病斑面積。Excel處理數據,SPSS 20進行差異顯著性分析,P<0.05表示差異顯著。

表1 所用引物序列Table 1 The primer sequences
2 結果
2.1 不同品種CitMYB20基因序列和啟動子序列的克隆與分析
分別從晚錦橙、棗陽小葉枳和金彈金柑中擴增CitMYB20的開放閱讀框序列,在GenBank數據登錄號為 MN689607、MN689608和 MN689609。序列分析結果表明,來源于上述 3個柑橘品種的CitMYB20的核苷酸序列相似度為98.60%,氨基酸序列相似度為97.64%,表明該基因在不同柑橘品種間序列差異甚微。
分別從棗陽小葉枳和金彈金柑中克隆CitMYB20起始密碼子上游1 500 bp的啟動子序列(GenBank數據登錄號為MN689610和MN689611),其核苷酸序列的相似性為95.16%。軟件預測結果顯示,該基因在抗性品種金彈金柑和易感品種棗陽小葉枳中都含有參與植物激素應答相關的順式作用元件ABRE(響應脫落酸)、CGTCA-motif(響應茉莉酸甲酯)、TGACG-motif(響應茉莉酸甲酯)。但是金彈金柑中含有 TCA-element(響應水楊酸)而棗陽小葉枳中缺少這一元件(表2)。
2.2 柑橘潰瘍病菌對CitMYB20的誘導表達
取易感品種棗陽小葉枳和抗性品種金彈金柑的成熟離體葉片接種柑橘潰瘍病菌菌液。qRT-PCR結果表明易感品種棗陽小葉枳在接種柑橘潰瘍病菌 0、1、3和5 d時,CitMYB20的表達量與對照相比無明顯變化;而抗性品種金彈金柑CitMYB20的相對表達量則上調幅度明顯,尤其是在接種柑橘潰瘍病菌5 d時表達量為對照的2.5倍(圖1)。
2.3 激素對CitMYB20的誘導表達
CitMYB20對不同外源激素的應答反應不盡相同。其中,水楊酸和茉莉酸甲酯對CitMYB20誘導表達結果相似,在兩種激素處理后,金彈金柑中CitMYB20的相對表達量均呈現出先升高后降低的趨勢,處理24 h相對表達量最高;而棗陽小葉枳中該基因的相對表達量均為先降低后升高,處理24 h相對表達量最低。乙烯利處理后,CitMYB20的表達量在棗陽小葉枳中12 h達到最高值,之后表達量降低;而在金彈金柑中其表達量呈現緩慢下降的趨勢(圖2)。

表2 CitMYB20啟動子順式作用元件Table 2 Cis-acting elements in promoter of CitMYB20 predicted through PlantCARE

圖1 柑橘潰瘍病菌對CitMYB20的誘導表達Fig. 1 The expression of CitMYB20 induced by Xcc

圖2 不同激素對CitMYB20的誘導表達分析Fig. 2 Expression analysis of CitMYB20 induced by different hormones
2.4 CitMYB20過表達和干擾植株抗性分析
經菌液PCR檢測、質粒BamH I/EcoR I雙酶切鑒定和測序結果分析,確認CitMYB20的開放閱讀框成功插入pLGNe載體,獲得長度為13.47 kb的pLGNe-CitMYB20植物過表達載體。另外選取CitMYB20的特異性片段,將抑制表達片段分別正、反向連接到pUCRNAi上得到中間載體pUCRNAi-CitMYB20,隨后連接到pLGNe載體上,經KpnI/SalI雙酶切驗證和測序分析,獲得長度為14.80 kb的pLGNe-pUCRNAi-CitMYB20干擾載體。
利用根癌農桿菌法轉化棗陽小葉枳上胚軸,將GUS染色呈藍色的陽性芽嫁接到無菌的晚錦橙實生苗上。待嫁接芽抽出新芽后,將試管苗嫁接到網室中兩年生的資陽香橙砧木上。提取嫁接苗葉片 DNA,PCR法再次檢測轉基因陽性植株,共獲得 7株CitMYB20過表達株系,分別命名為OE-1、OE-4、OE-5、OE-6、OE-8、OE-9、OE-10;5株CitMYB20干擾株系,分別命名為 R-3、R-8、R-9、R-10 和 R-11。qRT-PCR結果顯示,在過表達植株中,CitMYB20顯著上調表達,最高表達倍數達 207倍(圖 3);在干擾植株中,CitMYB20的表達顯著下調,最低僅為對照表達量的12%(圖4)。
與非轉基因植株的表型相比,棗陽小葉枳CitMYB20過表達植株和干擾植株的株高和葉片大小未觀測到明顯的變化。選取生長狀態一致的過表達植株葉片,采用針刺法接種柑橘潰瘍病病菌,10 d后對其拍照統計病斑面積。結果顯示,過表達植株葉片的病斑面積均小于非轉基因植株葉片的病斑面積,其中OE-1、OE-6、OE-10這3株轉基因材料的病斑面積與非轉基因植株相比存在顯著差異,病斑面積減少25%左右(圖5)。RNAi抑制CitMYB20表達植株葉片的病斑面積均大于非轉基因植株葉片的病斑面積,其中R-9轉基因植株的病斑面積與非轉基因植株相比存在顯著差異,病斑面積增加約40%(圖6)。

圖3 過表達植株的CitMYB20相對表達量檢測Fig. 3 Detection of CitMYB20 relative expression level in over-expressed plants

圖4 RNAi植株的CitMYB20相對表達量檢測Fig. 4 Detection of CitMYB20 relative expression level in RNAi plants
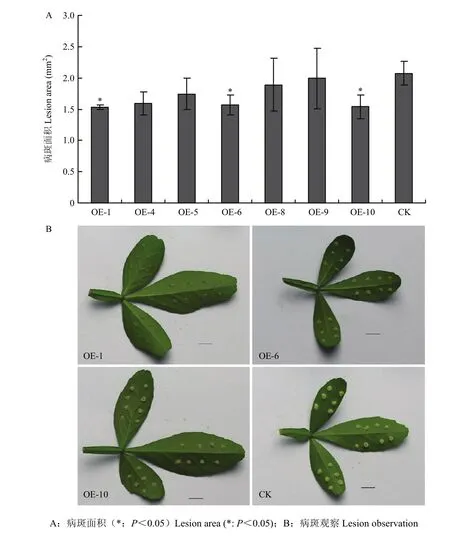
圖5 過表達CitMYB20植株的柑橘潰瘍病抗性評價Fig. 5 Evaluation of citrus bacterial canker resistance in over-expressed CitMYB20 plants
3 討論
CitMYB20(Ciclev10005629m)是 XIE等[20]從柑橘基因組數據庫中鑒定出的眾多 R2R3-MYB類轉錄因子基因之一。范海芳等[28]曾從晚錦橙、酸柚、紐荷爾臍橙和四季橘中克隆CitMYB20基因序列,其序列相似度在核酸水平達到99%。本試驗克隆了棗陽小葉枳和金彈金柑CitMYB20基因序列,與晚錦橙CitMYB20相比,在核苷酸水平上相似度也達 99%,表明CitMYB20在柑橘不同品種間高度保守。受柑橘潰瘍病菌侵染后,CitMYB20在抗性品種四季橘中上調表達3倍,在易感品種紐荷爾臍橙中無差異表達[28]。本研究以柑橘潰瘍病抗性品種金彈金柑和易感品種棗陽小葉枳作為材料,分析柑橘潰瘍病菌侵染不同時間基因表達量的變化,也發現CitMYB20在感染柑橘潰瘍病菌的抗性品種中顯著上調表達,同樣在感染柑橘潰瘍病菌的易感品種中未發現顯著差異表達。
本研究中,CitMYB20過表達植株在接種柑橘潰瘍病菌10 d后的病斑面積與對照植株相比明顯減小(圖5),抑制表達植株在接種柑橘潰瘍病病菌后病斑面積與對照植株相比明顯增加(圖6),表明CitMYB20能夠抵抗柑橘潰瘍病菌侵染,在抗潰瘍病途徑中起到正調控作用。然而,轉基因植株對柑橘潰瘍病的抗性與CitMYB20的表達量之間沒有觀測到明顯的相關性。在已報道的轉基因植物研究中也有類似現象,即基因的過表達或抑制表達程度與轉基因植株的抗性和敏感性之間不存在直接關系,或具有相同或相似表達水平的轉基因植株對病原的抗性程度不等[8,29-30]。這可能與外源基因在植物基因組上插入位點相關,影響基因組上其他基因的表達從而影響其抗性;也可能與外源基因在翻譯和翻譯后水平的調控相關,雖然外源基因表達水平甚高,但在轉基因植物中其蛋白的表達并不一定很高,因而外源基因的過表達量達到抗性水平時,更高的基因表達量也不會進一步增加轉基因植物的抗性。

圖6 CitMYB20抑制表達植株的柑橘潰瘍病抗性評價Fig. 6 Evaluation of citrus bacterial canker resistance in plants inhibiting CitMYB20 expression
R2R3-MYB轉錄因子通過調控植物體內多種途徑抵抗細菌病原的危害。研究顯示AtMYB30是過敏性細胞死亡的正向調控因子,在擬南芥和煙草中過表達AtMYB30,轉基因植株對不同的病原細菌表現過敏反應(hypersensitive response,HR)或類似過敏反應,并能增強對丁香假單胞桿菌番茄致病變種的抗性;在反義表達AtMYB30的擬南芥株系中,能強烈抑制對病原細菌的抗性和HR細胞死亡反應,HR和防衛反應相關基因的表達也發生改變[31]。偃麥草R2R3-MYB基因TiMYB2R-1的異源表達可增強轉基因小麥對全蝕病菌(Gaeumannomyces graminis)的抗性[32]。小麥R2R3-MYB基因TaPIMP1在煙草中的異源表達則表現出對青枯病菌(Ralstonia solanacearum)的抗性[33]。CitMYB20與擬南芥同源基因的進化樹分析顯示,該基因與擬南芥 R2R3-MYB類轉錄因子AtMYB15的同源性最高[28],前人研究表明AtMYB15能夠參與木質素的生物合成和植物的基礎免疫調節,增強對丁香假單胞桿菌番茄致病變種 DC3000的抗性[34],由此推測CitMYB20可能通過植物次生代謝物的合成在柑橘潰瘍病菌侵染過程中發揮抵抗作用。
水楊酸[35]、茉莉酸[36]等植物激素能夠參與植物抗病途徑的信號傳導,在植物抵御病菌侵染的過程中發揮重要作用。目前關于R2R3-MYB轉錄因子通過激素信號通路參與病菌響應的研究也有報道,如AtMYB44能夠通過水楊酸信號通路抵抗丁香假單胞桿菌番茄致病變種的侵染[37]。擬南芥茉莉酸合成突變體coi1受灰霉病菌(Botrytis cinerea)侵染后,擬南芥R2R3-MYB基因BOS1的誘導表達被延遲且表達增幅減少,提示病菌對BOS1的誘導表達與茉莉酸信號通路之間存在相關性[38]。本研究使用外源激素水楊酸、茉莉酸甲酯和乙烯利分別對CitMYB20進行誘導表達,結果顯示該基因在金彈金柑和棗陽小葉枳中對水楊酸和茉莉酸甲酯呈現出相反的誘導表達方式(圖 2),推測該基因的抗病途徑可能受到水楊酸和茉莉酸甲酯的誘導。另外,筆者在分析啟動子順式作用元件時發現,與金彈金柑相比,棗陽小葉枳CitMYB20的啟動子序列中缺少水楊酸響應的功能元件TCA-element(表2)。有研究顯示啟動子序列的缺失會嚴重影響基因表達的變化[39]。筆者的研究結果也顯示,在受外源水楊酸誘導時,棗陽小葉枳中CitMYB20在一定時期表達量不增反降(圖 2)。棗陽小葉枳對柑橘潰瘍病抗性的喪失是否因為TCA-element元件的缺失從而失去水楊酸誘導抗性基因表達的能力,有待于進一步研究。
4 結論
CitMYB20編碼序列在不同柑橘品種間非常保守,但啟動子序列在柑橘潰瘍病抗性品種金彈金柑和敏感品種棗陽小葉枳之間存在差異。CitMYB20在金彈金柑中受柑橘潰瘍病菌和外源激素水楊酸、茉莉酸甲酯的誘導表達。過表達CitMYB20柑橘株系對柑橘潰瘍病的抗性得到明顯提高,抑制CitMYB20表達的植株則降低了對柑橘潰瘍病的抗性,推測該基因在柑橘抗潰瘍病途徑中具有重要作用。

