馬流產沙門氏菌的分離鑒定及其微量凝集抗體檢測方法的建立與應用
郭奎,王寧,王金慧,初曉雨,趙語婷,郭巍,劉荻萩,胡哲,王曉鈞
(中國農業科學院哈爾濱獸醫研究所/獸醫生物技術國家重點實驗室,哈爾濱 150069)
0 引言
【研究意義】建立一種敏感、特異、操作簡便和高通量的微量凝集方法,實現對馬流產沙門氏菌抗體進行快速檢測,對馬流產沙門氏菌引起的流產的流行病學調查具有重要意義。【前人研究進展】馬流產沙門氏菌病,又稱為馬副傷寒,是由馬流產沙門氏菌(Salmonella abortus equi)、鼠傷寒沙門氏菌(S.typhimurium S. typhi)、都柏林沙門氏菌(S. dublin)等引起的以馬屬動物流產為特征的傳染病[1-2]。其中馬流產沙門氏菌是導致母馬妊娠晚期流產主要病原菌[3],且只對馬屬動物具有致病性,具有菌體抗原4、12,鞭毛第二相抗原H-enx。早在18世紀末19世紀初,歐美地區發生過大批馬流產的現象,20世紀 70年代末,我國華北、西北、東北等養馬地區也陸續暴發馬流產沙門氏菌病,并造成了嚴重的經濟損失,該病全年都可發生,主要發生于懷孕后期,大多數表現為散發,有時呈地方流行性。馬流產沙門氏菌易感染初孕馬,多數馬在發生流產前,一般無明顯臨床癥狀,突發流產,絕大多數為死胎,有少數存活的胎兒,在出生幾天后,也會發生死亡[4-5]。妊娠母馬流產時, 病原菌隨流產胎兒、胎衣、羊水及陰道分泌物排出體外, 病公馬能隨精液排菌[6]。感染馬流產沙門氏菌的馬常成為該菌的攜帶者,也通常被認為是非疫區最初傳染源[7]。盡管該病在歐洲國家及美國等得到嚴格控制[8],也有一些國家仍有零散發生,比如克羅地亞(歐洲)報道發生了 2起流產,流產率分別為 11%和 44%;非洲及亞洲國家,該病仍然尚未得到控制,該病在阿根廷和日本也有報道[7,10-11];我國在20世紀80年代多次暴發該病[4-5,12-13],但在之后的 30多年中,鮮有該病的報道,一直沒有引起行業內的關注,國內外的相關研究并不多見,也不深入,是一種被忽視的傳染病。直到 2014年我國內蒙古東部最先出現大批馬流產,流產率高達66.7%,此后的幾年里,我國多地持續流行該病,流產率為 30%—100%,其中大部分為草原上開放式散養的馬群,該病的發生直接影響了我國馬匹的存欄量、造成嚴重的經濟損失。該病目前呈蔓延的趨勢,對我國馬業持續發展產生了潛在的威脅和巨大的影響,嚴重阻礙了我國馬業的發展。細菌的病原學檢測方法主要包括傳統的細菌分離鑒定、革蘭氏染色、生化特性分析、血清型的檢測等,以及基因組PCR[14-18]鑒定、環介導等溫擴增(Loop-mediated isothermal amplification LAMP)[19-20]等分子生物學手段。細菌的血清學方法主要有玻片凝集、試管凝集試驗、微量凝集試驗、ELISA等,其中微量試驗的應用較為廣泛。王晶鈺等[21]建立了檢測雞大腸桿菌抗體的微量凝集試驗,證實免疫后抗體效價與免疫保護效果呈正相關;徐為中等[22]建立了檢測兔大腸桿菌的微量凝集方法,利用該方法監測免疫滅活疫苗后家兔大腸桿菌抗體水平。【本研究切入點】目前,還沒有關于馬流產沙門氏菌病原學系統的診斷方法,同時血清學的診斷方法也有限,主要依據傳統的試管凝集試驗進行診斷,然而該方法的凝集結果往往不易判讀,使用試管操作難免耗時費力,不適合大樣本的檢測。急需建立一種有效的微量凝集方法,提高檢測效率。【擬解決的關鍵問題】本研究采集疑似流產病例的流產馬駒組織,進行了系統的病原學實驗室診斷,對流產馬駒的臟器進行常規的細菌分離和鑒定,并以其中一株分離株制備了凝集抗原,對比馬流產沙門氏菌試管凝集血清學檢測方法,旨在建立一種實現高通量新型微量凝集抗體檢測方法,為臨床馬流產沙門氏菌病的診斷和疫苗抗體評估奠定基礎。
1 材料與方法
試驗于2018年3月至2019年9月在中國農業科學院哈爾濱獸醫研究所,獸醫生物技術國家重點實驗室,由馬傳染病與慢病毒病研究創新團隊進行。
1.1 質粒和菌株及樣品
PMD18T載體、大腸桿菌DH5α感受態細胞購自上海康為世紀有限公司;17份流產馬駒組織(心、肝、脾、肺、腎、淋巴結、臍帶)采自內蒙古3個不同地區;120份馬血清采自流產暴發地區,31份血清采取北京無流產疫情的地區。C77-1馬流產沙門氏菌標準株購自中國獸醫藥品監察所。
1.2 主要試劑
沙門氏菌顯色培養基購自上海欣中生物工程有限公司;沙門氏增菌液購自青島高科園海博生物技術有限公司;瓊脂糖凝膠DNA回收試劑盒(Gel Extraction Kit)、高純度質粒小提試劑盒(Pureplasmid Mini Kit)等均購自康為世紀有限公司;細菌基因組 DNA提取試劑盒(TIANamp Bacteria DNA Kit)購自TIANGEN;革蘭氏染色液,沙門氏菌屬診斷血清購自寧波天潤生物藥業有限公司;馬流產沙門氏菌鞭毛蛋白血清H:e,n,x(貨號:53824)購自哈爾濱賽德洪澤科技發展有限公司;馬流產沙門氏菌標準凝集抗原及陽性血清購自中國獸醫藥品監察所(效價為1∶6 400),馬傳染性貧血病毒(Equine infections anemin virus, EIAV)、馬流感病毒(Equine innuenza virus, EIV,(H7N7、H3N8))、馬皰疹病毒(Equine herpes virus, EHV, I型、II型、III型、IV型、VII型)、馬動脈炎病毒(Equine arteritis virus, EAV)、馬鏈球菌(Streptococcus equi,S.equi)、鼠傷寒沙門氏菌等陽性血清及馬流產沙門氏菌陰性血清保存哈爾濱獸醫研究所。
1.3 病原菌的初步分離及鑒定
用接種環沾取臟器浸出液,劃線接種于沙門氏菌顯色培養基上,37℃溫箱培養18—24h,第二天觀察菌落的顏色。在顯色培養基上,革蘭氏陽性菌被抑制,大腸埃希氏菌為藍色。某些芽孢桿菌呈無色,沙門氏菌為淡紫色。挑取沙門氏菌選擇培養基上可疑菌落,參照革蘭氏染色說明書,進行革蘭氏染色,并置于1 000倍光學顯微觀察下觀察細菌的顏色、形態、大小。
1.4 分離菌16S rRNA鑒定及序列分析
挑取單菌落,接種于沙門氏菌選擇培養基,37℃,180 r/min震蕩培養12h,按照細菌基因組DNA提取試劑盒說明書提取17株細菌DNA,并以此為模板,擴增16S rRNA基因。反應體系20 μL:2×Taq Master Mix,10 μL;P1/P2,1 μL; ddH2O,6 μL;模板,2 μL;反應條件為:預變性95℃ 5 min;95℃ 30 s,58℃ 30 s,72℃ 90 s,共35個循環;72℃終延伸7 min;待PCR反應結束后,取6 μL PCR產物進行1%的瓊脂糖凝膠電泳分析。獲得預期大小目的條帶后,將剩余PCR產物送去吉林庫美生物公司進行測序。
1.5 沙門氏菌的生化鑒定及血清型鑒定
挑取16S rRNA鑒定為沙門氏菌的單菌落,參考生化鑒定試劑盒說明書進行生化鑒定,并在規定時間內判定結果。同時劃線接種于 0.5%的低濃度瓊脂的LB平板,37℃培養16h,參照沙門氏菌屬血清型鑒定說明書,對菌株進行鑒定。
1.6 馬流產沙門氏菌凝集抗原制備
選取E.S-1菌株,進行凝集抗原的制備。首先挑取單個菌落于5 mL沙門氏菌增菌液中,37℃,180 r/min培養16h,第二天以1∶100接種沙門氏菌增菌液,37℃,180 r/min培養8 h,參照平板計數法進行細菌計數。菌液按照 0.2%體積比例加入甲醛,在 28℃,130 r/min滅活,分別在滅活24、48 h后,進行滅活效果驗證。完全滅活后,方可作為凝集抗原。
1.7 試管凝集試驗
試管凝集試驗按照NY_T570-2002行標進行,以分離株作為凝集抗原,根據購買的1∶6 400效價的標準陽性血清,確定凝集抗原工作濃度,并用于臨床樣品血清抗體的檢測。
1.8 微量凝集試驗最佳抗原濃度的確定
利用制備的凝集抗原,進行微量凝集試驗反應條件的優化。對陽性血清,在96孔U型板上進行2倍比稀釋,分別與作不同濃度稀釋的抗原反應,并設生理鹽水對照,利用封板膜封閉。室溫放置,20 h后判定結果。選取微量凝集最佳的抗原濃度,從而確定最佳抗原濃度。判定條件:“#”抗原抗體呈均勻分布,凝集成薄層,即 100%抗原被凝集 ;“+++”:凝集反應孔底能看到少許沉淀,即 75%抗原被凝集;“++ ”:凝集板底呈點狀沉淀,但傾斜時,沉淀不流動,即50%抗原被凝集;“+” :凝集板底有沉淀,但傾斜時,只有少許沉淀呈線狀流動,即25%抗原被凝集;“-” :凝集板底呈點狀沉淀,但傾斜時,沉淀呈線狀完全流下,即抗原未被或少部分血清被凝集。樣品結果參考NY_T570-2002判定,陽性反應:1∶1 600 凝集強度達“++”或以上時,用“+”表示;可疑反應:1∶800 凝集強度達“++”或以上時,用“+”表示;陰性反應:1∶800 凝集強度只達“+”或以下時,用“-”表示。
1.9 敏感性試驗
利用微量凝集優化的最佳抗原濃度(4億/mL)、試管凝集凝集抗原濃度(2億/mL)及馬流產沙門氏菌參考凝集抗原[23],對馬流產沙門氏菌陽性血清(標定效價6400)進行檢測,重復3次,每次3個重復。
1.10 特異性試驗
利用微量凝集方法,對馬流產沙門氏菌、馬傳染性貧血病病毒、馬流感病毒(H7N7、H3N8)、馬動脈炎病毒、馬皰疹病毒(I型、II型、III型、IV型、VII型)、馬腺疫鏈球菌、鼠傷寒沙門氏菌等標準陽性血清和陰性血清進行檢測。
1.11 微量凝集對臨床樣本的檢測
用微量凝集檢測方法對臨床151份馬血清樣品進行檢測,并隨機選取30份,做試管凝集試驗,并對兩種檢測方法結果進行比較。
2 結果
2.1 沙門氏菌的分離及鑒定
沙門氏菌在沙門氏菌顯色培養基上呈紫色,大腸桿菌呈藍色,革蘭氏陽性菌可抑制。從內蒙古地區(17/17)采集的各臟器劃線結果可以觀察到有大量紫色菌落(圖 1),初步證明各臟器組織內含有沙門氏菌,分離菌分別命名為 E.S-1—17菌株。革蘭氏染色鏡檢顯示為革蘭氏陰性短桿菌(圖略)。
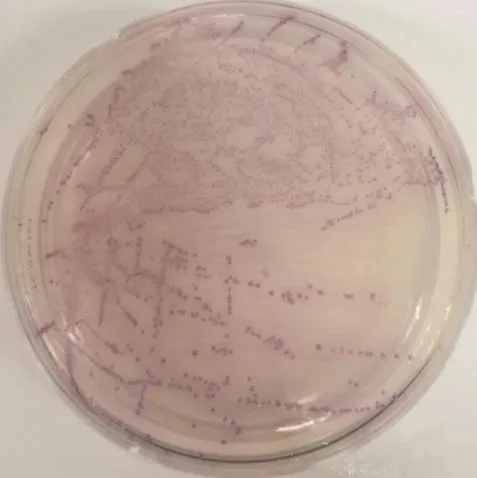
圖1 沙門氏菌的分離與鑒定Fig. 1 Isolate and identification of Salmonella
2.2 16S rRNA克隆、鑒定及遺傳分析
將獲得17株分離株分別進行PCR擴增16S rRNA基因,擴增的產物經 1%瓊脂糖凝膠電泳。電泳初步表明,獲得了1條約1 500bp的特異性條帶,與預期大小相一致(圖 2)。將 E.S-1—17株的擴增產物進行測序,氨基酸同源性和核苷酸同源性分析結果表明,E.S-1—17的16S基因組與C77-1序列完全一致,同源性為100%,與同屬沙門氏菌AL513382-Typhimurium(鼠傷寒沙門氏菌)、CP000026-Paratyphi A(甲型副傷寒沙門氏菌)、CP000857- Paratyphi C(丙型副傷寒沙門氏菌)、NZ_CM001062-Choleraesuis(豬霍亂沙門氏菌)、P125109-Enteritidis(腸炎沙門氏菌)同源性為 97.4%—99.7%,而與其他細菌同源性為38.4%—40.7%,選取E.S株的的序列進行進化樹分析顯示,沙門氏菌屬與其他種屬細菌的同源性低,具有獨立的分支,屬內細菌間同源性較高(圖3)。
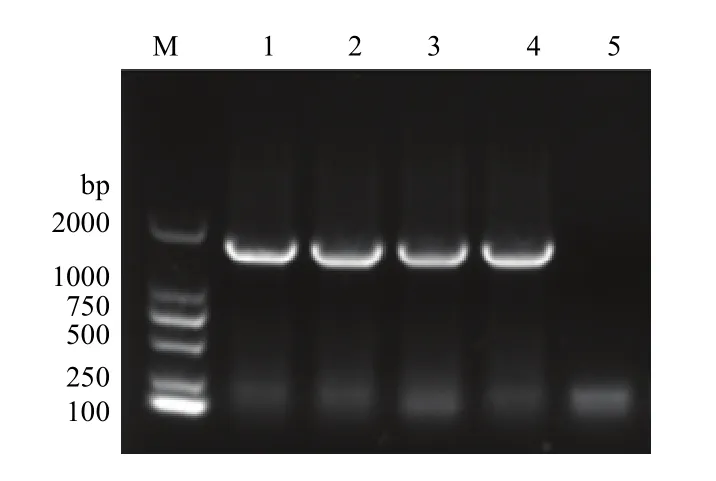
圖2 16S 基因的PCR擴增Fig. 2 PCR amplification of 16S gene
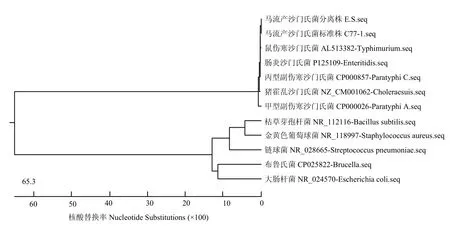
圖3 不同細菌16S rRNA 基因的系統進化樹Fig. 3 Phylogenetic trees of 16S rRNA gene of different bacteria
2.3 分離菌株血清型鑒定及生化鑒定
利用沙門氏菌屬診斷血清及馬流產沙門氏菌鞭毛蛋白血清H:e,n,x,對各菌株進行血清型鑒定(圖4):結果顯示各菌株均與 O4-012混合血清(左圖)及鞭毛第二相血清H-enx凝集(右圖),獲得的抗原式為O4,O12,H-e,n,x,經鑒定各分離菌株均為沙門氏菌B群的馬流產沙門氏菌。將獲得的17株馬流產沙門氏菌和C77-1分別進行生化鑒定,結果如表1所示,標準株C77-1菌株與NY_T570-2002馬流產沙門氏菌病診斷技術中所述一致;而E.S-1—17各株除不能發酵鼠李糖之外,其他生化鑒定結果均與C77-1結果一致。
2.4 試管凝集最佳抗原濃度的確定
根據試管凝集結果,確定了試管凝集最佳抗原濃度為 2億/mL,該方法可以應用于臨床樣品血清抗體的檢測。
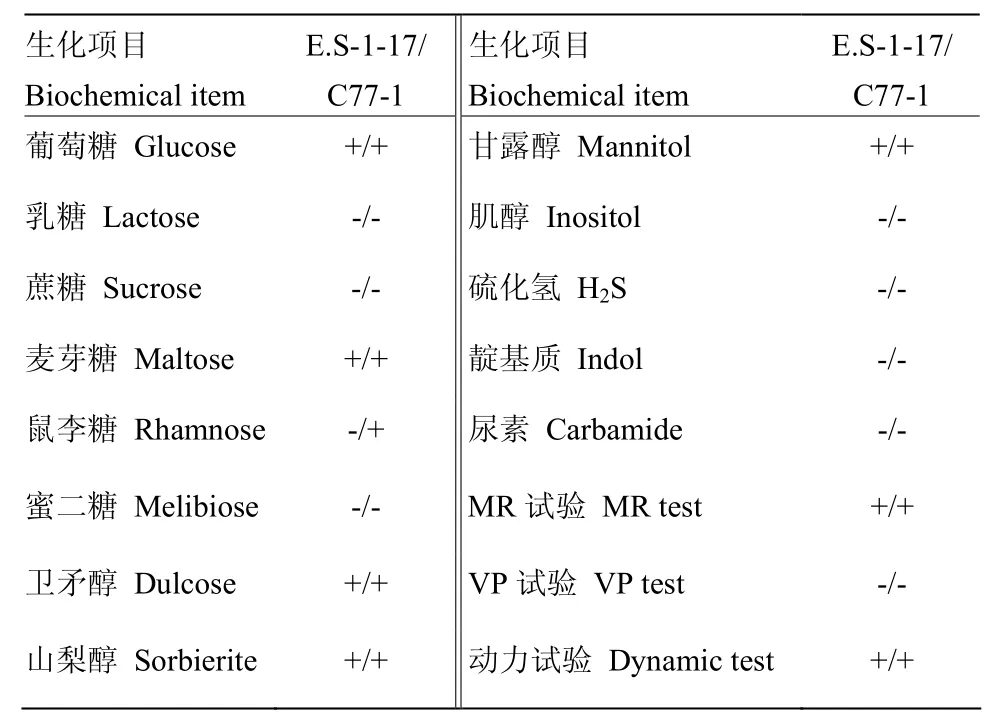
表1 分離菌株的生化鑒定結果Table 1 Biochemical identification of the E.S-1-17 strains

圖4 馬流產沙門氏菌的凝集結果Fig. 4 Result of agglutination for Salmonella abortus equi
2.5 微量凝集試驗最佳抗原反應濃度的選擇
由表2可以看出,當抗原(E.S-1)濃度為4億/mL時,檢測馬流產沙門氏菌陽性血清的抗體凝集效價最高為1∶12 800,且結果最易判讀。當抗原濃度2億/mL以下時,則空白對照判讀十分困難,因此選擇4億/mL為最佳抗原反應濃度。
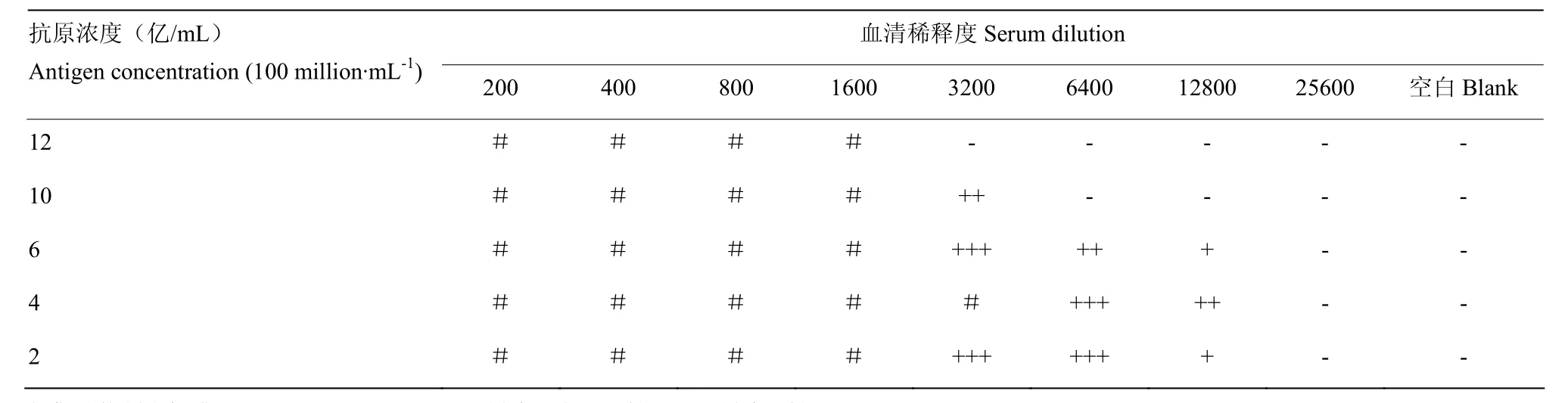
表2 不同抗原濃度的微量凝集反應結果Table 2 Results of microagglutination with different antigen concentrations
2.6 敏感性試驗
以E.S-1作為凝集抗原,分別利用試管凝集和微量凝集試驗,檢測馬流產沙門氏菌陽性血清的效價,試管凝集效價陽性血清效價可以達到1∶6 400,微量凝集效價可以達到1∶12 800,利用參考凝集抗原,試管凝集效價結果表明陽性血清效價為1∶6 400。因此微量凝集敏感性高于試管凝集試驗。
2.7 特異性試驗
應用不同的馬傳染病陽性血清進行特異性試驗,結果如表3所示,該微量凝集試驗僅能檢測出馬流產沙門氏菌陽性血清(凝集效價為1∶12 800)為陽性,其他血清均為陰性(凝集效價均低于1∶1 600)。因此該方法對馬流產沙門氏菌抗體檢測具有良好的特異性。
2.8 微量凝集抗體檢測方法的初步應用
應用微量對臨床151份樣品進行馬流產沙門氏菌抗體的檢測,以凝集價 1∶1 600為陽性判斷標準,結果如表4所示,流產流行地區,馬流產沙門氏菌抗體陽性率為27.3%—42.9%,非流產流行區,馬流產沙門氏菌抗體陽性率0。為了比較兩種方法的診斷敏感性,隨機選取 30份臨床樣品,進一步進行了試管凝集抗體的檢測,結果表明陽性率為10%(表5),低于微量凝集試驗(33.3%),試管凝集陽性3份,微量凝集陽性10份,其中試管凝集陽性的3份,微量凝集結果均陽性,因此,以試管凝集為標準(表6),微量凝集診斷敏感性為100%(3/3),診斷特異性為74.1%(20/27)。
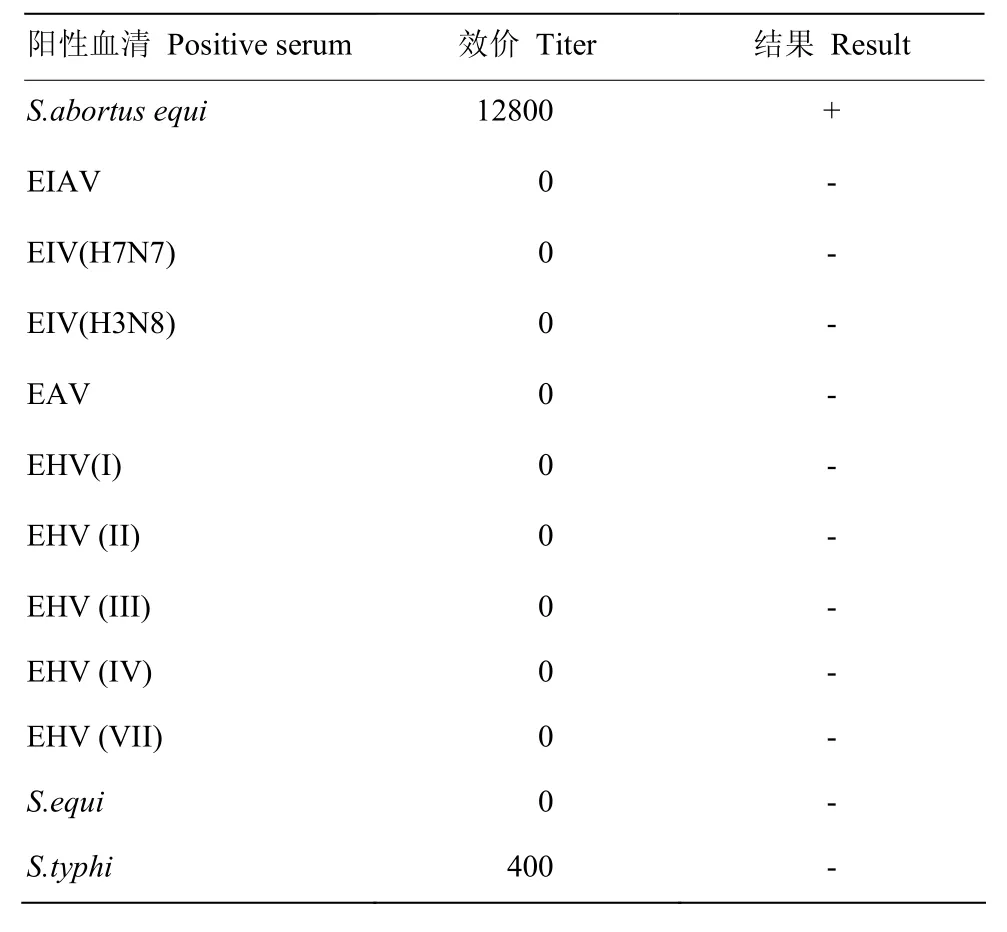
表3 微量凝集反應的特異性試驗Table 3 Specific test results of microagglutination
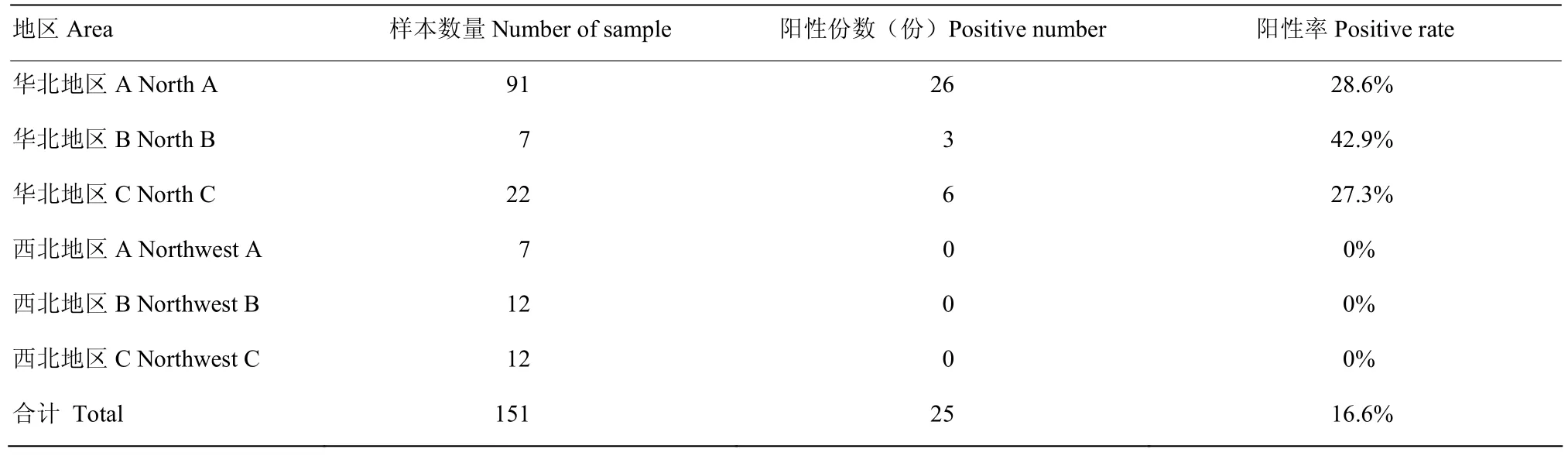
表4 臨床樣本的檢測Table 4 Test results of clinical samples
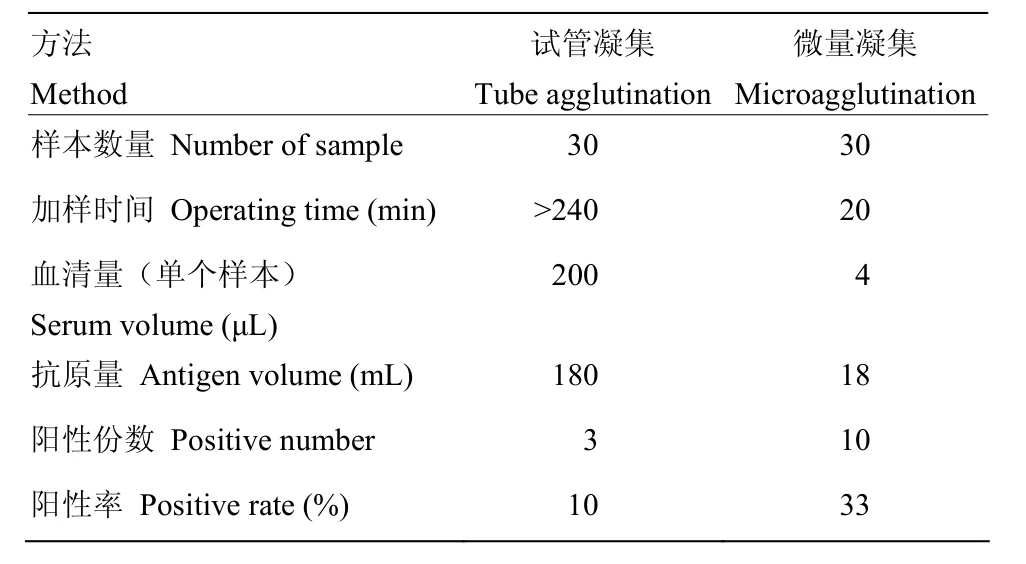
表5 兩種檢測方法的比較Table 5 Comparison of the two detection methods
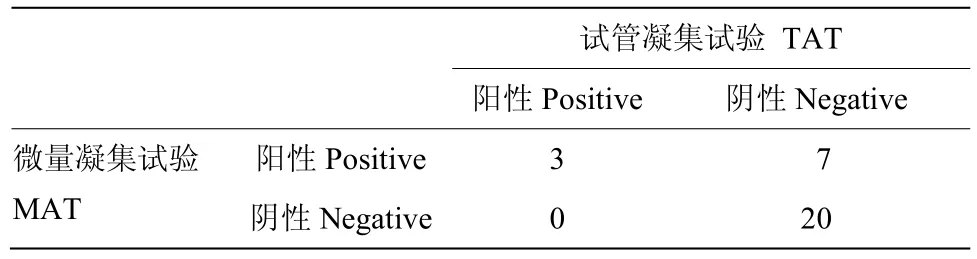
表6 兩種方法診斷敏感性的比較Table 6 Comparison of diagnostic sensitivity between the two methods
3 討論
隨著國家對賽馬行業的開放及驢相關產業的快速發展,馬驢的數量在不斷上升。隨之而來的傳染病越來越多,病毒性疾病有馬流感,馬病毒性動脈炎、馬鼻肺炎等,細菌性病有由馬鏈球菌馬亞種引起的腺疫、馬流產沙門氏菌引起的流產等[24-25]。環境因素、飼養管理、細菌性因素,病毒性因素等均可引起馬屬動物的流產,其中細菌性流產占主要部分[26-27]。馬流產沙門氏菌病自21世紀來在我國鮮有報道,近幾年,馬流產持續零散暴發,造成大量懷孕馬流產,給我國馬業造成巨大經濟損失。但對發病原因一直沒有深入研究,經過本試驗對內蒙古流產馬駒臟器進行系統的病原學檢測,最終確認為馬流產沙門氏菌感染。由此提示,該病已在我國內蒙古地區流行,需要及時采取針對性的預防和控制措施。NY_T570-2002馬流產沙門氏菌病診斷技術明確指出,細菌學的檢測結果是確診馬流產沙門氏菌病的依據。本研究通過沙門氏菌顯色培養基篩選、革蘭氏染色鑒定、16S基因組序列分析結果表明,從流產馬駒分離到的17株均為沙門氏菌,利用沙門氏菌屬血清型分析鑒定,E.S-1—17菌株,均具有菌體抗原O4,O12,鞭毛II相抗原H-enx,證明分離到的菌株為馬流產沙門氏菌。利用各種型特異性鞭毛抗血清對細菌鞭毛蛋白抗原型的鑒定過程中,往往存在假陰性結果,主要是因為常規方法培養獲得的菌體,鞭毛蛋白的表達不佳或者表達量很低,影響凝集結果的判定,可采取低濃度瓊脂培養法,誘導鞭毛蛋白表達;此外也與H-enx血清質量有關。E.S-1—17菌株生化鑒定結果符合馬流產沙門氏菌的生化特性,但與NY_T570-2002中馬流產沙門氏菌菌株相比均不能發酵鼠李糖,這是新分離株在進化上形成的新的生化特性。
NY_T570-2002馬流產沙門氏菌病診斷技術明確指出血清學檢測結果是針對馬流產沙門氏菌病的一種輔助手段,但血清學檢查對馬群的檢疫是有意義的。由于該病很多年未發生,近幾年該病突然暴發時,缺少可用商品化的凝集抗原,因此,為解決臨床樣本的檢測,獸醫生物技術國家重點實驗室利用分離菌株,制備了凝集抗原,以馬流產沙門氏菌標準陽性血清,優化了試管凝集抗原濃度(為 2億/mL),但是試管凝集試驗需要血清量大(送檢的血清量有時滿足不了要求),此外,試管凝集試驗需要不斷稀釋,每次只能做一支試管,操作繁瑣,不適合大量樣本的檢測,為克服試管凝集檢測方法的弊端,本研究建立了一種微量凝集抗體檢測方法,該方法與試管凝集相比,具有良好的操作性,可以多個樣品同時進行稀釋,而且可以同時判定多個樣品凝集結果,在加樣時間及判讀結果時間上至少縮短20倍,提高了檢測效率;血清用量減少50倍,凝集抗原量減少10倍,試管耗材等減少了使用,大大降低成本。本研究研制的微量凝集試驗,特異性好,對其他馬常見傳染病陽性血清檢測結果均陰性,敏感性比試管凝集高1個滴度,對于臨床相同的30份樣品,利用兩種方法進行試驗,微量凝集檢測陽性率為 33.3%高于試管凝集(10%),以試管凝集結果為標準,微量凝集與試管凝集相比,診斷敏感性為100%,診斷特異性為74.1%。
利用建立的微量凝集檢測方法,對151份馬血清樣品進行檢測,流產暴發區馬流產沙門氏菌抗體陽性率27.3 %—42.9%,略低于臨床流產率(30 %—100%),可能有以下五個方面的原因:1.樣品數量有限,不能代表整體的現狀,此外臨床流產時間不同,抗體有所差異。2.不同的病原也可以引起流產,如馬 I型皰疹病毒、馬VIII型皰疹病毒[28]、馬動脈炎病毒,可能還有一些未知病原(本研究利用real-time PCR方法對馬皰疹病毒、馬動脈炎病毒核酸進行了排除)。3.非傳染病因素如飼養管理、環境因素等。4.試驗的判定標準可能偏高。筆者判定的標準是依據 NY_T570-2002國家行業標準進行的判定(反應20h,1∶1 600“++”及以上判定陽性,)。客觀上,認為設定判定標準與疫病對人類的危害程度相關,對人類影響越大,判定陽性的稀釋度越低。如牛羊布氏桿菌病 1∶50“++”以上時判定陽性[29],5.不同病原抗體凝集試驗的反應時間不同,理論上反應時間越長,對結果判定準確性越高,因此本研究反應時間為 20h。此外,本研究建立的微量凝集與楊康[30]建立的馬流產沙門氏菌微量凝集方法不同,楊康建立的微量凝集反應時間為 2—3h,血清稀釋度為1∶40,做4個重復,當出現“++”及以上時,即將樣品判定陽性。判定標準過低,可能在一定程度上會造成假陽性,我們建立微量凝集,可以知道馬流產沙門氏菌抗體的具體效價,是對研發新的疫苗效果評估的重要手段。
綜上所述,本研究成功分離并鑒定出17株馬流產沙門氏菌,并利用其中的一株E.S-1菌株作為凝集抗原,成功建立了檢測馬流產沙門氏菌抗體的微量凝集方法,該方法可以大批量操作,可以應用于臨床各種馬屬動物的馬流產沙門氏菌抗體及疫苗抗體效價檢測,對于大規模疫病的監測和防控具有重要的意義。
4 結論
對流產馬駒的臟器進行細菌分離,通過對分離菌進行沙門氏菌顯色培養基、革蘭氏染色、16S rRNA測定證實分離菌株為沙門氏菌;生化鑒定表明,分離菌株符合馬流產沙門氏菌生化特性,但與C77-1相比,均不能發酵鼠李糖。通過利用低濃度瓊脂誘導鞭毛蛋白表達,證實分離菌株血清型為馬流產沙門氏菌,并將菌株命名為E.S-1—17,并以E.S-1菌株為凝集抗原,通過優化抗原濃度建立了微量凝集檢測方法,該方法與試管凝集相比,具有較高的敏感性和批量操作性,更適合應用于馬屬動物的馬流產沙門氏菌病的抗體檢測以及疫苗免疫抗體消長規律的評價。

