剖宮產(chǎn)術(shù)后腹壁瘢痕子宮內(nèi)膜異位癥癌變1例
唐莊艷,孔喬俊,王立巖,武寒茹,張萍萍,明 芳*
(1.柳州市人民醫(yī)院,廣西 柳州545000;2.吉林大學(xué)中日聯(lián)誼醫(yī)院 婦產(chǎn)科,吉林 長(zhǎng)春130021;3.揚(yáng)州婦幼保健院,江蘇 揚(yáng)州225000)
1 臨床資料
患者,女性,41歲,因“發(fā)現(xiàn)腹部包塊13年,加重1年”入院,患者既往2006年于當(dāng)?shù)蒯t(yī)院行剖宮產(chǎn)術(shù),術(shù)后3月自行觸及下腹部術(shù)口瘢痕處一小包塊(約0.5 cm),質(zhì)硬,輕壓痛,未突出皮膚表面,曾至醫(yī)院就診予消炎止痛對(duì)癥治療后緩解,后未定期復(fù)查未處理。13年來(lái)患者發(fā)現(xiàn)下腹壁腫塊無(wú)消退,且逐漸增大,近1年來(lái)明顯加重,包塊突出體表,伴疼痛,有刺痛感,經(jīng)期前后明顯。考慮腹部瘢痕子宮內(nèi)膜異位癥。建議入院手術(shù)治療。入院查體:腹平坦,下腹部剖宮產(chǎn)切口處見一橫約10 cm陳舊性疤痕,左側(cè)壁疤痕處可觸及一大小約4*3 cm腫物,邊界尚清,質(zhì)硬,有觸痛,不活動(dòng)。婦檢:外陰發(fā)育正常,陰道黏膜未見紫藍(lán)色病灶,宮頸光滑,子宮及雙附件未觸及異常。輔助檢查:體表包塊B超:下腹部剖腹產(chǎn)術(shù)口皮下脂肪層內(nèi)可探及一大小約32×25×27 mm實(shí)質(zhì)性低回聲腫塊,邊界清,形態(tài)不規(guī)則,內(nèi)回聲不均勻,后方回聲增強(qiáng)。CDFI:低回聲團(tuán)內(nèi)部及周邊見樹枝狀血流信號(hào);PW:腫塊至周邊及內(nèi)部可測(cè)及低速高阻血流頻譜,見圖1。婦科彩超、肝膽胰脾腎彩超、乳腺彩超、胸片均未見明顯異常。CA125: 20.87 U/ml。入院后2天在全麻下行腹壁腫物切除術(shù),術(shù)中見:腫物位于前鞘與皮下之間的肌肉層,呈紫藍(lán)色,大小約4×3 cm,質(zhì)硬,與周圍組織界限欠清,將腫物完整切除后,剖開腫物,可見巧克力樣液體。術(shù)后病理回報(bào):(腹壁切口腫物)低分化腺癌。免疫組化:CK(+)、CK7(+)、NapsinA(+)、p53小灶狀(+)、p16小灶狀(+);CK20、ER、PR、WT-1、SALL4、Arg-1、Hep均(-)。特殊染色:網(wǎng)染纖維組織增生;PAS無(wú)特殊。結(jié)合形態(tài)學(xué)及免疫表型,病變符合透明細(xì)胞癌改變,見圖2。術(shù)后為排除其他部位的原發(fā)病灶,完善盆腔MR、胸部CT、全腹CT、胃腸鏡均未提示異常,故結(jié)合患者臨床表現(xiàn)、檢查及術(shù)后病理檢查結(jié)果,考慮腹壁透明細(xì)胞癌為內(nèi)異癥病灶惡變所致,若再次手術(shù)探查,損傷機(jī)會(huì)較大,與患者及家屬溝通后,為防止復(fù)發(fā),建議轉(zhuǎn)入腫瘤科行局部放療。

圖1 腹壁瘢痕子宮內(nèi)膜異位癥超聲圖像
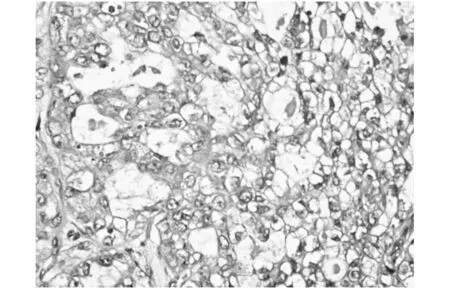
圖2 蘇木精和曙紅(H&E)染色的組織病理
2 討論
近年來(lái),隨著剖宮產(chǎn)率的升高,腹壁瘢痕子宮內(nèi)膜異位癥也并不罕見[1]。據(jù)報(bào)道,剖宮產(chǎn)后瘢痕子宮內(nèi)膜異位癥的發(fā)病率為0.2-0.8%,其惡變較為罕見,發(fā)病率為1%,最常見病理類型是透明細(xì)胞癌,其次是子宮內(nèi)膜樣癌[2]。雖然各種成像技術(shù)為其作出準(zhǔn)確診斷提供了很大幫助,但缺乏特異性。根據(jù)Hensen等人的研究,超聲是最簡(jiǎn)便易行的影像學(xué)檢查方法,并在大多數(shù)情況下可以借助超聲與腹壁切開疝,血腫,膿腫或皮脂囊腫進(jìn)行鑒別[3]。對(duì)于某些疑難病例,可以借助計(jì)算機(jī)斷層掃描(CT)或MRI等影像學(xué)檢查,也可以通過細(xì)針穿刺細(xì)胞學(xué)檢查(FNAC)明確診斷。目前瘢痕子宮內(nèi)膜異位癥最常見的治療手段是藥物治療和手術(shù)[4]。雖然藥物治療能夠減輕癥狀和控制病灶增長(zhǎng)及復(fù)發(fā),但是手術(shù)切除腫物仍是首選[5]。臨床上為了防止復(fù)發(fā)及惡變,手術(shù)治療時(shí)應(yīng)切除距腫物切緣至少1 cm的手術(shù)范圍,必要時(shí)可能需要進(jìn)行皮瓣移植或聚丙烯網(wǎng)片植入以彌補(bǔ)筋膜缺損[6]。對(duì)于內(nèi)異癥癌變的患者,需術(shù)后輔助化放療以防復(fù)發(fā)。
由于腹壁子宮內(nèi)膜異位癥的臨床表現(xiàn)不同,比如有些患者表現(xiàn)為月經(jīng)周期性疼痛典型癥狀,但有些患者可能完全沒有癥狀,且其癌變?nèi)狈μ禺愋缘哪[瘤標(biāo)志物。據(jù)報(bào)道,CA125在腹部?jī)?nèi)異癥癌變病例中可表現(xiàn)為正常至輕度升高,其敏感性和特異性分別為87%和92%[7]。有研究報(bào)道,透明細(xì)胞癌是腎癌、胰腺癌和婦科腫瘤的代表性組織學(xué)類型,其相關(guān)免疫組織化學(xué)分析表明,通常在婦科腫瘤中CK7染色陽(yáng)性,CK20染色陰性,而GPC-3在肝癌和腎癌中通常呈陽(yáng)性。故對(duì)于免疫組化CK7/CK20呈陽(yáng)性/陰性,而對(duì)GPC-3呈陰性,可以表明該腫瘤起源于婦科腫瘤[8]。本例患者既往只有剖宮產(chǎn)手術(shù)史,有伴隨月經(jīng)周期而出現(xiàn)周期性疼痛的典型癥狀,腫瘤標(biāo)志物CA-125正常,腹壁腫物組織切片提示透明細(xì)胞癌,免疫組化:CK7/CK20呈陽(yáng)性/陰性。基于以上證據(jù),可以診斷出本例患者腹壁腫塊為剖宮產(chǎn)術(shù)后腹壁子宮內(nèi)膜異位引起的惡變。
綜上所述,在臨床上,腹壁內(nèi)異癥惡變病例較為罕見,目前對(duì)這類患者管理經(jīng)驗(yàn)欠缺和診斷方法缺乏特異性,有時(shí)可能無(wú)法做出準(zhǔn)確的判斷而導(dǎo)致誤診或延誤治療。盡管如此,只要加強(qiáng)子宮內(nèi)膜異位癥患者的監(jiān)測(cè),也是可以早期診斷和治療的,對(duì)于月經(jīng)期間腹壁切口疼痛或者腫脹的需高度重視,因?yàn)檫@可能是惡變的早期征兆。

