A2M、A1PI、MMPs水平與肺部感染合并肺不張患者的相關性及臨床意義*
王 攀,曹益瑞,王紅玉,達 力
(成都市溫江區人民醫院重癥醫學科,四川成都 611130)
肺不張是肺組織塌陷導致的肺容量減少,可根據病例生理機制劃分為阻塞或非阻塞型肺不張,也可根據肺容量劃分,還可根據發生位置分為肺葉、節段或壓段肺不張[1-2]。其中阻塞型肺不張為氣道堵塞,非阻塞型肺不張是實質壓迫導致表面活性物質功能障礙,可能由氣道內(異物或黏液栓)、從壁(腫瘤,常見于鱗狀細胞癌)或從外部(淋巴結、結節、頂骨和內臟胸膜之間失去接觸等)壓迫引起[2-3]。細菌、病毒、真菌等引起的肺部感染,引發患者痰量增多和痰液性狀改變,嚴重或疏于治療者可能因吸入性損傷引發誤吸和氣道內分泌物增加導致肺不張[4-5]。目前,關于患者體內α2-巨球蛋白(A2M)、α1-蛋白酶抑制物(A1PI)和血清基質金屬蛋白酶(MMPs)等指標變化的研究較少,且少有闡述單純肺部感染患者與合并肺不張患者之間上述指標差異的研究。故本研究分析了上述指標在肺部感染合并肺不張患者體內的水平變化,旨在為該病的臨床診斷和治療提供參考。
1 資料與方法
1.1一般資料 選取2018年1-12月于本院就診的患者100例作為研究組,男63例,女37例,平均年齡(56.33±10.18)歲;選取同期本院就診的肺部感染患者45例作為對照組,男26例,女19例,平均年齡(55.71±9.46)歲;體檢健康者100例作為健康對照組,男61例,女39例,平均年齡(57.16±8.51)歲。各組人群性別構成和年齡比較,差異無統計學意義(P>0.05)。肺部感染診斷標準:臨床表現、胸部X線片和氣道內分泌物培養結果符合肺部感染診斷標準[6]。肺不張診斷標準[7-8]:(1)影像學可有氣管向患側移位(單側肺不張)和(或)患側肋間隙變窄;(2)胸部X線片可有局部組織密度均勻增高,肺葉體積縮小,組織均質毛玻璃狀;(3)CT檢查有體積縮小伴片狀密度升高,葉間胸膜移位;(4)纖維支氣管鏡檢查可有支氣管黏膜增厚、充血或水腫,無組織壞死和結節樣或息肉樣或菜花樣改變。研究組納入標準:(1)診斷為肺部感染合并肺不張[6-8];(2)臨床資料齊全;(3)年滿18歲;(4)對治療所用藥物無過敏反應。對照組納入標準:(1)胸部X線片或CT診斷為肺部感染;(2)年滿18歲;(3)對治療所用藥物無過敏反應。健康對照組納入標準:(1)年滿18歲;(2)無肺部感染;(3)無肺不張。3組排除標準:(1)1個月內肺部感染合并肺不張治療史;(2)有肺部手術史;(3)除肺部感染外,其他因素導致的肺不張(如外力壓迫、腫瘤等);(4)腫瘤;(5)免疫系統功能障礙;(6)非自愿參與研究。本研究在本院倫理委員會監督下進行并取得全部參與人員及其家屬同意。
1.2方法 于檢測日早晨8:00前,抽取研究對象外周靜脈血5 mL,4 ℃下2 000 r/min離心10 min,取上清后-20 ℃保存待測。血清A2M使用免疫比濁法檢測,血清A1PI使用酶聯免疫吸附測定檢測,MMPs(包括MMP-1、MMP-2和MMP-9)使用化學發光法檢測,全部操作按照試劑盒(購自美國RD公司)說明書操作。均先制作標準曲線,A2M檢測:2 μL血樣與試劑盒中250 μL試劑1混合,37 ℃水浴10 min后加入85 μL試劑2,同樣條件下水浴,后讀取吸光度(A)700值。A1PI檢測:在血樣中加入抗體,洗滌后加入特異性抗原試劑,再洗滌后加入特異性酶標抗體,洗滌后顯色,讀取A405值。MMPs檢測:先提取血樣中的總蛋白,檢測其總蛋白后進行聚丙烯酰胺凝膠電泳,轉膜后依次加入一抗和二抗,化學發光顯影定影后凝膠圖像分析。利用肺部感染評分[9]對研究組和對照組患者進行肺部疾病程度分級,其中評分≤6分者判定為輕度,>6~10分為中度,>10分為重度。上述全部操作由同一組熟練的操作人員完成。
研究組患者全部采取常規治療,包括給予吸氧、吸痰和體位引流,同時根據患者情況給予抗感染藥物,療程1個月。
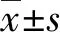
2 結 果
2.1研究組與對照組臨床資料比較 2組肺部感染嚴重程度、肺部感染原因等資料比較,差異無統計學意義(P>0.05),見表1。

表1 研究組與對照組臨床資料比較(n)

續表1 研究組與對照組臨床資料比較(n)
注:-表示此項無數據。
2.23組A2M、A1PI和MMPs水平比較 研究組A2M、A1PI、MMP-1和MMP-2水平均明顯高于對照組和健康對照組(P<0.05),其中對照組各指標水平均明顯高于健康對照組(P<0.05),見表2。
2.3研究組和對照組不同疾病程度患者A2M、A1PI和MMPs水平比較 2組患者隨著肺部疾病嚴重程度增加,A1PI和MMPs水平逐步升高(P<0.05),對照組各感染程度患者間A2M水平差異無統計學意義(P>0.05),而研究組差異有統計學意義(P<0.05),對照組各疾病程度患者各指標水平均明顯低于同程度研究組(P<0.05),見表3。
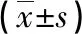
表2 3組A2M、A1PI和MMPs水平比較
注:與研究組相比,aP<0.05;與對照組相比,bP<0.05。
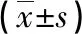
表3 研究組和對照組不同疾病程度患者A2M、A1PI和MMPs水平比較
注:與研究組輕度感染相比,aP<0.05;與研究組中度感染相比,bP<0.05;與研究組重度感染相比,cP<0.05;與對照組輕度感染相比,dP<0.05;與對照組中度感染相比,eP<0.05。
2.4治療前、后研究組患者各指標水平比較 常規治療后研究組各指標水平均明顯下降(P<0.05),見表4。
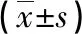
表4 治療前、后研究組患者各指標水平比較
3 討 論
近期報道顯示,在支原體肺炎患者體內A2M和A1PI水平均明顯升高,且可作為肺炎診斷的輔助指標[10]。因此,筆者推測,這二項指標在肺部感染患者中也表現異常。本研究結果驗證了筆者的猜想,在研究組和對照組患者體內,A2M和A1PI水平相較于健康對照組的確異常增高,且合并肺不張患者(研究組)上述二項指標水平增高更明顯。此外,研究表明A2M還能夠通過吞噬細胞的上清道夫受體,與循環中活性形式的MMPs(MMP-2和MMP-9)結合并從中除去[11-12]。故筆者推測,A2M、MMP-1、MMP-2、MMP-9的水平變化具有同步性。檢查肺部感染患者體內MMPs水平發現,MMP-1、MMP-2和MMP-9水平的確高于體檢健康者,且與A2M變化趨勢相同,在合并肺不張患者體內MMPs水平更高。LIU等[13]研究結果顯示,A2M表達與MMPs相關聯,且呈正相關,與本研究結果一致。將肺部感染患者根據病情進行劃分,再次分析其體內上述各指標水平發現,輕度患者各指標水平明顯低于中度和重度患者,而中度又明顯低于重度患者,這說明隨著疾病嚴重程度增加,各指標水平明顯上升。同時,僅肺部感染各疾病程度患者體內上述各指標水平均低于合并肺不張患者,說明A2M、A1PI和MMPs可用來輔助區分體檢健康者、僅肺部感染患者和肺部感染合并肺不張患者。此外,接受1個月治療后,肺部感染合并肺不張患者各指標水平均趨于正常(未達到健康水平但均極低于治療前)。這也能從側面體現本文研究的三項指標可利用于表征肺部感染合并肺不張患者疾病情況。
在肺部感染過程中不免發生病理性變化,導致肺組織損傷,進而影響肺功能和(或)造成肺不張,在這一系列過程中,多種效應細胞和炎癥因子均參與反應。A2M能夠通過抑制纖溶酶和激肽釋放酶以充當抗蛋白酶從而滅活多種蛋白酶,也可以作為載體蛋白發揮作用[14]。研究結果顯示,在肺部感染患者體內,Toll樣受體、白細胞介素等細胞因子的水平均異常增多[15],而A2M能夠與多種細胞因子結合并影響其功能[10]。因而推測,在肺部感染患者體內A2M水平隨著Toll樣受體、白細胞介素等細胞因子和蛋白酶水平的升高而升高,以此在宿主抵御肺部感染中發揮重要作用;而這些效應細胞和炎癥因子同時影響MMP的RNA表達,進而影響MMPs表達。另一方面,當機體發生病變而導致蛋白酶釋放增加和病原體入侵機體釋放外源性蛋白酶時,A2M會與之相結合并將其清除以達到組織免受損害的目的,而MMPs則因細胞外機制動態平衡的打破而與其抑制物水平失衡[16-17]。相對于單純肺部感染患者,合并肺不張患者機體病變程度加劇,導致A2M水平升高并保護組織。在感染過程中,病毒基因編碼需要蛋白酶作用以裂解發揮功能,而A1PI阻止這一過程發生從而使其不能發揮作用,故AIPI水平也反映疾病程度。
雖然本文探究了A2M、A1PI和MMPs在肺部感染合并肺不張患者體內表達情況,但由于部分患者臨床資料缺失,沒有分析A2M、A1PI等與動脈血氣等指標之間的關系。下一步擬重新篩選患者資料,保留動脈血氣數據完整的患者,分析A2M、A1PI等與肺功能參數、血氧飽和度等之間的關系,為臨床初步判斷這類患者肺功能受損程度提供依據。另外,上述疾病過程中的分子機制均根據既往文獻報道推測而來,下一步需要建立模型驗證。
4 結 論
綜上所述,肺部感染合并肺不張患者血清A2M、A1PI和MMPs水平異常升高,隨著病情加重,各指標水平顯著增高,常規治療后其水平趨于正常水平,可為臨床肺部感染合并肺不張患者提供診斷依據。

