新型冠狀病毒的研究現狀與實驗室診斷*
靳偉東 綜述,張東云,謝鳳欣,府偉靈,張 陽 審校
(陸軍軍醫大學第一附屬醫院檢驗科,重慶 400038)
自2019年底湖北武漢出現不明原因肺炎以來,中國疾病預防控制中心傳染病預防控制所聯合多家科研單位先后通過高通量測序獲得了新型冠狀病毒(SARS-CoV-2)[1]的全基因組序列,并成功分離了我國第1株SARS-CoV-2。這是自2002年嚴重急性呼吸綜合征病毒(SARS-CoV)和2012年中東呼吸綜合征病毒(MERS-CoV)暴發以來,冠狀病毒再一次大規模感染人類。盡快解析病毒復制及感染宿主的機制對于疫情的防控與治療性疫苗的研制至關重要。與此同時,及時對疑似患者進行病毒核酸檢測和對易感人群進行快速篩查顯得尤為重要。在前六版的新型冠狀病毒肺炎(COVID-19)診療方案中,核酸檢測仍是SARS-CoV-2感染的確診依據,病毒基因測序與實時熒光定量PCR(qPCR)檢測為實驗室檢測中唯一的確診方法。隨著研究的深入,國家衛生健康委員會最新發布的《新型冠狀病毒肺炎診療方案(試行第七版)》中,新增“將血清SARS-CoV-2特異性免疫球蛋白(Ig)M 和IgG抗體陽性作為病原學診斷標準之一”。本文將圍繞SARS-CoV-2分子生物學特征、實驗室診斷方法的最新進展及可能影響檢測結果及時性、準確性的因素進行述評。
1 SARS-CoV-2的結構特征
冠狀病毒(命名時簡寫為“CoV”)是大型有包膜的正鏈RNA病毒,于1965年被分離出來,以其在顯微鏡下可見如日冕般外圍的冠狀特征而得名,在基因型和血清學上分為四個屬,即α,β,γ和δ冠狀病毒[2-3]。迄今為止被發現的冠狀病毒中(包括此次發現的SARS-CoV-2),只有7種可以使人類感染。其中,HCoV-OC43、SARS-CoV、HCoV-HKU1、MERS-CoV、SARS-CoV-2都屬于β屬冠狀病毒[4-6]。
SARS-CoV-2與2003年的SARS-CoV一樣,基本結構為基因組RNA和磷酸化核衣殼蛋白(N蛋白)組成的包膜結構。包膜結構嵌合4種蛋白:刺突糖蛋白(S蛋白)、小包膜糖蛋白(E蛋白)、膜糖蛋白(M蛋白)和血凝素糖蛋白(HE蛋白)。N蛋白被埋在磷脂雙層中被兩種不同類型的刺突蛋白覆蓋,負責營養物質運輸的膜蛋白(M蛋白,屬于Ⅲ型跨膜糖蛋白)和E蛋白位于病毒包膜的S蛋白之間,見圖1。2020年1月6日,研究人員通過電子顯微鏡解析了SARS-CoV-2的顯微結構:SARS-CoV-2病毒顆粒形狀并不規則,呈球形或呈多形性,直徑75~160 nm,病毒顆粒邊緣有形態近似日冕的突起,約9~12 nm,這一形態與冠狀病毒科一致。1月16日,上海科技大學饒子和團隊率先解析了SARS-CoV-2病毒RNA復制最關鍵蛋白-3CL水解酶(Mpro)的高分率晶體結構[7]。隨后,美國德克薩斯大學奧斯汀分校的研究人員利用冷凍電鏡Cryo-EM技術成功解析了SARS-CoV-2刺突蛋白三聚體3.5埃的近原子分辨率結構[8],從生物物理及結構生物學的角度解析了SARS-CoV-2,為相關疫苗的研發工作奠定了基礎。
2 SARS-CoV-2的核酸分子特征與遺傳變異
在SARS-CoV-2流行之前,21世紀已經暴發了另外兩種高致病性冠狀病毒,即SARS-CoV和MERS-CoV。這些病毒的暴發是由于人畜共患型冠狀病毒越過物種壁壘而導致的[9-10]。研究表明,SARS-CoV-2與SARS-CoV、MERS-CoV在臨床表現方面顯示出若干相似之處,即都能引起嚴重的呼吸系統疾病[11]。
2.1SARS-CoV-2全基因組分析 截至目前,國家生物信息中心2019新型冠狀病毒信息庫(https://bigd.big.ac.cn/ncov)已收錄了來自世界各地的283條SARS-CoV-2的完整或部分基因組序列。SARS-CoV-2全基因組包含近30 000個核苷酸堿基,由1a、1ab、S、3a、3b、E、M、6、7a、7b、8b、9b、N和ORF14等14個蛋白編碼區域(CDS)構成[12],見圖2。對SARS-CoV-2完整基因組進行Blastn搜索顯示,GenBank中與SARS-CoV-2最相關的病毒是2個蝙蝠類SARS樣冠狀病毒:SL-CoVZC45病毒(序列同一性為87.6%,查詢覆蓋率99%)和SL-CoVZXC21病毒(序列同一性為87.5%,查詢覆蓋率98%)。SARS-CoV亦起源于蝙蝠SARS樣冠狀病毒,而與MERS冠狀病毒的距離更遠。SARS-CoV-2與SL-CoVZC45、SL-CoVZXC21在5個基因編碼區域(E、M、7、N和14)中的序列同一性大于90%,在E基因中最高(98.7%),而在S基因中最低,僅為75%左右[13]。
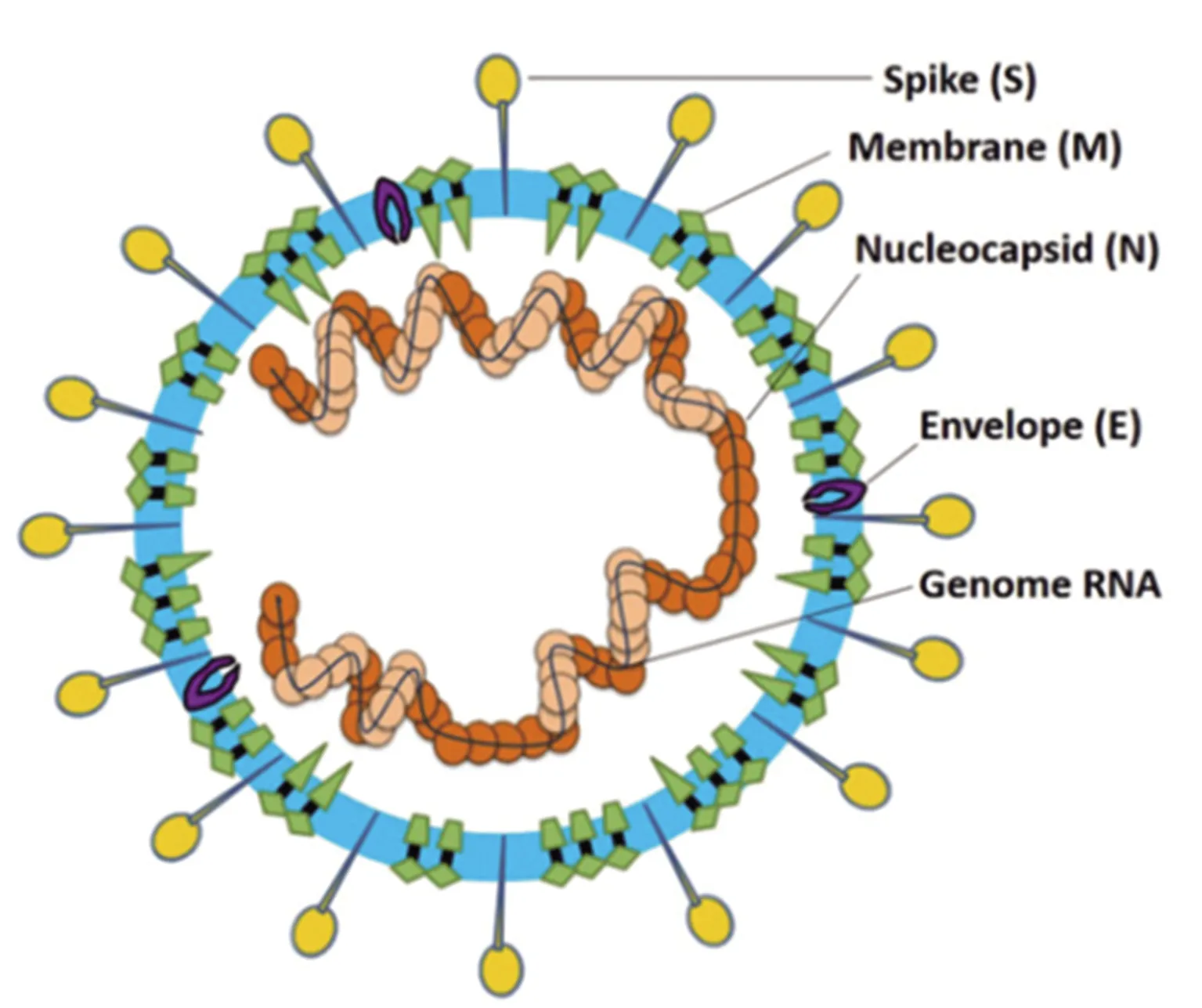
圖1 冠狀病毒結構模式圖
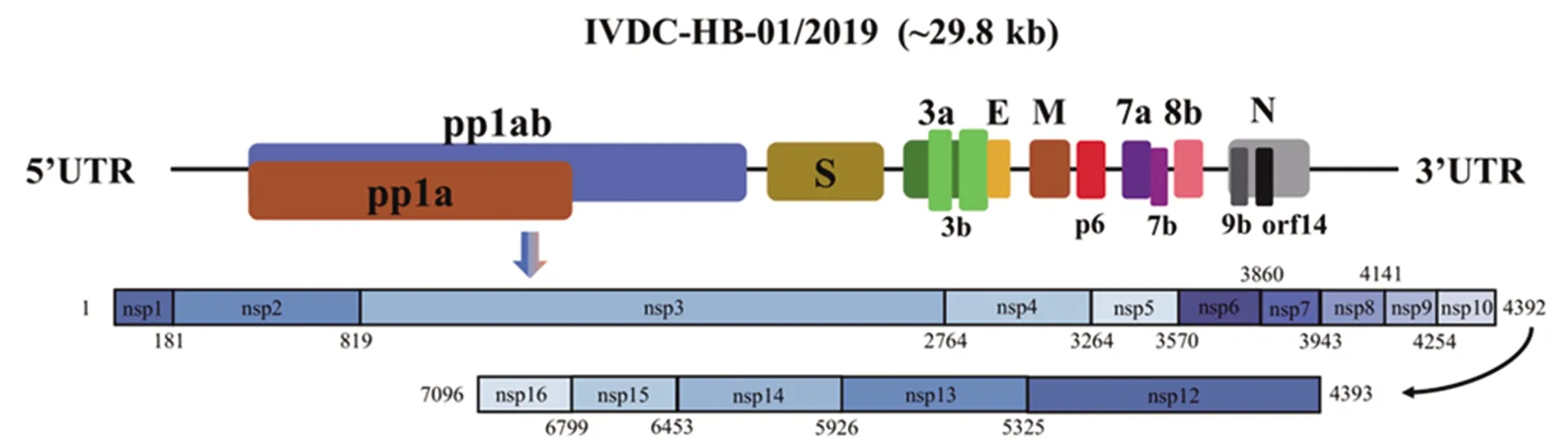
圖2 SARS-CoV-2全基因組構成
2.2SARS-CoV-2的分子特征與遺傳變異 流行病學調查結果表明,SARS-CoV-2最初的感染病例與接觸在動物市場上出售的活體動物有關。XU等[14]通過比較最初分離出來的6株SARS-CoV-2的基因型(序列號分別為:MN908947、EPI_ISL_402119、EPI_ISL_402120、EPI_ISL_402121、EPI_ISL_402123和EPI_ISL_402124),發現這6株病毒的基因型極其保守,同源性>99%。隨后,他們又比較了SARS-CoV-2與已知感染人類的SARS-CoV和MERS-CoV的基因組序列。結果顯示,SARS-CoV-2基因組與SARS-CoV的基因組具有比MERS-CoV更好的序列同源性[14]。根據冠狀病毒的系統發生樹,SARS-CoV-2與SARS-CoV的同源性達到79%,而與MERS-CoV的同源性僅為50%[14]。SARS-CoV-2與SARS-CoV之間的序列多樣性主要存在于ORF1a和S蛋白基因中。與SARS-CoV和MERS-CoV相比,SARS-CoV-2最顯著的遺傳特征是其編碼更長的S蛋白[13]。研究發現用于冠狀病毒物種分類的ORF1ab編碼區中的7個保守復制酶結構域在SARS-CoV-2和SARS-CoV之間有94.6%的氨基酸序列一致[15],這意味著兩者屬于同種類病毒。值得注意的是,TANG等[16]的最新研究發現,SARS-CoV-2已于近期發生了突變,并演化出了L型和S型2個不同的亞型。2個亞型的區別在于病毒RNA基因組的第28 144位點,L型是T堿基(對應亮氨酸),S型是C堿基(對應絲氨酸)。根據基因組數據結果,L型毒株在COVID-19患者人群中占比70%,而S型僅占比30%,推測L型病毒具有比S型更強的傳染力。對不同亞型的深入研究,將有助于筆者對COVID-19的差異化治療和防控。
2.3SARS-CoV-2的溯源分析 在病毒的溯源分析研究中,根據基因測序結果發現SARS-CoV-2與一種蝙蝠冠狀病毒RaTG13的全基因組序列相似性達到96.2%,推測RaTG13病毒是SARS-CoV-2的最初起源[17]。進一步研究發現,SARS-CoV-2與RaTG13在S1受體結合域的序列相似性低于75%,表明RaTG13病毒不能直接傳染人類,而是通過遺傳變異成為SARS-CoV-2最終使人患病。冠狀病毒的遺傳變異需要有中間宿主,XIAO等[18]解析了從馬來亞穿山甲身上分離的一株冠狀病毒的基因組序列,發現該病毒與SARS-CoV-2在E、M、N、S區表現出100.0%、 98.2%、96.7%和90.4%的氨基酸同一性,而在受體結構域僅相差1個氨基酸,推測穿山甲可能是SARS-CoV-2的潛在中間宿主。
3 SARS-CoV-2致病的分子機制及潛在的藥物靶點
根據病毒的作用機制找到合適的藥物作用靶點,已經成為抗SARS-CoV-2藥物研究的熱點。SARS-CoV-2感染宿主的主要過程包括附著和進入宿主細胞、復制酶的翻譯和復制轉錄復合體的組裝、基因復制和轉錄、結構性蛋白的翻譯和病毒粒的組裝和釋放等。進入宿主細胞是SARS-CoV-2復制周期的首要步驟,主要決定因素是病毒顆粒最外層的S蛋白與細胞表面受體的有效結合。ZHOU等[15]的研究發現,SARS-CoV-2和SARS-CoV類似,可能是通過蛋白受體-血管緊張素轉換酶2(ACE2)的靶向識別進入細胞的,SARS-CoV-2的S蛋白上的受體結合域(RBD)與ACE2有很強的結合自由能。因此,針對人類細胞表面受體ACE2 蛋白進行新藥研發,競爭性結合ACE2受體,有可能會得到理想的抗病毒效果。同時,S1亞基的RBD也可作為抗COVID-19藥物和疫苗研發的重要作用靶點。有研究報道,通過比較分析SARS-CoV-2及其近親病毒在內的1 000個冠狀病毒的S蛋白序列,發現和SARS冠狀病毒相比,其S蛋白在S1/S2的酶切位點多出了PRRA 4個氨基酸的插入,從而形成能被人類弗林蛋白酶識別的“RRAR”序列。揭示了SARS-CoV-2 S蛋白中弗林蛋白酶切位點的插入可能是其傳染能力增強的1個重要因素,提示弗林蛋白酶可能是抗SARS-CoV-2治療的新靶點[19]。此外,冠狀病毒的非結構蛋白對病毒的復制和組裝等過程同樣起著非常重要的作用,其中3-胰凝乳樣蛋白酶、 木瓜樣蛋白酶參與多肽翻譯 ,RNA依賴的RNA聚合酶(RdRp)參與病毒復制。因此,這3種蛋白酶也可作為抗病毒藥物研發的重要靶點[20-21]。
4 SARS-CoV-2感染的實驗室檢測
由于該病毒傳播速度快,潛伏期較長,因此SARS-CoV-2的實驗室檢測技術受到人們的廣泛關注。目前冠狀病毒的檢測主要有2個發展趨勢:方法的多樣性和多種方法互補聯合使用。當前針對SARS-CoV-2感染病例的實驗室檢測主要包括一般血常規檢查、呼吸道病原學檢查和血清學檢查等。
4.1患者常規實驗室診斷異常表現 根據國家衛生健康委員會最新公布的《新型冠狀病毒肺炎診療方案(試行第七版)》,患者以發熱、干咳、乏力為主要臨床表現。少數患者伴有鼻塞、流涕、咽痛、肌痛和腹瀉等癥狀。重癥患者多在發病1周后出現呼吸困難和(或)低氧血癥,嚴重者可快速進展為急性呼吸窘迫綜合征、膿毒癥休克、難以糾正的代謝性酸中毒和凝血功能障礙及多器官功能衰竭等。
鐘南山團隊在NEJM雜志上發表的一篇文章詳細報道了SARS-CoV-2感染患者的臨床特征[22]。該研究發現,與SARS病毒類似,SARS-CoV-2感染患者以發熱和咳嗽為主要臨床表現,而胃腸道癥狀并不常見。從血液檢查結果來看,有83.2%的患者出現淋巴細胞減少,36.2%的患者血小板減少,33.7%的患者白細胞減少。多數患者的C-反應蛋白水平升高,而較不常見的臨床生化特征是丙氨酸氨基轉移酶、天門冬氨酸氨基轉移酶、肌酸激酶和D-二聚體水平的升高。該研究還指出,重癥患者的實驗室結果異常(包括淋巴細胞減少和白細胞減少)比非重癥患者表現更為突出。針對COVID-19的疾病分型和預后,TAN等[23]提出了一種起病時間-淋巴細胞模型,該模型能夠通過外周血淋巴細胞百分比判斷COVID-19患者的輕重程度、疾病預后及治療反應。此外,還有研究指出中性粒細胞/淋巴細胞比值和紅細胞分布寬度標準差也有可能是鑒別COVID-19普通型與重型的重要指標。
4.2病原學檢測 病毒的病原學檢測方法有細胞培養、血清學檢測、核酸檢測、電鏡檢測等。與其他方法相比,核酸分子的檢測具有快速、靈敏度和特異度高等特點,已成為冠狀病毒檢測的主流方法[24]。現有的冠狀病毒核酸檢測方法包括全基因組測序、qPCR法、CRISPR、反轉錄環介導等溫擴增法(RT-LAMP)和實時RT-LAMP等。針對SARS-CoV-2核酸的檢測,當前最為普遍適用的方法是qPCR法,即通過對標本中的病毒RNA進行提取、反轉錄、PCR擴增特定保守序列后,通過熒光等常規方法進行顯示。依賴于SARS-CoV-2與SARS-CoV的密切遺傳相關性,臨床上對SARS-CoV-2的核酸檢測所選用的引物設計靶點和SARS-CoV一致,通過擴增RNA依賴性的RdRp基因、E蛋白基因和N蛋白基因序列來檢測SARS-CoV-2是否存在[25]。SARS-CoV-2病毒核酸檢測的3個基因靶標在全基因組中的位置見圖3。
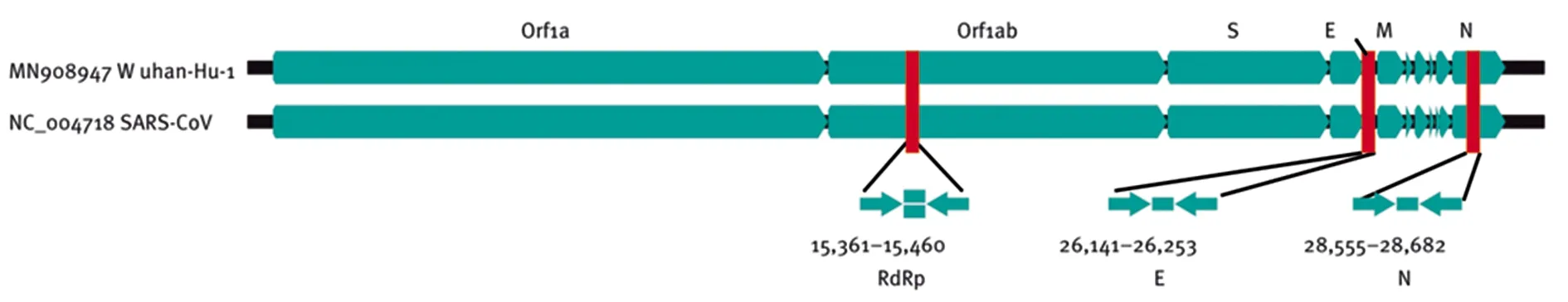
圖3 SARS-CoV-2和SARS冠狀病毒基因組上擴增子靶標的相對位置[25]。
在COVID-19患者的早期診斷中,具有以下病原學證據之一的患者可被確診為SARS-CoV-2感染:一是呼吸道標本或血液標本qPCR 檢測SARS-CoV-2核酸陽性;二是呼吸道標本或血液標本病毒基因測序,與已知的SARS-CoV-2高度同源。目前市場上絕大部分SARS-CoV-2病毒核酸檢測試劑盒采用一步法或磁珠法進行病毒核酸的提取,以ORF1ab和N基因作為檢測靶標進行擴增,最后通過熒光檢測得到所需的結果,具有快速、易操作等特點。
然而,在大量的臨床應用過程中發現核酸檢測存在假陰性等不確定的情況。鑒于此,國家衛生健康委員會印發《新型冠狀病毒肺炎防控方案(第五版)》,在實驗室檢測技術指南中明確指出,核酸檢測結果陰性不能排除SARS-CoV-2感染,需要排除可能產生假陰性的因素。核酸檢測假陰性的原因應考慮以下幾個方面:(1)被感染者體內病毒未達到一定水平;(2)采集患者標本時,未采集到含有病毒的標本;(3)體外診斷試劑不夠靈敏;(4)不規范的核酸檢測程序。此外,通過對6種國產SARS-CoV-2核酸檢測試劑的檢測性能進行了比較和分析,發現6種試劑對弱陽性標本的檢測能力參差不齊,少數試劑對SARS-CoV-2(ORF1ab和N基因)均能檢出,而部分試劑只能檢測出其中1個[26],說明當前各試劑的準確性和重復性還有待提高。
4.3血清學檢查 炎癥細胞因子風暴是在高致病性冠狀病毒感染(如SARS、MERS)中被觀察到的典型異常,且被認為與疾病嚴重程度有關。最近也有研究報道,SARS-CoV-2感染患者的血清中出現炎癥細胞因子水平升高的現象[27]。根據目前最新的《新型冠狀病毒肺炎診療方案(試行第七版)》,血清學抗體檢測已被納入COVID-19確診標準之一。與核酸檢測相比,抗體檢測具有采樣簡單、檢測效率高等特點。IgM抗體是免疫應答中首先分泌的抗體,是病毒感染自體免疫過程中最早出現的抗體,可作為近期急性感染的標志。在通常情況下,IgM 抗體產生早,一經感染,快速產生,多在3~5 d后開始出現陽性,維持時間短,消失快,血液中IgM檢測陽性可作為早期感染的指標。IgG 抗體產生晚、維持時間長、消失慢、滴度恢復期較急性期有4倍及以上增高,血液中檢測陽性可作為感染和既往感染的指標。因此,通過檢測患者血清中 IgM 和 IgG 的陽性情況,將有助于判斷患者所處SARS-CoV-2感染的不同時期。
5 其他病毒感染篩查技術的發展
雖然核酸檢測是SARS-CoV-2檢測的最常用的手段,但也受到諸多因素的限制,比如實施核酸檢測需要有專門的儀器和標準的分子檢測實驗室,防止檢測人員受到待檢血液或其他體液標本的感染,且取樣過程或其他原因可能會導致qPCR結果出現假陰性或漏檢,從而使檢測靈敏度降低。因此,研發出新的SARS-CoV-2病毒篩查診斷技術將有利于推動本次及今后的疫情防控工作。
5.1基于抗原/抗體檢測的即時檢驗(POCT)產品 和核酸檢測相比,基于抗體檢測的POCT可在數分鐘內出結果,操作簡單方便,適用于大批量標本的快速篩查。目前已有多家SARS-CoV-2抗體快速檢測試劑盒獲批上市。抗體檢測法主要是采集COVID-19患者血清或血漿,通過檢測其中IgM或IgG抗體濃度值間接檢測SARS-CoV-2,可用于疑似病例中核酸檢測為陰性的患者的輔助診斷,同時也可以部分反映確診患者的免疫情況。2020年3月5日,電子科技大學楊正林教授團隊研發的SARS-CoV-2 IgM/IgG抗體檢測試劑盒(膠體金法)獲得歐盟準入資格,可快速、準確檢查人體血清中病毒特異性IgM和IgG抗體。與此同時,重慶醫科大學黃愛龍教授團隊牽頭研發的SARS-CoV-2 IgM/IgG抗體檢測試劑盒(磁微粒化學發光法),通過國家藥品監管局審批。李泉等[28]臨床一線工作人員通過25例確診患者與17例疑似病例分析了上述IgM/IgG抗體檢測在SARS-CoV-2肺炎診斷中的應用價值,臨床檢測結果靈敏度達到了96%,特異度為100%。此外,鐘南山院士團隊近期發表論文描述了SARS-CoV-2 IgM/IgG聯合抗體檢測試劑的研發及在SARS-CoV-2感染性疾病臨床診斷中的應用[29]。該檢測試劑只需滴血可驗,約15 min就能出結果,相比需要3~4 h出結果的病毒核酸qPCR檢測,大大縮短了檢測的時間。經過多中心的臨床標本檢測評價證實,該檢測試劑的臨床檢測的靈敏度高達88.66%,檢測特異度為90.63%;IgM/IgG聯合抗體檢測的敏感性(靈敏度為94.83%)遠高于IgM或IgG單抗體檢測(靈敏度分別為1.72%、3.45%)。另外,該抗體檢測試劑采用指尖血與靜脈血檢測結果作對比,發現兩者檢測的一致性基本吻合,提示SARS-CoV-2 IgM/IgG聯合抗體快速檢測試劑盒可用于POCT,可以在床旁用指尖采血進行檢查。這一便捷、快速、安全,靈敏度高的抗體檢測試劑盒,既可作為病毒核酸檢測陰性患者的補充檢測提高臨床診斷率,也可以作為快速篩查的手段,在全國復工、復產、復學等大面積人員流動和聚集的時期發揮篩查的優勢。截至目前,國家藥品監督管理局共批準SARS-CoV-2抗體檢測試劑8個,采用的檢測方法主要有膠體金法和化學發光法,見表1。除了IgM/IgG抗體檢測外,還有一類抗原檢測的策略,被檢測對象為血漿中的病毒抗原包括N蛋白和S蛋白[30],通過免疫膠體金法、免疫熒光層析法和高通量化學發光技術等發展為特異性的POCT產品。

表1 目前獲批上市的SARS-CoV-2抗體檢測試劑
5.2高通量呼吸道感染病原體篩查芯片 早期篩查診斷是SARS-CoV-2疫情防控的關鍵環節之一。為了有效解決集中檢測造成的醫療資源透支和交叉感染的問題,亟需發展核酸提取與擴增一體化、減少“開蓋關節”與氣溶膠污染、不依賴專業技術人員的現場快速分子檢測新技術。上海交通大學譚蔚泓院士團隊開發了一種SARS-CoV-2家庭簡易快速檢測試劑盒,該試劑盒突破了核酸快提、恒溫反轉錄擴增、便攜式實時熒光檢測和比色檢測等關鍵技術,可根據病毒或病原體相關基因信息設計不同的引物,實現對包括SARS-CoV-2在內的各種病原體的快速現場和家庭檢測。近期由清華大學程京團隊共同設計開發的包括SARS-CoV-2在內的“六項呼吸道病毒核酸檢測試劑盒(恒溫擴增芯片法)”也獲得了國家藥監局SARS-CoV-2應急醫療器械審批批準。該技術是用于呼吸道感染多病毒檢測的全新微流控芯片系統,只需采集患者的咽拭子等呼吸道分泌物標本,便可在1.5 h內一次性檢測包括SARS-CoV-2在內的6種呼吸道常見病毒,具有高通量快速檢測、多指標聯合檢測等特點。此外,基因芯片技術在病毒的檢測中也扮演著十分重要的角色。與傳統的分子生物學技術相比,基因芯片最大的特色在于其能夠實現對病原體的高通量篩查。
6 SARS-CoV-2的生物安全防護策略
大量的流行病學研究證實,SARS-CoV-2的主要傳播途徑仍然是呼吸道飛沫傳播和密切接觸傳播。此外,日本“鉆石公主號”郵輪在海上隔離,1例患者致該船上數百名游客陸續感染的案例,間接證明了SARS-CoV-2可經氣溶膠傳播。在生物標本方面,先后從COVID-19患者的糞便和尿液標本中分離出了SARS-CoV-2,證實了患者體液中存在活病毒,提示COVID-19患者體液標本存在實驗室污染的可能性,對實驗室標本處理與安全防控提出了新的挑戰。2月 6 日,國家衛生健康委員會發布了《新型冠狀病毒肺炎防控方案(第四版)》,其中對標本的采集和處理做了具體的指示和說明,現將實驗室生物安全防護要點總結如下。
6.1標本處理 標本采集后須在生物安全二級實驗室生物安全柜內進行分裝,標本包裝要求要符合《危險品航空安全運輸技術細則》相應的標準。涉及外部標本運輸的,應根據標本類型,按照 A 類或 B 類感染性物質進行3層包裝。廢棄標本的處理應該按照《醫療廢物管理條例》進行,對廢棄物中可能含病原體的標本、耗材、實驗廢液等高危險廢棄物,實驗人員需要在實驗室就地進行壓力蒸汽滅菌或者化學消毒處理。而對于感染性廢液,需要用有效氯含量0.55%消毒劑浸泡,并驗證滅菌效果后,排入實驗室水處理系統。
6.2人員防護 國家衛生健康委員會公布的《新型冠狀病毒實驗室生物安全指南(第二版)》對實驗活動生物安全的個人防護作了明確要求。按照指南,活病毒感染動物、感染動物取樣、感染性標本處理和檢測、感染動物特殊檢查、感染動物排泄物處理等實驗操作,應當在生物安全三級實驗室操作。未經培養的感染性材料在采用可靠的方法滅活前進行的病毒抗原檢測、血清學檢測、核酸提取、生化分析及臨床標本的滅活等操作,應當在生物安全二級實驗室進行,同時采用生物安全三級實驗室的個人防護。感染性材料或活病毒在采用可靠的方法滅活后進行的核酸檢測、抗原檢測、血清學檢測、生化分析等操作應當在生物安全二級實驗室進行。
7 展 望
SARS-CoV-2病毒在全球范圍內的傳播對世界公共健康構成了巨大威脅。實驗室檢測手段的加強能夠在一定程度上減少甚至遏制SARS-CoV-2的傳播。雖然核酸檢測仍是SARS-CoV-2感染的確診依據,但是目前也有許多實驗室研發出了基于抗原、抗體檢測的新技術。這些新興診斷技術與核酸檢測優勢互補,聯合使用后可以大大提高SARS-CoV-2的排查率。鑒于實驗室檢查結果在疾病診斷中的重要作用,多技術聯合核酸檢測有望成為今后確診SARS-CoV-2感染的發展方向。

