卵巢腫瘤組織中CXCL9mRNA表達與患者的預后、免疫微環境特征的相關性研究
上海交通大學醫學院附屬仁濟醫院婦產科,上海市婦科腫瘤重點實驗室,上海 200127
在婦科惡性腫瘤中,卵巢癌的惡性程度及死亡率均位列第一[1]。由于卵巢癌起病隱匿且缺乏早期檢測方法,超過70%的患者在初診時即已發生癌細胞轉移。盡管晚期卵巢癌患者可從腫瘤細胞減滅術及紫杉醇聯合鉑類一線化學治療(化療)中獲益,但75%以上的晚期患者仍會復發并最終導致死亡[2]。已有研究[3]證實卵巢癌的微環境免疫特征與患者預后密切相關,即與無腫瘤浸潤淋巴細胞(尤其是CD3+T細胞)的卵巢癌患者相比,存在有該細胞的卵巢癌患者的5年生存率提高了8倍(4.5%vs38%)。
在腫瘤微環境中,免疫細胞的遷移及激活與趨化因子家族密切相關。其中,趨化因子CXCL9(C-X-C motif chemokine ligand 9)及相關趨化因子受體CXCR3(C-X-C motif chemokine receptor 3)發揮了至關重要的作用[4-6]。CXCL9是一種響應干擾素γ(interferon-γ,IFN-γ)誘導且參與免疫炎癥反應相關細胞生長、遷移及激活的趨化因子。當CXCL9與表達于單核細胞、激活T細胞、自然殺傷細胞(natural killer cell,NK cell,簡稱NK細胞)、樹突狀細胞(dendritic cell,DC)表面的CXCR3相結合,可介導淋巴細胞浸潤至病灶部位以發揮免疫細胞抗腫瘤功能。在穩態中,CXCL9于單核細胞、內皮細胞和成纖維細胞中低水平表達,但在IFN-γ和腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)等細胞因子刺激下其表達將顯著上調[4,7-8]。Gorbachev等[9]對小鼠體內的研究發現,與表達CXCL9的腫瘤細胞相比,存在CXCL9表達缺陷的腫瘤細胞具有更強的成瘤性,繼而推測CXCL9表達缺失是腫瘤細胞逃避抗腫瘤免疫反應的一種機制。研究者對腫瘤微環境進一步分析發現,CXCL9表達受IFN-γ誘導上調,并能夠與T、B和NK細胞表達的CXCR3結合以募集淋巴細胞至腫瘤微環境[5-6]。同時有較多實驗[10-12]表明,CXCL9表達不足會大大削弱免疫細胞介導的抗腫瘤免疫反應。
基于此,本研究以癌癥基因組圖譜(The Cancer Genome Atlas,TCGA)數據庫中卵巢癌組織測序數據集進行生物信息學分析,探究CXCL9mRNA表達對總體生存期的影響,并通過基因集富集分析(Gene Set Enrichment Analysis,GSEA)挖掘CXCL9mRNA在卵巢癌中的生物學功能,分析CXCL9mRNA表達與細胞分化抗原8A(cluster of differentiation 8A,CD8A)及免疫檢查點的mRNA表達的相關性,以期為免疫檢查點阻斷治療卵巢癌的生物標志物研究提供可能性依據。
1 資料與方法
1.1 數據來源
UCSC(https://xenabrowser.net/datapages/)是一個被公認的能夠對TCGA數據進行標準化清洗與處理的網站。本研究從該網站下載獲得由AffyU133A基因芯片測量得到的TCGA漿液性卵巢癌數據集。同時,本研究使用的另一部分數據來源于R包curatedOvarianData[13],共包含來自23項研究中的2 970個患者的基因表達譜數據及生存數據,其中有16組研究的樣本表達譜和患者生存數據可用于計算中位生存期,具體數據集包括E.MTAB.386、GSE13876、GSE14764、GSE17260、GSE18520、GSE19829、GGSE26193、GSE26712、GSE30161、GSE32062、GSE49997、GSE51088、GSE9891、PMID17290060c、TCGARNAseqV2、TCGA。
1.2 CXCL9 mRNA表達及其與總體生存期的相關性分析
采用Log-rank檢驗法對來自GEPIA(Gene Expression Profiling Interactive Analysis,GEPIA)網 站[14]的TCGA漿液性卵巢癌組織與癌旁組織中CXCL9mRNA的表達情況進行分析。根據CXCL9的每千個堿基的轉錄每百萬映射讀取的轉錄本(transcripts per kilobase of exon model per million mapped reads,TPM)中位數,將424個漿液性卵巢癌組織分為CXCL9低表達組(212例)與CXCL9高表達組(212例)。采用Kaplan-Meier法分析2組組織中CXCL9mRNA表達對卵巢癌患者總體生存期的影響。同時,本研究使用由R包curatedOvarianData[13]內含的卵巢癌樣本數據及其相應臨床數據繪制森林圖,探究大樣本基數下CXCL9mRNA對卵巢癌患者總體生存期的影響。
1.3 GSEA
于GSEA門戶網站(https://www.gsea-msigdb.org/gsea/index.jsp)下載GSEA軟件[15]。GSEA是一種計算方法,用來確定一組先驗基因在2種生物狀態之間是否表現出統計學上的顯著一致性差異。GSEA軟件包含分子簽名(Molecular Signatures Database,MSigDB)數據庫,研究人員可以從該數據庫中選擇感興趣的功能基因集進行分析。本研究選用GSEA軟件內附帶的MSigDB數據庫中的c2.cp.kegg.v.7.0功能基因集,將TCGA漿液性卵巢癌數據集全基因表達譜作為輸入文件,計算c2.cp.kegg.v.7.0功能基因集中各生物學通路在CXCL9高表達組與CXCL9低表達組中的差異,最終得出基因集在2組中的富集評分。
1.4 CXCL9 mRNA表達與CD8A及免疫檢查點mRNA表達的相關性分析
使用在線分析網站GEPIA的correlation功能,計算CD8A、程序性死亡受體-1(programmed death-1,PD-1)、程序性死亡配體-1(programmed death ligand-1,PD-L1)、細胞毒性T淋巴細胞相關蛋白4(cytotoxic T-lymphocyteassociated protein 4,CTLA4)的mRNA表達與CXCL9mRNA表達之間的關系。將log2(CXCL9TPM)作為X軸,依次將log2轉換后的CD8A、PD-1、CTLA4及PD-L1的TPM值作為Y軸,使用Pearson相關分析研究其表達間的相關性,并采用t檢驗判定該相關性是否具有顯著意義。
2 結果
2.1 預后相關預測因子分析
本研究針對GEPIA網站提供的TCGA漿液性卵巢癌組織和癌旁組織的CXCL9mRNA表達數據進行分析,結果(圖1A)顯示CXCL9mRNA在卵巢癌組織中的表達水平較高(P<0.05),繼而提示CXCL9表達具有腫瘤組織特異性。隨后,使用Kaplan-Meier法評估CXCL9高表達組與CXCL9低表達組的生存曲線,結果(圖1B)顯示在TCGA漿液性卵巢癌數據中,CXCL9是漿液性卵巢癌預后良好的預測因子(Log-rankP=0.010)。
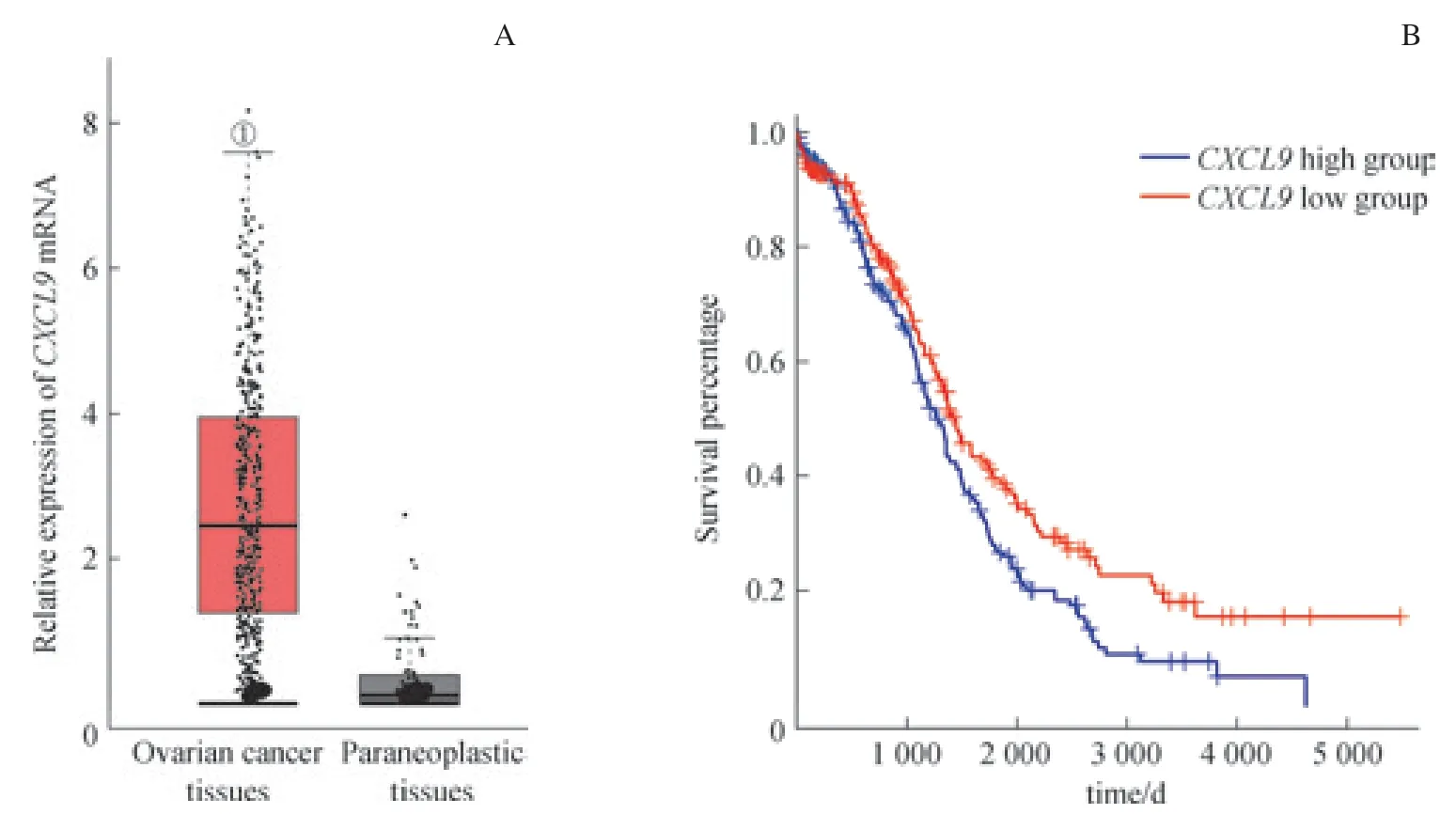
圖1 CXCL9 mRNA在TCGA漿液性卵巢癌組織中的表達情況及總體生存期分析Fig 1 Analysis of CXCL9 mRNA expression and overall survival in TCGA serous ovarian cancer tissues
由于TCGA數據庫中的卵巢癌樣本均為漿液性卵巢癌,為擴大卵巢癌的組織學類型,本研究使用R包curatedOvarianData中的16組研究的樣本表達譜及患者生存數據進行進一步分析,即將趨化因子CXCL9表達作為整體生存的單變量預測因子并繪制森林圖;其中,風險比(hazard ratio,HR)>1表示CXCL9mRNA表達與預后不良相關,HR<1則表示與預后良好相關。結果(圖2)顯示僅有GSE19829、GSE14764、GSE26193數據集的HR>1,提示CXCL9mRNA表達或與卵巢癌預后不良相關。
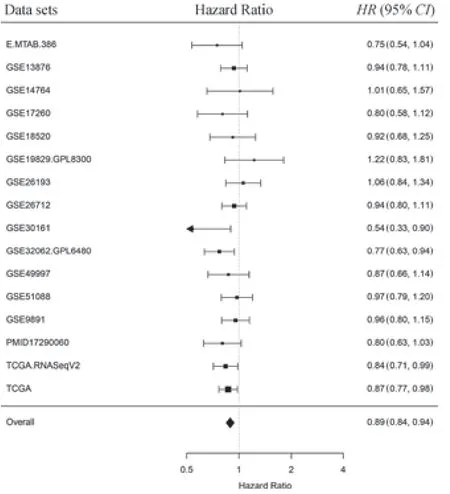
圖2 卵巢癌數據集中CXCL9 mRNA表達與總體生存期的森林圖Fig 2 Forest plot of the expression of CXCL9 mRNA in ovarian cancer datasets
2.2 CXCL9 mRNA表達在TCGA漿液性卵巢癌組織中的生物學功能分析
本研究使用TCGA 漿液性卵巢癌數據集,根據 GSEA中的c2.cp.kegg.v.7.0 功能基因集對CXCL9高表達組與CXCL9低表達組的組織進行富集分析,結果(圖3)顯示與免疫細胞遷移、激活有關的功能通路在CXCL9高表達組中的表達均較高,而在CXCL9低表達組中則較低;繼而提示,CXCL9mRNA表達主要與細胞因子及其受體相互作用通路、NK細胞介導的細胞毒性通路、Janus激酶(Janus kinase,JAK)-信號轉導子和轉錄活化子(signal transducer and activator of transcription,STAT)信號通路、白細胞跨膜通路、T細胞受體信號通路以及抗原加工與提呈通路顯著相關;從而推斷,在卵巢癌微環境中,CXCL9mRNA高表達或對免疫細胞遷移、激活等功能發揮重要作用。
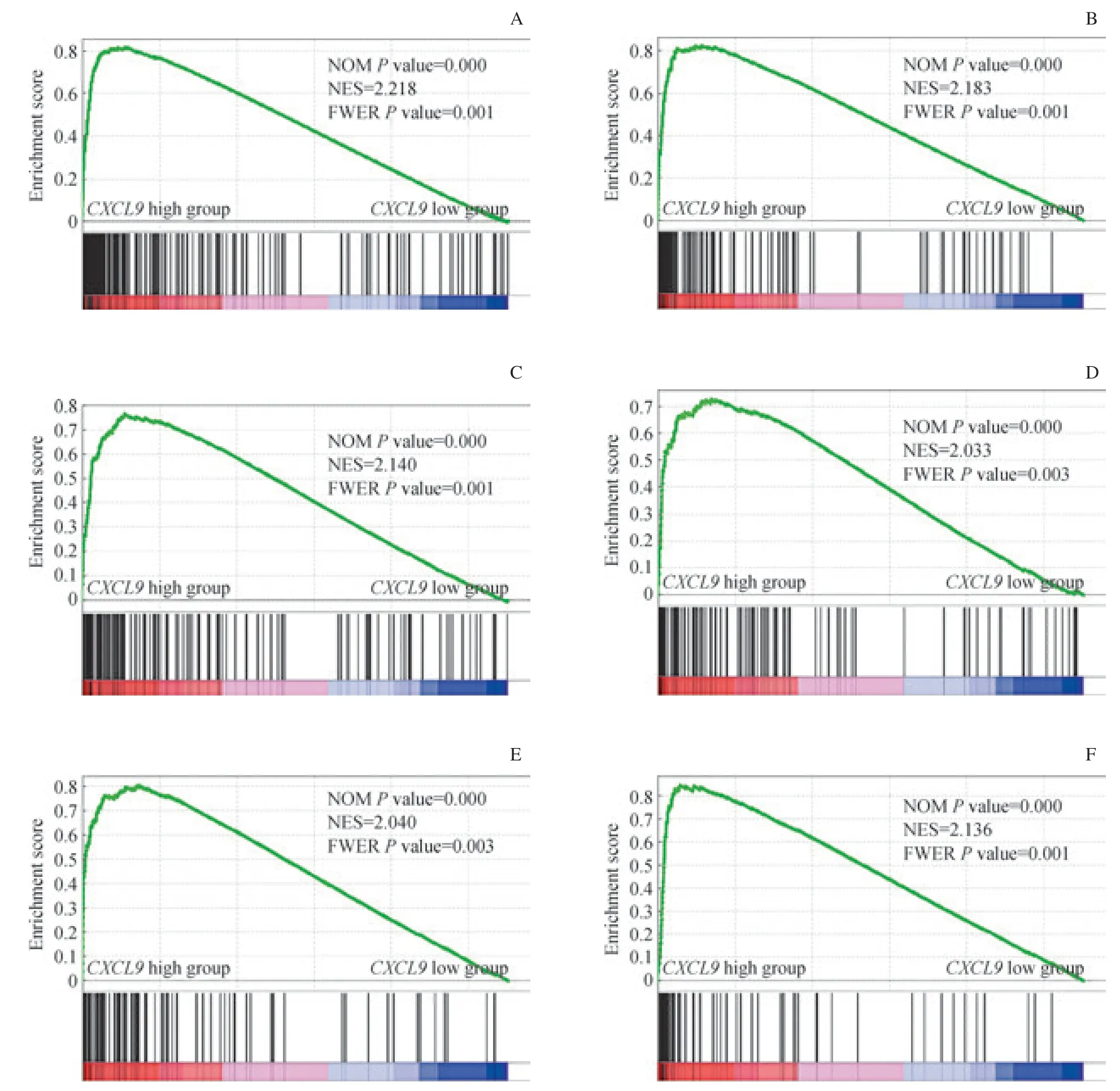
圖3 GSEA研究CXCL9 mRNA表達在TCGA漿液性卵巢癌組織中的生物學功能Fig 3 Analyze the biological function of the expression of CXCL9 mRNA in TCGA serous ovarian cancer tissues by GSEA
2.3 CXCL9 mRNA表達與CD8A及免疫檢查點mRNA表達的相關性分析
運用Pearson相關分析對TCGA漿液性卵巢癌腫瘤組織中CXCL9與CD8A、PD-L1、PD-1及CTLA4mRNA表達的相關性進行分析,其中R代表Pearson相關系數,表示兩者mRNA間的線性關系(即最大正相關為1、最大負相關為-1)。結果(圖4)顯示,CD8A、PD-L1、PD-1及CTLA4mRNA均與CXCL9mRNA表達存在顯著的線性正相關(均P<0.05),其中CTLA4、CD8A、PD-1的表達分別與CXCL9表達的線性相關系數均較高(R>0.7)。
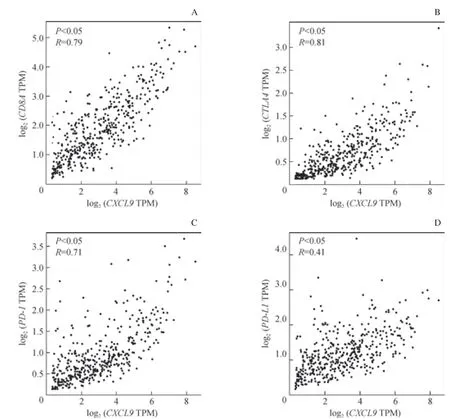
圖4 CXCL9與CD8A、CTLA4、PD-1及PD-L1 mRNA表達的相關性分析Fig 4 Correlation of mRNA expression levels of CXCL9 and CD8A, CTLA4, PD-1 and PD-L1
3 討論
過往研究已證實卵巢癌是一種免疫原性腫瘤,該腫瘤組織中的腫瘤浸潤淋巴細胞數目與患者的預后呈正相關。除腫瘤浸潤淋巴細胞數目外,腫瘤微環境中免疫效應細胞與抑制細胞的比例、免疫細胞浸潤位置及免疫細胞激活程度也是影響該患者預后及臨床免疫治療應答的重要因素。趨化因子CXCL9的表達與腫瘤微環境中的免疫細胞遷移、分化及激活密切相關,且對表達CXCR3的CD8+T細胞、Th1細胞、細胞毒性T細胞和NK細胞的抗腫瘤免疫反應具有積極影響[9-11]。
研究[16-17]顯示,CXCL9的高度表達與腎癌、胰腺導管腺癌等多種惡性腫瘤的總體生存期延長相關。有研究[16]使用免疫組織化學技術(免疫組化)對CXCL9在腎癌組織中的表達進行檢測,結果發現CXCL9的表達量與腫瘤大小、腫瘤微血管密度均呈負相關,與CD8+T細胞在腫瘤中的浸潤數量呈正相關。Bronger等[18]對184例高級別漿液性卵巢癌的CXCL9、CXCL10表達進行免疫組化分析,并使用CD3、CD56和FOXP3熒光抗體標記細胞以評估腫瘤浸潤淋巴細胞的數量;結果表明,CXCL9高表達是晚期高級別漿液性卵巢癌的有利預后因素,并推測CXCL9對腫瘤抑制性免疫細胞的趨化性募集可能是導致卵巢癌預后良好的原因。本研究中,我們根據TCGA漿液性卵巢癌數據集中CXCL9mRNA的TPM中位數將TCGA數據集分為CXCL9低表達組和CXCL9高表達組,并通過Kaplan-Meier法對2組的總體生存期進行分析,結果顯示CXCL9高表達組與預后良好顯著相關。為進一步擴大樣本量、減少抽樣誤差,本研究對16組研究的樣本表達譜及患者生存數據中CXCL9mRNA表達與總體生存期間的關系進行綜合分析,結果發現其表達亦與卵巢癌預后良好顯著相關。
目前,卵巢癌的死亡率位居婦科惡性腫瘤之首,且其患者總體生存期在過去30年間并沒有得到顯著提升,而以鉑類及紫杉醇類藥物為基礎的化療方式也一直未得到有效突破,因此急需探索除傳統化療之外的治療方法,如免疫治療。迄今已有多個臨床試驗證實,PD-1單抗在黑色素瘤、非小細胞肺癌、膀胱癌等多種腫瘤中具有顯著的臨床效果,而在卵巢癌中使用PD-1單抗單藥治療的客觀緩解率較低(為10%~15%)。因此,探索預測卵巢癌PD-1/PD-L1阻斷治療的生物標志物以有效篩選潛在獲益人群,成為了研究者們的共識。截至目前,大量研究已發現多種因素可影響PD-1單抗的藥物有效性,包括腫瘤微環境中抗腫瘤免疫細胞浸潤的數量與位置[19]、腫瘤負荷[20]、PD-L1表達水平[21]、抗原提呈缺陷[22]、干擾素信號傳導[23]及錯配修復缺陷[24]等。腫瘤組織PD-L1表達是目前應用范圍最廣的免疫檢查點抑制劑生物標志物,但就卵巢癌而言,即便是PD-L1陽性表達的人群,其對PD-1單抗的應答率依然較低。KEYNOTE-028臨床試驗[25]是一項關于PD-1單抗pembrolizumab的一期臨床試驗,該試驗共納入26例PD-L1陽性(PD-L1表達≥1%)的晚期卵巢癌患者,患者每2周接受1次pembrolizumab治療(10 mg/kg),持續24個月;結果顯示,其最終客觀緩解率為11.5%(1例完全緩解、2例局部緩解),中位無進展生存期及中位生存期分別為1.9個月和13.8個月。為進一步探究pembrolizumab在晚期卵巢癌患者中的療效,KEYNOTE-100臨床試驗[26]中入組376例復發性晚期卵巢癌患者,每3周接受1次pembrolizumab靜脈注射(200 mg);截至目前,該試驗中總人群的客觀緩解率僅為8%,其中PD-L1表達聯合陽性評分(combined positive score,CPS) <1的患者的客觀緩解率僅為5.0%,而CPS≥1(或CPS≥10)的患者的客觀緩解率也同樣較低,分別為10.2%(或17.1%)。該研究一方面提示在卵巢癌中PD-L1的表達水平與pembrolizumab療效具有一定的相關性,即PD-L1表達評分高的患者,采用pembrolizumab治療具有相對更高的客觀緩解率;另一方面亦提示即使將PD-L1表達CPS≥10作為篩選患者的陽性閾值,該人群的客觀緩解率依然不高。因此,在卵巢癌中為進一步精準篩選PD-1/PD-L1阻斷治療潛在獲益人群,急需探索其他生物標志物以更有效篩選患者。
綜上所述,在卵巢癌PD-1/PD-L1阻斷治療中,除進一步完善PD-L1等生物標志物的應用外,探索其他預測PD-1/PD-L1阻斷治療的生物標志物,或尋找新的生物標志物與已有標志物聯合使用成為了當下亟待解決的問題。本研究中,我們通過GSEA研究發現CXCL9mRNA主要富集于細胞因子及其受體相互作用通路、NK細胞介導的細胞毒性通路、JAK-STAT信號通路、白細胞跨膜通路、T細胞受體信號通路以及抗原加工與提呈通路等。這些通路均參與了腫瘤浸潤淋巴細胞遷移、分化及激活等重要的抗腫瘤免疫生物學功能,繼而提示CXCL9在卵巢癌抗腫瘤免疫應答中發揮著多重效應;此外,本研究通過Pearson相關分析發現,CXCL9mRNA表達與CD8A及免疫檢查點mRNA表達呈正相關。目前研究[27]認為腫瘤微環境中PD-L1、PD-1等免疫檢查點mRNA表達主要受與JAKSTAT通路相關的IFN-γ下游調節,而CXCL9是IFN-γ誘導產生的趨化因子,因此CXCL9與免疫檢查點的mRNA的表達呈正相關可能與其兩者皆受IFN-γ調控相關。根據以上結果推測,在CXCL9高表達組的免疫微環境中或存在高表達的CD8+T細胞及PD-L1。Teng等[28]針對免疫治療提出了一種腫瘤微環境的免疫分型(tumor microenvironment immune type,TMIT),該分型基于腫瘤PD-L1表達及腫瘤淋巴細胞浸潤(tumor-infiltrating lymphocyte,TIL)情況將腫瘤分成4型,包括Ⅰ型TIL+PD-L1+(適應性免疫抵抗型)、Ⅱ型TIL+PD-L1-(免疫豁免型)、Ⅲ型TIL-PD-L1+(內源誘導型)和Ⅳ型TIL-PD-L1-(免疫耐受型)。由于PD-L1與TIL雙陽性是免疫檢查點通路參與腫瘤內浸潤T細胞程序化死亡的最有力證據,使得Ⅰ型腫瘤被認為是最有可能受益于PD-1/PD-L1阻斷治療的分型。Kryczek等[29]研究顯示,CXCL9表達與CD8+T細胞浸潤顯著相關;且表達CXCR3的免疫細胞(如NK細胞[11]、Th1細胞[30])也均被證明,其可通過CXCR3依賴的方式被CXCL9-CXCR3軸募集到腫瘤所在部位。綜合上述研究可以推斷,本研究中的CXCL9高表達組卵巢癌組織或存在Ⅰ型(TIL+PD-L1+)腫瘤免疫微環境,繼而受益于PD-1/PD-L1阻斷治療。
卵巢癌錯綜復雜的基因組表達變化與其腫瘤微環境之間的相互作用是研究卵巢癌免疫檢查點抑制劑的巨大挑戰,這不僅涉及免疫細胞還涉及腫瘤微環境中眾多免疫趨化因子在免疫激活通路中發揮的動態作用。近期,越來越多的研究強調趨化因子CXCL9對腫瘤患者生存的影響及其在腫瘤微環境中調節抗腫瘤免疫細胞的遷移、浸潤功能。CXCL9作為調控免疫細胞浸潤的重要基因,在卵巢癌免疫微環境中參與了多項抗腫瘤免疫應答,與較高的免疫細胞浸潤數量相關,且與PD-L1的表達呈正相關。未來,CXCL9或可作為預測卵巢癌患者響應PD-1/PD-L1阻斷治療的生物標志物之一,同時將CXCL9與PD-L1表達或錯配修復缺陷聯合使用,或有望更精準地篩選PD-1/PD-L1阻斷治療的潛在獲益患者。

