人血漿7α-羥基-4-膽固醇烯-3-酮及膽汁酸的超高效液相色譜-串聯質譜定量方法研究
上海交通大學附屬第六人民醫院轉化醫學中心,上海200233
膽汁酸(bile acid,BA)是膽固醇在肝臟分解代謝的最終產物,是體內類固醇/甾醇排泄的主要形式[1]。研究[2-4]表明BA不僅在食物消化、吸收方面具有重要的生理功能,同時也是機體內一種重要的信號調節因子,在能量代謝、糖脂代謝等方面發揮非常關鍵的作用。BA的合成是由肝臟膽固醇首先在膽固醇7α-羥基化酶(cholesterol 7α-hydroxylase,CYP7A1)作用下進行7α-羥基化,或者在固醇27-羥化酶(sterol 27-hydroxylase,CYP27A1)作用下進行27-羥基化開始的,即BA合成的“經典途徑”與“替代途經”[5]。人體中90%的BA主要靠經典途徑合成[6-7]。在經典途徑中,膽固醇的7α-羥基化是膽汁酸合成中的關鍵步驟,由限速酶CYP7A1所催化[8],隨后經3β-羥基-Δ5-C27-類固醇脫氫酶(3β-hydroxyl-Δ5-C27-steroid dehydrogenase,HSD3B7)轉化為7α-羥基-4-膽固醇烯-3-酮(7α-hydroxy-4-cholesten-3-one,C4)。既往研究[9]表明血漿C4的濃度水平與肝臟CYP7A1活性相關,因此,C4被認為是表征CYP7A1活性的重要代謝物,同時它也是合成膽酸(cholic acid,CA)、鵝去氧膽酸(chenodeoxycholic acid,CDCA)的前體物質。因此,C4是反映肝臟膽汁酸合成水平的重要生物標志物[10-13]。
研究報道檢測血中C4的方法多集中于對C4單一物質的定量。Jean-Christophe等[14]通過對人血清C4的定量協助診斷膽汁酸吸收不良癥;Akira等[15]使用液相色譜-串聯質譜定量血清中C4的水平以反映BA的合成;DeBarber等[16]通過定量人血漿C4的含量快速、簡便地診斷腦腱黃瘤病(cerebrotendinous xanthomatosis,CTX)。
本研究擬建立基于超高效液相色譜-串聯質譜(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)技術的定量方法,同時定量C4及C4的下游代謝產物,即肝臟膽固醇分解代謝產生的2個初級膽汁酸CA和CDCA(可以反映肝臟膽固醇轉化成膽汁酸時關鍵酶CYP7A1的活性,還在一定程度上表征了肝臟合成膽汁酸的水平),并將該方法應用于臨床糖尿病患者血漿中C4、CA、CDCA的含量變化研究。
1 對象與方法
1.1 研究對象
連續納入2019年4月—5月參與上海交通大學附屬第六人民醫院內分泌科口服葡萄糖耐量試驗的志愿者35人,以世界衛生組織(World Health Organization,WHO)糖尿病診斷與分型標準為依據將35名志愿者分為3組:糖尿病前期組10人,糖尿病組15人,正常健康對照組10人;3組之間年齡、性別比較無統計學差異。所有患者均知情同意且簽署知情同意書。
1.2 主要試劑
C4與氘代同位素7α-羥基-4膽固醇烯-3-酮(d7-C4),購自加拿大Toronto Research Chemicals公司,CA和CDCA標準品均購自美國Steraloids公司,氘代同位素膽酸(d4-CA)、氘代同位素鵝去氧膽酸(d4-CDCA)均購自加拿大C/D/N ISOTopes 公司,色譜純的乙腈和甲醇購自美國Thermo Fisher Scientific公司,色譜純甲酸購自美國Sigma-Aldrich公司,超純水[電阻率18.2(MΩ·cm)]為Milli-Q純水儀制備。
1.3 方法
1.3.1 樣本前處理 分別使用含有肝素抗凝劑的負壓采血管收集35名試驗對象的靜脈血各3 mL。采血后上下顛倒管子,使血液與肝素混合均勻。1 006×g離心10 min,分離,取上層得到血漿樣本。血漿質控(quality control,QC)樣本為所收集的35例試驗對象的血漿各取100 μL混合而成,共3 500 μL。
測試血漿樣本前處理過程:精密吸取各試驗對象的血漿50 μL置于1.5 mL離心管中,加入200 μL的乙腈(含d7-C4、d4-CA、d4-CDCA同位素內標,濃度均為50 nmol/L),渦旋5 min。于-20 ℃下放置20 min后在4 ℃,20 375×g離心10 min,取上清液200 μL,待測。
標準曲線樣本的前處理:C4的標準品儲存液濃度為100 μmol/L,CA和CDCA的標準品儲存液濃度為200 μmol/L。3種標準品儲存液各取10 μL混合均勻,再加入970 μL甲醇稀釋成C4為1 000 nmol/L、CA和CDCA均為2 000 nmol/L的標品混合液。之后用甲醇逐級稀釋成8個濃度梯度(STD1~STD8),其中C4濃度梯 度 為5、10、25、50、100、250、500、1 000 nmol/L;CA和CDCA濃度梯度為10、20、50、100、200、500、1 000、2 000 nmol/L。分別精密吸取各濃度點的標準溶液50 μL置于1.5 mL離心管,按測試血漿樣本的前處理過程處理。
1.3.2 儀器測定條件 色譜系統為Waters公司Acquity?UPLC,色譜柱為ACQUITY UPLC?BEH C18(2.1 mm×100 mm,1.7 μm),保護柱為ACQUITY UPLC?BEH C18 vanGuard? Pre-Column(2.1 mm×5 mm,1.7 μm)。流動相A為含0.01%甲酸的去離子水,流動相B為含0.01%甲酸的乙腈-甲醇(體積比9:1),柱溫45 ℃。梯度洗脫程序見表1。
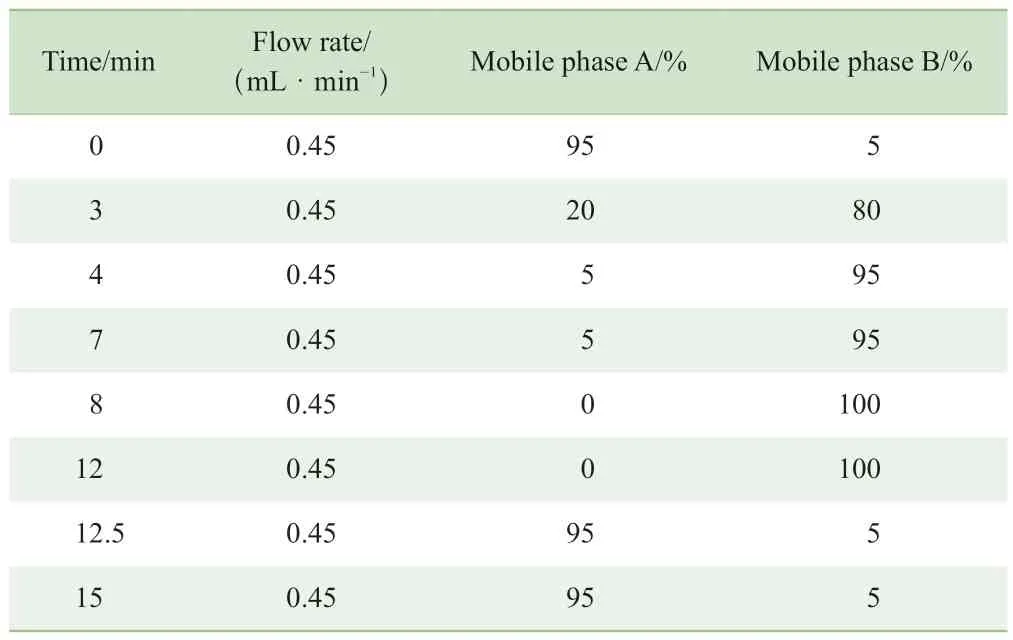
表1 C4與BAs的梯度洗脫程序Tab 1 Gradient elution of C4 and BAs
試驗的質譜系統為Waters公司Xevo?TQ,采用電噴霧電離(electrospray ionization,ESI)離子源,毛細管電壓3kV(正離子模式,ES+),2.5 kV(負離子模式,ES-),干燥氣溫度500 ℃,干燥氣流速1 000 L/h,錐孔氣50 L/h,碰撞氣流速0.14 mL/min,離子源溫度150 ℃。數據采集采用多重反應監測模式(multiple reaction monitoring,MRM)。C4及其同位素內標d7-C4在正離子模式下監測,CA、CDCA與其同位素內標d4-CA、d4-CDCA在負離子模式下監測,C4、BAs及其同位素內標的定量離子對見表2。
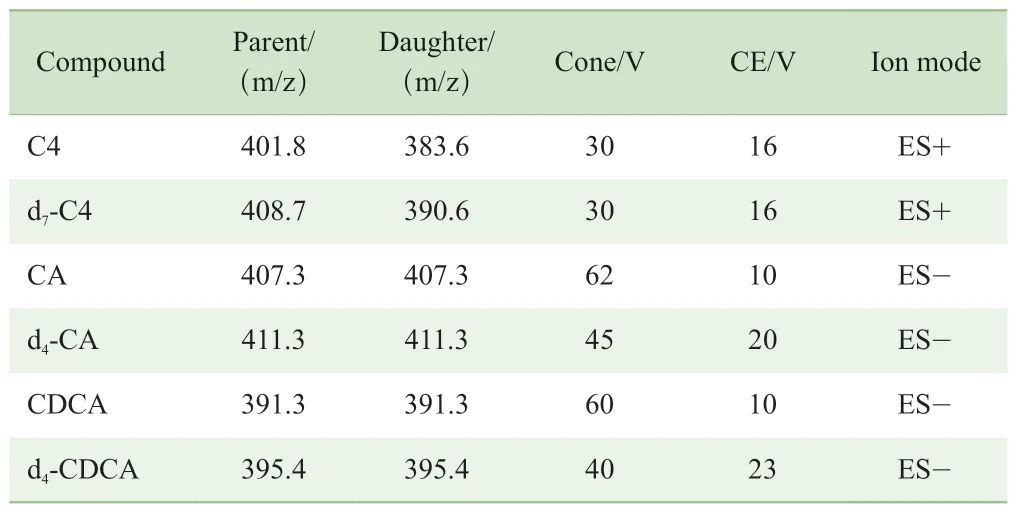
表2 C4、BAs和同位素內標的定量離子對Tab 2 Quantitative ion pairs of C4, BAs and isotopic internal standards
1.4 檢測項目
1.4.1 提取溶劑的選擇 為了有效地提取血漿中C4、CA和CDCA,本實驗一共設計5組提取溶劑,為不同比例的乙腈-甲醇,體積比分別為1:0,4:1,1:1,1:4,0:1。平行取5份QC樣本,每份50 μL,分別加入以上5種提取溶劑,按1.3.1的處理方法進行樣本前處理,比較5種提取溶劑下C4、CA和CDCA的色譜峰形與響應值大小,確定最佳提取溶劑。
1.4.2 檢出限、定量限和線性 檢出限(limits of detection,LOD)和定量限(limits of quantitation,LOQ)是用一系列已知濃度的標準品溶液測試,計算不同濃度下各物質的信噪比(signal-noise ratio,S/N)。隨著濃度的降低,每個物質測定的信噪比也會降低。本研究將一系列已知濃度的3種標準品混合溶液上機測試,C4、CA、CDCA濃度相同,分別為0.01、0.02、0.04、0.08、0.16、0.32、0.64、1.28、2.56 nmol/L。取S/N≥3的濃度作為各標準品的LOD,取S/N≥10的濃度作為各標準品的LOQ。
標準曲線樣本按1.3.1中標準曲線樣本處理方法處理后檢測。以標準品的濃度為橫坐標,以物質峰面積(compound peak area)和對應內標峰面積(internal standard peak area)的比值為縱坐標(response,R),建立線性回歸方程,考察方法的線性。
1.4.3 重復性 平行取6份標準品混合液(C4濃度為100 nmol/L,CA和CDCA濃度為200 nmol/L),6份QC樣本,按1.3.1方法處理后測試,分別計算6次測試濃度的相對標準偏差(relative standard deviation,RSD),評估方法的重復性。
1.4.4 日內精密度、日間精密度 取3份標準品混合液(C4濃度為100 nmol/L,CA和CDCA濃度為200 nmol/L),3份QC樣本,按1.3.1中對應樣本處理方法處理后,1 d內測試3次,每次重復測試3針,分別計算所測試濃度的RSD,考察日內精密度。
取9份標準品混合液(C4濃度為100 nmol/L,CA和CDCA濃度為200 nmol/L),9份QC樣本,按1.3.1中對應樣本處理方法處理,每日處理3份,1 d內測試3次,每次重復測試3針,連續3 d,分別計算每日所測試濃度的RSD,考察日間精密度。
1.4.5 加標回收率 混合QC中分別加入低、中、高濃度的C4、CA和CDCA的標準品混合液后,按1.3.1中QC樣本處理方法處理,通過標準曲線計算加入標準品混合液前后QC樣本中C4、CA和CDCA的濃度,計算各自的加標回收率。
1.4.6 穩定性 取3份QC樣本,按1.3.1中QC樣本處理方法處理后,每份取30 μL提取液立即測試作為0 h結果,每份剩余提取液密封存放于4 ℃冰箱保存,并分別于12、24、48、72、96 h和7 d,6個時間點每份各取30 μL進行測試,通過比較每份其余各時間點的濃度與0 h濃度的RSD,評估樣本在4 ℃存放的穩定性。
1.4.7 方法應用 用本文建立的方法,分別測試每個血漿樣本中C4、CA、CDCA的離子對峰面積,并采用標準曲線法定量每個血漿樣本中C4、CA、CDCA的含量。計算糖尿病前期組、糖尿病組、健康對照組中C4、CA、CDCA的平均值,考察并比較這3種物質在各組中的變化情況。
1.5 統計學分析
使用GraphPad Prism 8.0軟件進行顯著性分析,采用t-test雙尾檢驗,P<0.05為差異有統計學意義。使用SPSS 22.0軟件進行相關性分析,采用Spearman相關檢驗方法,P<0.05為有相關性。
2 結果
2.1 提取溶劑
5種提取溶劑測試結果顯示:不同提取溶劑提取QC樣本,對C4的提取效率影響最大。其中純乙腈提取C4的峰強度最強,干擾峰最少,而對CA、CDCA的影響相對較小。綜合考慮,確定乙腈為最終提取溶劑,提取離子峰見圖1。
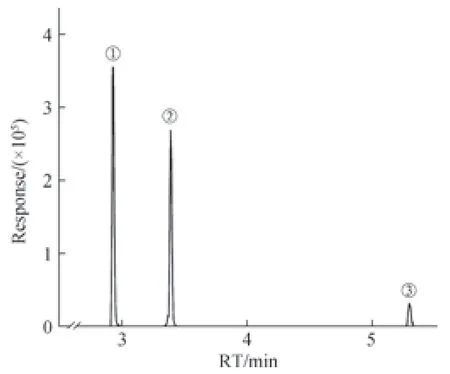
圖1 C4、CA和CDCA的提取離子流色譜圖Fig 1 Extracted ion chromatograms of C4, CA and CDCA
2.2 C4、CA和CDCA的檢出限、定量限和線性
通過計算標準品溶液測定結果的信噪比(S/N)確定3種物質C4、CA和CDCA的LOD分別為0.16、0.02和0.04 nmol/L,LOQ分別為0.32、0.04和0.16 nmol/L。線性結果顯示:C4在5~1 000 nmol/L濃度范圍內,CA、CDCA在10~2 000 nmol/L濃度范圍內均具有良好的線性關系,滿足定量要求(表3)。
2.3 C4、CA和CDCA的重復性
標準品溶液和QC樣本各自平行處理6份,6份測試結果的RSD顯示該方法C4、CA和CDCA的重復性良好,標準品溶液和QC樣本中3種物質的RSD均低于3%,如表4所示,滿足定量要求。
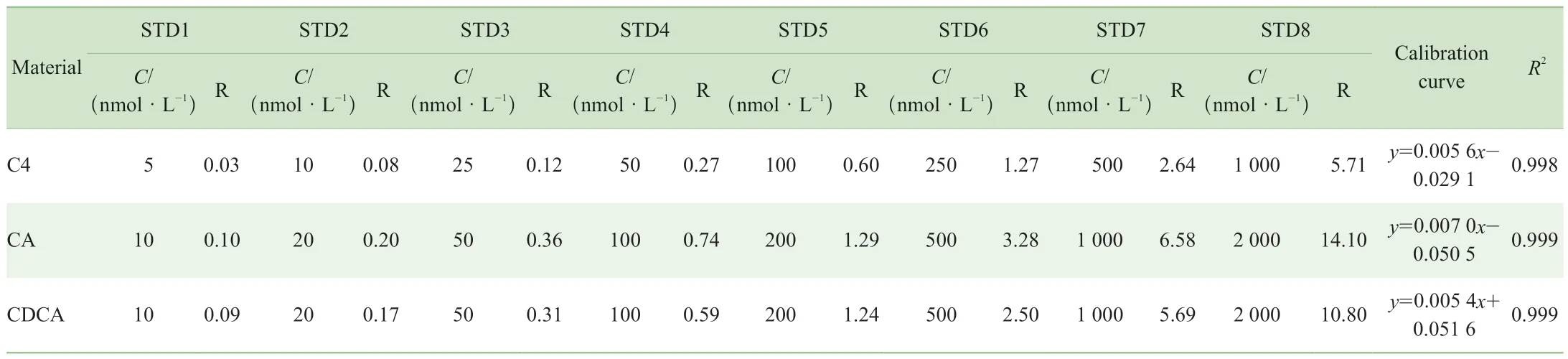
表3 C4、CA 和CDCA的濃度梯度與線性關系Tab 3 Concentration gradient and linear relationships of C4, CA and CDCA
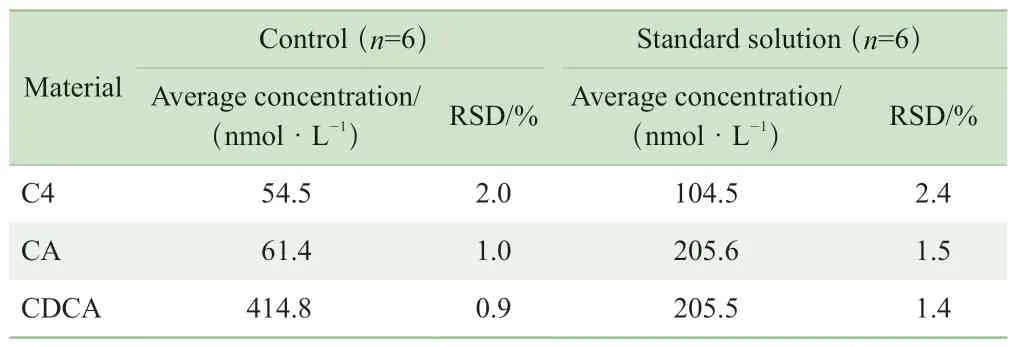
表4 C4,CA 和CDCA的重復性Tab 4 Repeatabilities of C4, CA and CDCA
2.4 C4、CA和CDCA的日內精密度和日間精密度
標準品溶液和QC樣本中C4、CA和CDCA的日內精密度的RSD均低于5%;兩者日間精密度第1日結果在6%以內,第2日結果在4%以內,第3日結果在5%以內。如表5所示,該方法的日內精密度與日間精密度良好,RSD符合定量要求。
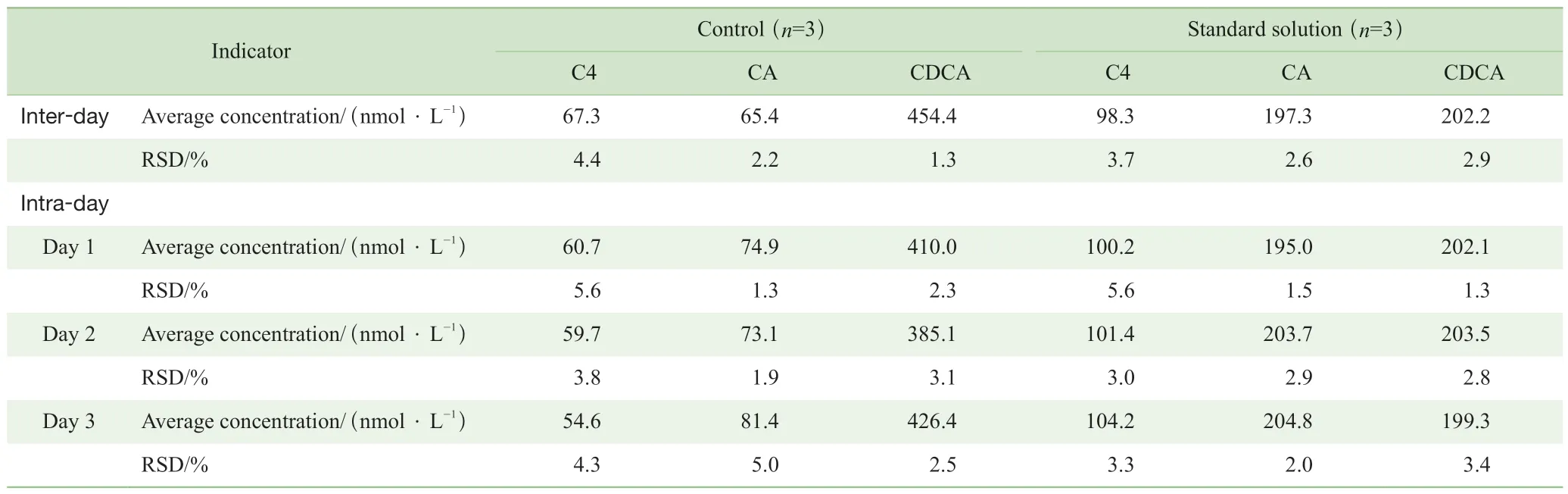
表5 C4、CA 和CDCA的日內精密度與日間精密度結果Tab 5 Inter-day and intra-day RSDs of C4, CA and CDCA
2.5 C4、CA和CDCA的加標回收率
加標回收率結果顯示,C4、CA、CDCA的平均加標回收率分別是97.7%、113.3%、105.0%,且3種物質在中、高2個濃度下的回收率良好(表6)。
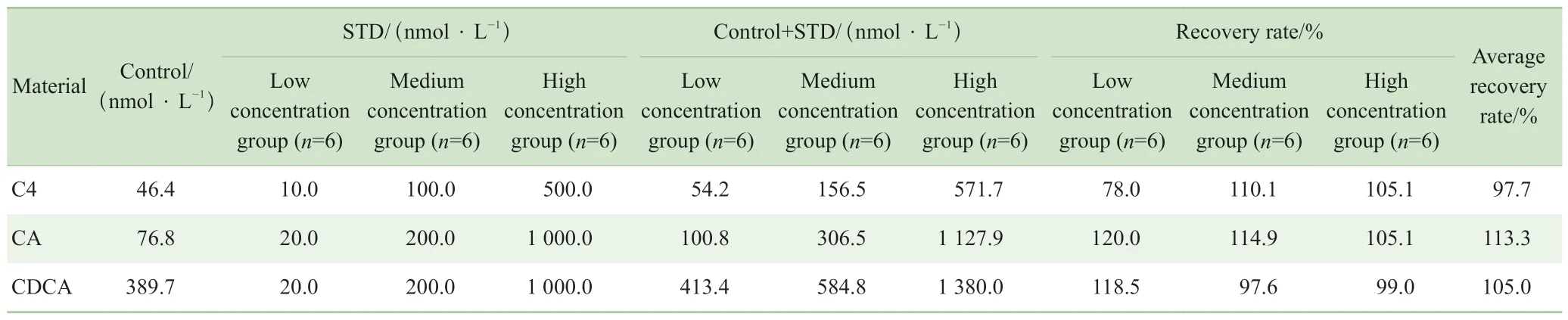
表6 C4、CA 和CDCA的加樣回收率Tab 6 Recovery rates of C4, CA and CDCA
2.6 C4、CA和CDCA的穩定性
通過將12、24、48、72、96 h及7 d各時間點QC樣本的測試結果與0 h的測試結果相比較,得出C4、CA和CDCA在各時間點的濃度與0 h濃度的RSD均小于10%(表7),說明經該方法處理后樣本在4 ℃條件下能夠穩定存儲(7 d內)。
2.7 方法應用
本研究采用上文建立的方法,對10例健康對照、10例糖尿病前期和15例糖尿病患者血漿中C4、CA和CDCA的濃度進行了定量測定。結果表明,糖尿病組血漿C4濃度與健康對照組相比顯著下降(P<0.05),但糖尿病前期組與健康對照組相比血漿C4濃度沒有顯著性改變。同時,糖尿病前期組與糖尿病組相比血漿C4濃度差異無統計學意義。同樣的,血漿中CA和CDCA與C4表現出相似的情況(圖2)。
進一步通過相關性分析可知,血漿中C4濃度與血漿CDCA的濃度呈現明顯的正相關關系(r=0.554,P=0.000),如圖3所示。
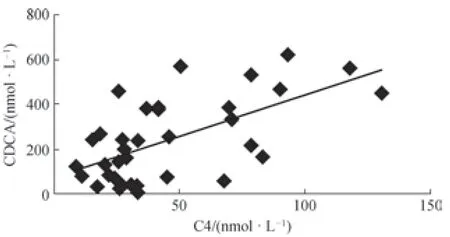
圖3 血漿中C4與CDCA濃度的相關性Fig 3 Correlation of C4 and CDCA in plasma
3 討論
血漿中C4被看作是肝臟合成BA時表征CYP7A1活性的一個重要生物標志物[17-18],一直以來備受關注,也誕生了各種檢測手段。質譜檢測儀器的高靈敏度與高特異性,使得檢測結果更為準確可靠。而相對于氣相色譜-質譜聯用技術(gas chromatography-mass spectrometry,GCMS),UPLC-MS/MS由于在樣本前處理部分不需要進行衍生化而縮短了樣本制備時間,大大降低了檢測的時間成本。而BA除了在脂肪乳化中的傳統作用外,還是機體重要的信號分子。因此,在生物學和醫藥學領域內的BA研究日益增多,對檢測的敏感性要求也更高[19]。根據研究報道,絕大多數基于質譜的檢測方法都集中在對C4的定量,而未同時定量BA合成的實際水平。本研究建立了一種能同時定量C4和BA含量的方法,經驗證具有高靈敏度、準確度和快速等特點。
本研究建立的方法經過對血樣進行簡單前處理后,采用UPLC-MS/MS對C4,以及C4下游合成的CA和CDCA同時進行定量。該方法經方法學考察符合準確定量的要求,適用于臨床樣本的定量檢測。其中C4的加標回收率結果顯示,在加入低濃度標準品溶液時,由于基質效應的影響,C4的加標回收率結果較差(78.0%)。隨著加入的標準品溶液濃度增大,這種影響會降低,能夠得到較好的回收率結果,這與Jean-Christophe 等[14]的實驗結果一致。使用該方法對所收集的臨床糖尿病患者血漿樣本進行C4、CA和CDCA定量,發現糖尿病患者血漿中C4含量顯著低于健康人水平,表明糖尿病患者BAs合成能力下降。且C4合成的下游BA CA和CDCA水平均分別低于健康對照組,這也印證了BA合成的減少。由于CYP7A1是經典膽汁酸合成途徑中唯一的限速酶,因此C4的含量高低與CYP7A1的活性呈正相關,C4濃度水平的下降主要反映CYP7A1活性的減弱,而膽汁酸合成中的經典途徑主要合成CA和CDCA 2種初級膽汁酸,CYP7A1活性的減弱會直接影響到這2種初級膽汁酸的合成水平,這與我們的檢測結果是一致的。同時,血漿C4濃度與CDCA濃度呈現顯著的正相關關系,表明C4濃度的下降將主要影響到CDCA的合成,提示糖尿病患者血膽汁酸水平的降低可能與初級膽汁酸CDCA的合成減少有直接關系,這為研制靶向藥物及制定臨床干預措施提供了重要的依據。
綜上所述,利用UPLC-MS/MS同時定量C4和CA、CDCA的方法簡單可靠、實用性強。結合膽汁酸水平,可以獲得人體膽汁酸代謝情況,為臨床疾病的預后和診斷提供依據。

