miR-124 靶向OSX 對牙周膜干細(xì)胞成骨分化能力的調(diào)控作用*
王獻(xiàn)剛 馮保靜
牙周炎是一種由牙菌斑等多種因素引起的慢性炎癥性疾病,可導(dǎo)致牙周組織進(jìn)行性喪失,從而導(dǎo)致牙齒松動和脫落。近年,組織工程再生和牙周膜干細(xì)胞成為牙周疾病治療的前景和研究熱點。PDLSCs 是來源于牙周支持組織中的一群未分化細(xì)胞,具有高增殖率和多向分化潛能,在相應(yīng)誘導(dǎo)條件下可向成骨細(xì)胞、成軟骨細(xì)胞、脂肪細(xì)胞以及內(nèi)皮細(xì)胞等分化,被認(rèn)為是牙周組織工程中牙周改建、修復(fù)的理想材料和種子細(xì)胞[1]。牙周病的理想治療目標(biāo)是實現(xiàn)牙周支持組織再生,而PDLSCs在牙周骨質(zhì)缺損修復(fù)及組織工程再生中發(fā)揮重要作用[2]。成骨分化是一個高度協(xié)調(diào)的過程,涉及Runx2 和OSX 等多種轉(zhuǎn)錄因子,Runx2 是間充質(zhì)干細(xì)胞向成骨前體細(xì)胞分化的關(guān)鍵,OSX 是成骨前體細(xì)胞向功能性成骨細(xì)胞分化的關(guān)鍵[3-5]。OSX缺失的小鼠出生后立即死亡,并顯示完全沒有骨形成[6,7]。OSX 作為成骨細(xì)胞的特異性轉(zhuǎn)錄因子可通過上調(diào)成骨細(xì)胞特異性分化標(biāo)志物的表達(dá),包括堿性磷酸酶(ALP)、骨鈣素(OCN)、骨連接蛋白(ON)和骨橋蛋白(OPN),從而影響骨形成[8]。在PDLSCs中OSX 基因可調(diào)控Wnt/β-catenin 信號通路從而影響牙周膜干細(xì)胞的成骨向分化[9]。因此,研究OSX 對牙周膜干細(xì)胞成骨分化能力的調(diào)控機(jī)制對牙周組織工程應(yīng)用具有重要意義。
MicroRNAs (miRNAs)是非編碼家族的單鏈RNA,長度約18~25 個核苷酸,可與靶基因mRNA的3’UTRs 相結(jié)合,促進(jìn)靶mRNA 降解或抑制靶mRNA 翻譯,進(jìn)而介導(dǎo)基因抑制[10]。MicroRNA在調(diào)控間充質(zhì)干細(xì)胞增殖、成骨分化能力方面具有重要作用,研究顯示miR-124 在強(qiáng)直性脊柱炎成骨細(xì)胞中增加GSK-3β 進(jìn)而下調(diào)Wnt/β-catenin入核而抑制成骨分化過程[11]。研究表明,miR-124可通過靶向調(diào)控骨髓間充質(zhì)干(BMSCs)細(xì)胞中的OSX 進(jìn)而抑制成骨分化[12]。然而miR-124 是否影響牙周膜干細(xì)胞成骨分化能力及其作用機(jī)制尚不清楚。本實驗將通過研究miR-124 對牙周膜干細(xì)胞成骨分化的影響及其機(jī)制,以期為牙周膜干細(xì)胞在牙周組織修復(fù)再生應(yīng)用中提供理論依據(jù)。
1.材料和方法
1.1 實驗材料 細(xì)胞孵育箱(Heraeus,德國);酶聯(lián)儀(BIO-TEK,美國);離心機(jī)(Eppendorf,德國);胎牛血清(Gibco,美國);胰蛋白酶、PBS、α-MEM 培養(yǎng)基(Hyclone,美國);倒置相差顯微鏡(OLYMPUS,日本);miR124mimics、miR124 inhibitor、si-RNA(OSX)(銳博生物公司,中國);RIPA 蛋白裂解液、雙螢光素酶報告基因檢測試劑盒(碧云天,中國);OSX 抗體(貨號ab94744,Abcam,美國);Lipofectamine2000(Invitrogen,美國)。
1.2 細(xì)胞培養(yǎng)及成骨誘導(dǎo) 經(jīng)安陽市第六人民醫(yī)院倫理委員會同意,收集18~25 歲口腔科患者者即刻拔除的第三磨牙,要求牙齒健康完整無齲壞及牙周病,超凈臺內(nèi)充分沖洗牙齒,使用刀片刮取牙齒根中1/3 處牙周膜,加入I 型膠原酶(3mg/L)放入細(xì)胞培養(yǎng)箱消化40min,每10 分鐘搖勻一次,使用含10%FBS 的培養(yǎng)液終止消化,去除上清后用含20%胎牛血清的α-MEM 培養(yǎng)液后重懸后接種于培養(yǎng)板中,于細(xì)胞培養(yǎng)箱內(nèi)培養(yǎng),每2 天換一次液,待細(xì)胞長至80%融合率時,挑選單克隆純化PDLSCs 后用于后續(xù)實驗。
取P3 代PDLSCs,消化重懸后接種于培養(yǎng)板中,分為對照組(非成骨誘導(dǎo)組)和成骨誘導(dǎo)組,當(dāng)PDLSCs 達(dá)80%左右的融合率,更換成骨誘導(dǎo)液(10%FBS,10 mm β-甘油磷酸鈉、50ug/uL 維生素C 和10 nmol/L 地塞米松),成骨誘導(dǎo)2 周后檢測miR124 及成骨基因的表達(dá)。
1.3 q-RCR 檢測目的基因mRNA 的表達(dá)取P3 代PDLSCs 接種于培養(yǎng)板中,分為miR124 mimics、miR124 inhibitor、miR124 對照組(miR124-NC)、control 組(圖2)及si-NC、si-OSX、miR-124 inhibitor+OSX 沉默組(miR-124+si-OSX)和miR-124inhibitor+OSX 沉默對照組(miR-124+si-NC)(圖4),參照Lipo-2000 說明書對人PDLSCs 進(jìn)行轉(zhuǎn)染,轉(zhuǎn)染48h 后提取miR124 mimics、inhibitor 和對照組細(xì)胞的總RNA,按照PrimeScriptTMRT reagent Kit 說明書逆轉(zhuǎn)錄合成cDNA。
1.4 Western blotting 檢測PDLSCs 中OSX蛋白的表達(dá) 取P3 代PDLSCs 接種于6 孔培養(yǎng)板中,分為分為miR124 mimics、miR124 inhibitor、miR124-NC、control 組(圖2)及si-NC、si-OSX、miR-124+si-OSX 和miR-124+si-NC 組(圖4),提取各組細(xì)胞總蛋白后95℃變性5min,配制10%SDS-PAGE 膠,110mV 電壓下電泳分離細(xì)胞蛋白、70mV 電壓轉(zhuǎn)膜、5%脫脂奶粉TBST 封閉后,加入OSX(1∶1000 稀釋)抗體、β-actin(1∶10 000稀釋)抗體,于冷房過夜孵育。TBST 輕柔漂洗3次,每次10 分鐘,加入二抗后孵育1h,TBST 輕柔漂洗3 次,每次10 分鐘,ECL 化學(xué)發(fā)光后采用Image J 軟件分析結(jié)果,以O(shè)SX/β-actin 條帶灰度值表示OSX 的相對表達(dá)水平。
1.5 茜素紅實驗檢測成骨分化能力 取P3 代PDLSCs 接種于培養(yǎng)板中,分為miR124 mimics、miR124 inhibitor、miR124-NC、control 組(圖2)及si-NC、si-OSX、miR-124+si-OSX 和miR-124+si-NC 組(圖4),參照Lipo-2000 說明書分別對PDLSCs 進(jìn)行轉(zhuǎn)染,當(dāng)細(xì)胞達(dá)到80%以上的融合率;更換成骨誘導(dǎo)液(10%FBS,10 mm β-甘油磷酸鈉、50ug/uL 維生素C 和10 nm 地塞米松),成骨誘導(dǎo)2 周后,4%多聚甲醛加入培養(yǎng)板,固定細(xì)胞20min,PBS 漂洗2~3 次,加入茜素紅染液孵育15min,PBS 充分洗去茜素紅染液,顯微鏡觀察、拍照茜素紅染色結(jié)果。
1.6 雙熒光素酶報告基因?qū)嶒炆镄畔W(xué)分析預(yù)測miR-124 的靶基因,結(jié)果發(fā)現(xiàn)OSX 為miR-124 的靶基因,為確定miR-124 靶向結(jié)合于OSX的3’UTR 區(qū),將OSXmRNA 突變型(OSX-MUT)和野生型(OSX-WT)的3’UTR 區(qū)合成,并連接到psiCHENK-2 載體質(zhì)粒。在PDLSCs 中共轉(zhuǎn)染miR124-NC、miR124 mimics 和OSX 質(zhì)粒,分組為OSX-WT+miR124 NC、OSX-MUT+miR124 NC、OSX-WT+miR124 mimics、OSX-MUT+miR124 mimics。轉(zhuǎn)染后冰上裂解細(xì)胞,檢測熒光強(qiáng)度并進(jìn)行分析。
1.7 統(tǒng)計學(xué)分析 采用SPSS 19.0 統(tǒng)計軟件對數(shù)據(jù)進(jìn)行統(tǒng)計學(xué)分析,計量資料以均數(shù)±標(biāo)準(zhǔn)差表示,組間比較采用t 檢驗或單因素方差分析,P<0.05 表示差異有統(tǒng)計學(xué)意義。
2.結(jié)果
2.1 PDLSCs 成骨分化前后miR-124 和OSX的表達(dá) qPCR 檢測PDLSCs 分化后成骨基因和miR-124 的表達(dá)變化,結(jié)果顯示,PDLSCs 成骨分化后miR-124 的表達(dá)明顯下調(diào)(圖1),而OSX、OCN、Runx2、ALP 的表達(dá)水平顯著升高(圖1),差異具有統(tǒng)計學(xué)意義(P<0.05),結(jié)果與文獻(xiàn)報道一致[12]。
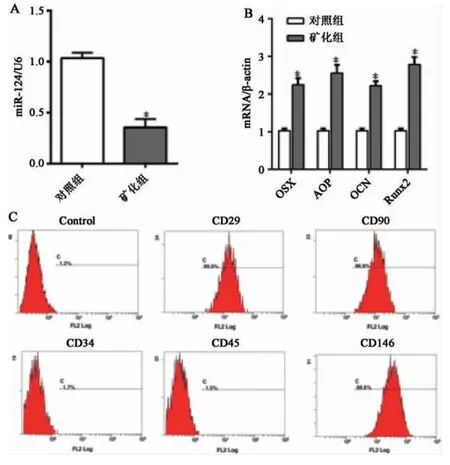
圖1 牙周膜干細(xì)胞成骨誘導(dǎo)后miR-124 和成骨相關(guān)基因的表達(dá)
2.2 miR-124 對PDLSCs 成骨分化能力的調(diào)控PDLSCs 轉(zhuǎn)染miR124 mimics 和miR124 inhibitor,q-PCR 驗證轉(zhuǎn)染效果,結(jié)果顯示miR124 inhibitor組中miR-124 的表達(dá)下調(diào),而miR124 mimics 組中miR-124 的表達(dá)明顯上調(diào),差異具有統(tǒng)計學(xué)意義(P<0.05)(圖2)。PDLSCs 轉(zhuǎn)染miR124 后成骨誘導(dǎo)2 周,茜素紅結(jié)果顯示miR-124 inhibitor 組中鈣化結(jié)節(jié)明顯增多,而miR-124 mimics 組則顯著減少;q-PCR 結(jié)果顯示miR-124 inhibitor 組中OSX、ALP、Runx2、OCNmRNA 及OSX 蛋白的表達(dá)明顯上調(diào),而miR-124 mimics 組則結(jié)果相反;差異具有統(tǒng)計學(xué)意義(P<0.05)(圖2)。
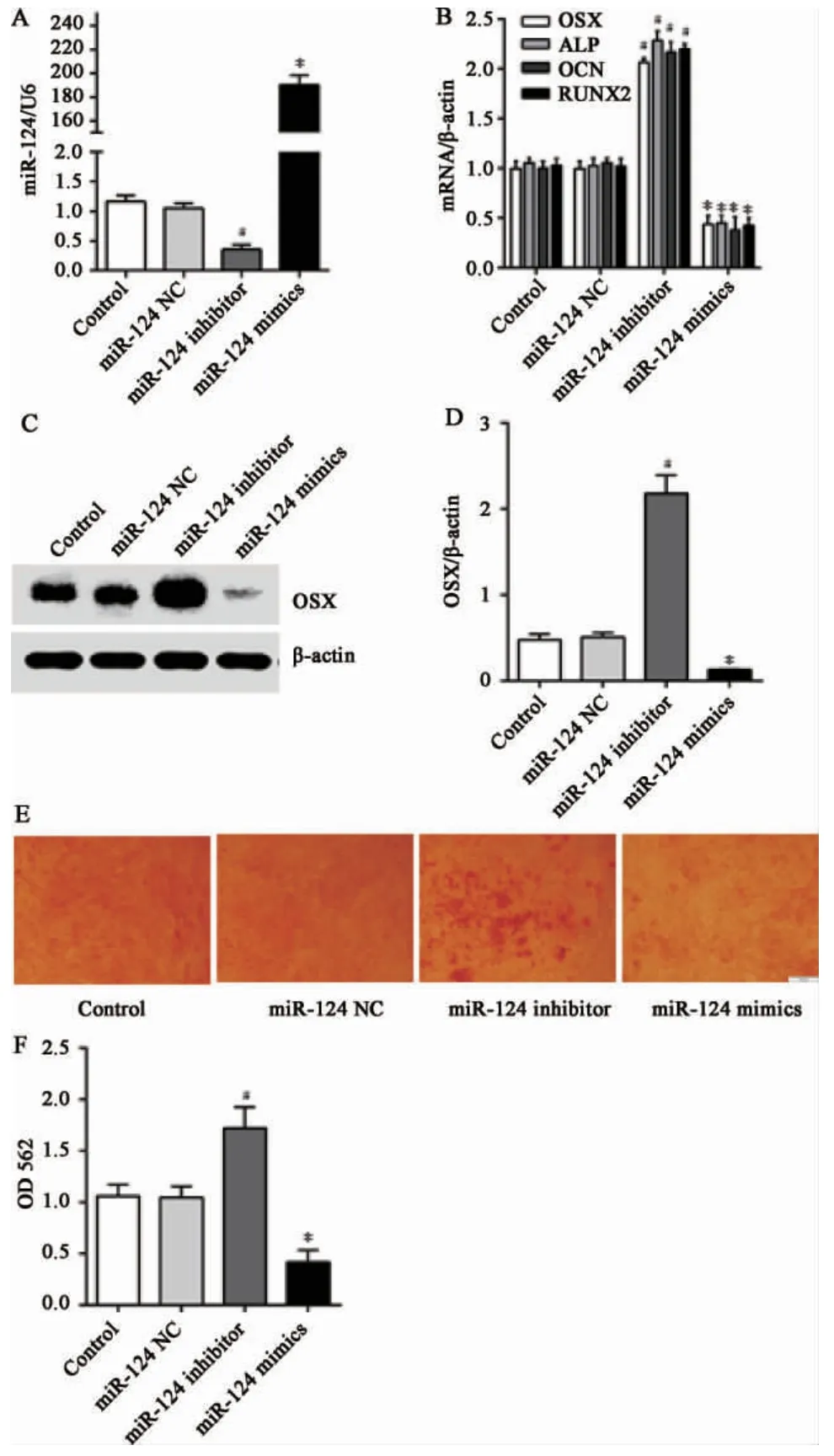
圖2 miR-124 對PDLSCs 的成骨分化能力的影響
2.3 miR-124 的靶基因為OSX 生物信息學(xué)分析預(yù)測發(fā)現(xiàn)OSX 為miR-124 的潛在靶基因,圖2 結(jié)果顯示miR-124 mimics 組中OSX 的表達(dá)明顯低于對照組,說明OSX 可被miR-124 負(fù)向調(diào)控。采用雙熒光素酶報告基因?qū)嶒炞C實OSX 是miR-124 的靶基因,檢測結(jié)果顯示,OSX-WT+miR-124 組的熒光比值低于OSX-WT+miR-NC組(圖3),差異具有統(tǒng)計學(xué)意義(P<0.05)。OSXMUT+miR-124 組和OSX-MUT+miR-NC 組的熒光比值分別為0.952±0.047 和1.0±0.073,差異無統(tǒng)計學(xué)意義(P>0.05)。表明miR-124 可與OSX 基因3’-UTR 位點結(jié)合,miR-124 與OSX存在直接負(fù)向調(diào)控關(guān)系。

圖3 雙熒光素酶報告驗證OSX 為miR-124 靶基因
2.4 沉默OSX 能逆轉(zhuǎn)miR-124 inhibitor 對PDLSCs 成骨向分化的促進(jìn)作用 為進(jìn)一步研究miR-124 和OSX 的關(guān)系,在牙周膜干細(xì)胞中同時轉(zhuǎn)染siRNA-OSX 和miR-124inhibitor,分析對PDLSCs 的成骨分化能力的影響。結(jié)果顯示,共轉(zhuǎn)染siRNA-OSX 和miR-124inhibitor 可逆轉(zhuǎn)miR-124 inhibitor 對OSX 的表達(dá)促進(jìn)作用(圖4)。茜素紅染色結(jié)果可見siRNA-OSX 和miR-124 inhibitor組(miR-124+si-OSX)與miR-124 inhibitor 組相比,miR-124+si-OSX 組中鈣化結(jié)節(jié)數(shù)明顯減少(圖4)。說明沉默OSX 能夠逆轉(zhuǎn)miR-124 inhibitor對PDLSCs 的成骨分化的促進(jìn)作用。
3.討論
牙周炎發(fā)病后導(dǎo)致牙周支持組織漸行性破壞,牙槽骨的修復(fù)弱于吸收,進(jìn)而導(dǎo)致牙槽骨的高度降低[13]。牙周炎治療不僅要控制牙周炎癥,還要促進(jìn)牙周支持組織的修復(fù)再生。因此,明確牙槽骨形成的細(xì)胞分子機(jī)制對于牙槽骨修復(fù)和牙周組織再生的至關(guān)重要。2004 年,Seo 等[1]人類牙齒牙周膜中培養(yǎng)出PDLSCs。PDLSCs 具有較強(qiáng)的自我更新能力和成骨、成脂等多向分化潛能,使PDLSCs 在牙周組織工程再生領(lǐng)域中擁有廣闊的應(yīng)用前景[14]。本實驗探索了miR-124 對牙周膜干細(xì)胞成骨向分化能力中的影響,研究結(jié)果顯示PDLSCs 在成骨分化后miR-124 的表達(dá)水平呈現(xiàn)下調(diào)趨勢,而OSX的表達(dá)則顯著升高。通過inhibitor 抑制miR-124的表達(dá)可上調(diào)牙周膜干細(xì)胞的成骨分化能力,并可促進(jìn)OSX mRNA 和蛋白的表達(dá),miR-124 與OSX的表達(dá)呈負(fù)相關(guān),結(jié)果與文獻(xiàn)報道相一致[12]。OSX作為一種調(diào)控細(xì)胞成骨分化的轉(zhuǎn)錄因子,可特異性調(diào)控多種成骨相關(guān)基因的轉(zhuǎn)錄[7]。OSX 的表達(dá)是成骨前體細(xì)胞向成骨細(xì)胞分化的必要條件,OSX 基因的轉(zhuǎn)錄表達(dá)可調(diào)控成骨細(xì)胞的晚期分化,當(dāng)OSX 基因缺失時,則成骨細(xì)胞分化則基本完全被抑制[6]。此外,成牙本質(zhì)細(xì)胞中條件性敲除OSX的小鼠可表現(xiàn)出短而薄的牙根表型,說明在牙根發(fā)育過程中OSX 發(fā)揮了重要作用[15]。機(jī)制研究表明,OSX 表達(dá)的調(diào)控網(wǎng)絡(luò)可以通過調(diào)控上皮BMP 信號通路、間質(zhì)Runx2 表達(dá)和細(xì)胞磷酸化水平來調(diào)控[16]。綜上,OSX 對細(xì)胞成骨分化能力具有重要的調(diào)控作用,因此研究OSX 在PDLSCs 中的調(diào)控機(jī)制對牙周支持組織再生具有重要意義。為了進(jìn)一步了解OSX 在PDLSCs 的作用機(jī)制。本研究通過生信分析發(fā)現(xiàn)OSX 為miR-124 的潛在作用靶點,雙熒光素酶實驗驗證結(jié)果顯示與OSX 突變組相比,OSX-WT+miR-124 組的相對熒光素酶活性顯著抑制,而OSX-WT+miR-NC 組的無顯著變化,表明miR-124 可與OSX 的3’-UTR 位點結(jié)合,兩者存在直接負(fù)向調(diào)控關(guān)系。有研究表明miR-124可靶向結(jié)合OSX 進(jìn)而抑制骨髓間充質(zhì)干細(xì)胞體外成骨分化能力[12],與本實驗結(jié)果相一致。MicroRNAs(miRNAs)是一種在結(jié)構(gòu)上不同于雙鏈小干擾RNA(siRNA)的非編碼RNA,作用機(jī)制也與siRNA 介導(dǎo)的mRNA 基因沉默有所區(qū)別,miRNA-RISC結(jié)合復(fù)合體對靶基因降解效能主要取決于其與mRNA 轉(zhuǎn)錄本3’-UTR 序列互補的程度。本實驗中miR-124 與OSX 的3’-UTR 序列高度互補,并證實miR-124 與OSX 互補結(jié)合后導(dǎo)致OSX mRNA 發(fā)生降解,抑制其翻譯效率,進(jìn)而影響OSX 蛋白的表達(dá)。本研究結(jié)果顯示miR-124 可能是一個新的調(diào)控成骨分化的重要路徑,參與了OSX 基因介導(dǎo)的PDLSCs 成骨分化進(jìn)程,這對牙周組織損傷修復(fù)時的骨改建具有重要意義。
本研究采用雙熒光素酶報告系統(tǒng)證實了miR-124 結(jié)合與OSXmRNA3’-UTR 區(qū),即OSX 為miR-124 的靶基因,最后miR-124 inhibitor 和OSX-siRNA 共轉(zhuǎn)染實驗進(jìn)一步證實了沉默OSX可逆轉(zhuǎn)miR-124 inhibitor 對PDLSCs 成骨分化能力的促進(jìn)作用。綜上所述,miR-124 通過靶向負(fù)調(diào)控OSX 對牙周膜干細(xì)胞的成骨分化產(chǎn)生抑制作用,提示miR-124 在牙周膜干細(xì)胞和組織損傷修復(fù)過程中發(fā)揮重要作用。

