新型唾液生物標記物在口腔癌檢測的研究進展
李惠芳 張 芳
口腔和口咽癌位居全身惡性腫瘤第6 位,90%以上為鱗狀細胞癌[1]。就醫意識弱,臨床存在誤診、不當治療等,患者確診時已處于晚期。研究顯示,OSCC 在T1 階段確診、治療,5 年生存率為80%以上;晚期確診,僅20%~30%[2];OSCC、口腔白斑高危人群的篩查可早期發現OSCC[3]。因此,口腔癌的早期診斷,特別在T1 階段,甚至與口腔癌前病變區分,具有重要意義[2]。
口腔癌確診“金標準”為病理學檢查,有創且依賴專業人員。唾液包含較多反映機體病理、生理狀態的生物學信息,收集方便無創,多次可靠,唾液組學在全身疾病的研究得到廣泛關注[4]。過去20年,學者們已發現100 余種口腔癌唾液潛在標記物[5],轉錄組學和蛋白質組學標雖表現出較好預測值,但標記物聯合運用,曲線下面積(Area Under Curve,AUC)仍未達0.90 理想水平[6]。
近五年,新的唾液標記物被發現,已知標記物的研究進一步深入,唾液蛋白組學、代謝組學庫被建立、完善,新型唾液標記物較傳統標記物體現出以下優勢:(1)唾液標記物或測定板顯示較高的AUC(單獨或聯合運用甚至超過0.90)、靈敏度和特異性;(2)不受口腔癌危險因素、慢性牙周炎影響;(3)部分標記物具有性別差異。這些優勢為其早日用于臨床提供可能。因此,本文就新型唾液生物標記物(表1)在口腔癌檢測的研究進展作一綜述。
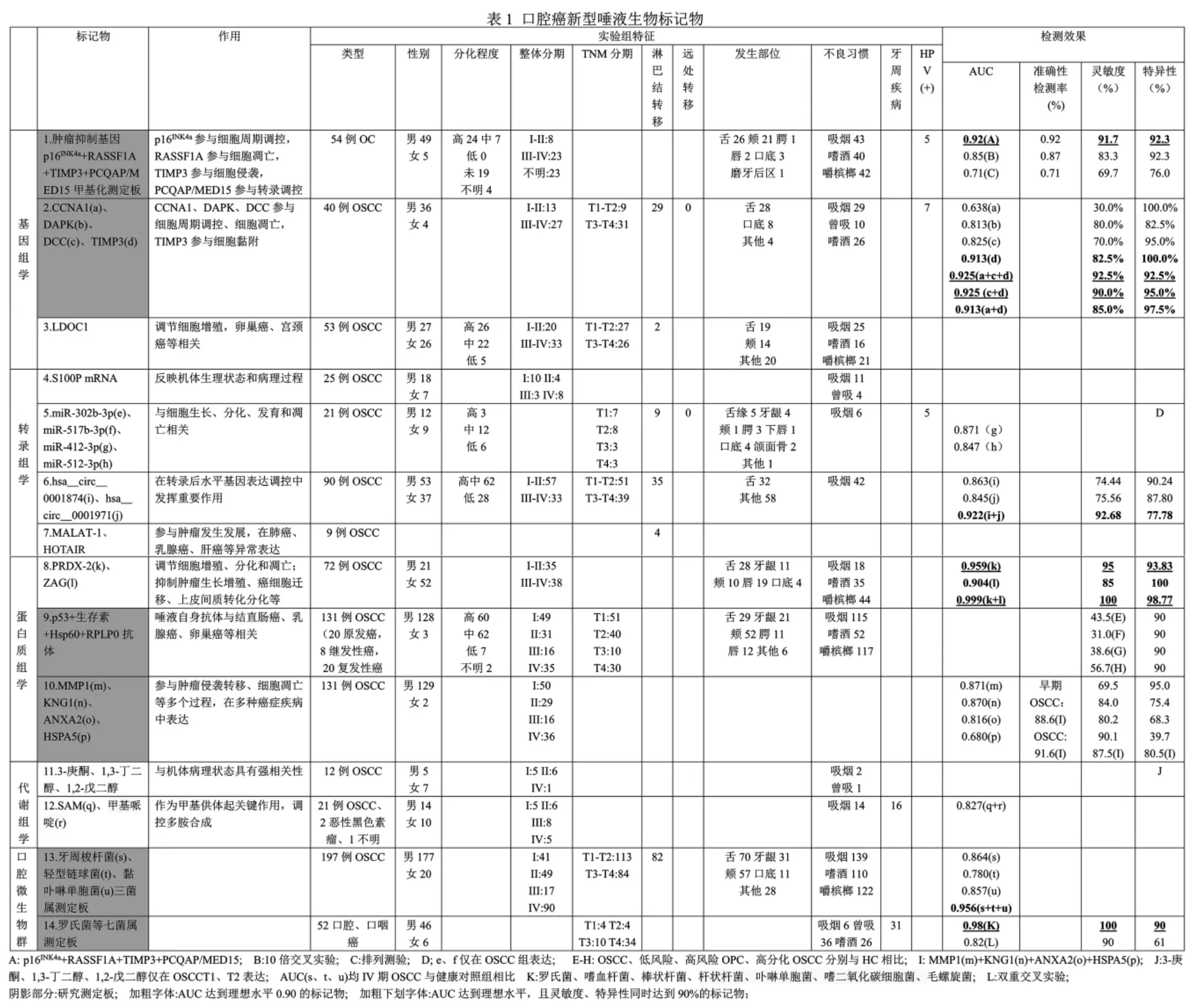
1.基因組學
多種形式的基因突變可影響蛋白合成,導致口腔癌發生。過去研究顯示,p53 基因突變在唾液與組織具有一致性,近幾年口腔癌唾液基因組學的研究熱點集中于甲基化。
Liyanage 等[7]研究了54 例口腔癌患者和60 例健康人群唾液p16INK4a、RASSF1A、TIMP3、PCQAP/MED15 抑癌基因的表達,發現四者聯合AUC、準確性、靈敏度、特異性為0.92、0.92、91.7%、92.3%,10 倍交叉實驗(模擬臨床運用效果)為0.85、0.87、83.3%、92.3%,排列測驗(模擬臨床運用效果)為0.71、0.71、69.7%、76.0%,四者聯合具有從健康人群區分口腔癌的高效性,有望成為口腔癌篩查的理想工具。
Arantes 等[8]對OSCC 患者和健康人群各40 例唾液進行研究,發現甲基化的CCNA1、DAPK、DCC 和TIMP3 在OSCC 具有高特異性,與臨床特征(性別年齡、HPV、臨床分期、血管栓塞和神經浸潤)無關,早期檢測OSCC 有較好效果:CCNA1 的AUC、靈敏度、特異性為0.638、30.0%、100.0%,DAPK 為0.813、80.0%、82.5%,DCC 為0.825、70.0%、95.0%,TIMP3 為0.913、82.5%、100.0%,CCNA1+DCC+TIMP3 為0.925、92.5%、92.5%,DCC+TIMP3 為0.925、90.0%、95.0%,CCNA1+TIMP3 為0.913、85.0%、97.5%。這些標記物表現出檢測OSCC 的潛力,有望臨床運用該測定板。
LDOC1 是一種X 連鎖腫瘤抑制因子基因,通過NF-κB 通路調節細胞增殖,與卵巢癌、宮頸癌等相關。Liu 等[9]qRT-PCR 檢測了53 例OSCC患者和43 例健康對照者唾液LDOC1,發現女性OSCC 組顯著上調,男性OSCC 組顯著下調;然而,約60%的男性OSCC 患者有吸煙史(79.1%)、嚼檳榔史(66.6%)。高表達的LDOC1 有望成為女性OSCC 唾液標記物,低表達的LDOC1 能否排除吸煙、嚼檳榔等影響成為男性OSCC 標記物,有待進一步研究。
2.轉錄組學
轉錄組學參與基因表達調控、蛋白合成修飾。唾液易檢出大量RNA,主要包括mRNAs、miRNAs,近年circRNAs、lncRNAs 開始受到重視。
mRNAs 雖只占細胞總RNA 的2%~5%,但種類最多、代謝活躍,可反映機體生理和病理狀態。健康人唾液上清約3000 種mRNA,DUSP-1、H3F3A、IL-Iβ、IL-8、OAZ-1、SAT 和S100P的聯合運用顯示較高靈敏度和特異性[10]。唾液炎性狀態影響唾液mRNAs 表達,Cheng 等[11]發現,OSCC 與中重度慢性牙周炎患者(無論吸煙與否)、健康人群相比,以上7 種mRNA 僅S100P 升高。唾液S100P mRNA 表達不受慢性牙周炎影響,有望成為OSCC 唾液潛在標記物。
miRNAs 是長約21~23 個核苷酸的非編碼RNA,占人類基因的1%~5%,卻調節約30%蛋白編碼基因,與細胞生長、分化、發育和凋亡相關。miR-125a、miR-200a、miR-31 是已被報道的口腔癌唾液潛在標記物。近年發現,唾液miRNAs可由細胞外囊泡分泌,Gai 等[12]首次評估其在OSCC的表達,發現miR-302b-3p、miR-517b-3p 僅在OSCC 組表達;miR-412-3p、miR-512-3p 在OSCC 較健康對照組表達上調,AUC 分別為0.871、0.847。提示四者可作為OSCC 檢測的可靠唾液標記物。
circRNAs 是一種無5' 帽或3' 聚尾的共價閉環結構,穩定性好、平均半衰期長,可對抗RNA外切酶、與miRNAs 結合抑制其活性。Zhao 等[13]微陣列篩選出OSCC 組12 個上調、20 個下調唾液circRNAs;隨后對90 例OSCC 唾液qRT-PCR,發現OSCC 較健康對照組上調的hsa_circ_0001874AUC、靈敏度、特異性為0.863、74.44%、90.24%,下調的hsa_circ_0001971 為0.845、75.56%、87.80%,聯合運用為0.922、92.68%、77.78%,卡方檢驗顯示二者與TNM 分期、腫瘤病理分級相關。
lncRNAs 是長度大于200 個核苷酸的非編碼RNA,可影響染色質重塑和甲基化、抑制miRNAs、調節蛋白質復合物的穩定性。57 例OSCC 組織的研究顯示,OSCC 與健康對照組有160 個差異表達lncRNAs[14]。MALAT-1、HOTAIR 是目前熱點lncRNA,Tang 等[15]qPCR 研究了9 例OSCC 唾液,發現所有患者均表達MALAT-1;5 位表達HOTAIR,4 例淋巴結轉移患者中3 例陽性表達。唾液lncRNAs 在口腔癌的研究尚處起步階段,值得關注。
3.蛋白質組學
蛋白質是遺傳信息的最終產物,唾液蛋白質組學在闡明致病機制、靶向治療等方面具有重要意義。MMP-9、白細胞介素是已被報道的口腔癌唾液潛在標記物。近年新發現139 種唾液蛋白可能與口腔癌相關[16],完善了口腔癌唾液蛋白庫。
PRDX-2 屬于硫醇特異性抗氧化酶家族,介導與細胞增殖、凋亡調節相關的多種信號通路;ZAG 屬于巨球蛋白家族,與抑制腫瘤生長、上皮間質轉化和激活凋亡相關。Heawchaiyaphum 等[17]研究了72 例OSCC 和78 例無癌對照組,發現二者在OSCC 唾液顯著上調,不受危險因素(吸煙嗜酒、嚼檳榔、人乳頭瘤病毒和EB 病毒)影響;檢測早期OSCC,PRDX-2AUC、靈敏度、特異性為0.959、95%、93.83%,ZAG 為0.904、85%、100%,二者聯合為0.999、100%、98.77%。提示二者單獨或聯合可作為OSCC 早期檢測的可靠唾液標記物。
Wu 等[18]通過ELISA 與懸浮陣列結合的多路復用面板,研究了131 例OSCC、42 例低風險、44例高風險口腔癌前病變患者和131 例健康人群唾液,發現早期OSCC 較健康個體抗p53、生存素、Hsp60、RPLP0 抗體顯著升高,與高分化OSCC相關,與臨床特征(年齡、吸煙嗜酒、嚼檳榔、部位分期、淋巴結有無轉移)不相關;將特異性確定為90%,四者檢測OSCC 靈敏度分別23.7%、20.6%、17.6%、23.7%、29.0%,檢測高分化OSCC 為30%、31.7%、23.3%、33.3%、38.3%,聯合區分OSCC、低風險、高風險口腔癌前病變、高分化OSCC 為43.5%、31.0%、38.6%、56.7%。唾液自身抗體聯合測定板具有早期檢測OSCC 潛力,靈敏度有待提高。
Yu 等[19]通過LC-多重反應監測質譜定量131例OSCC、103 例低風險、130 例高風險口腔癌前病變患者、96 例健康人群49 種唾液蛋白,生成MMP1、KNG1、ANXA2、HSPA5 測定板:MMP1的AUC、靈敏度、特異性為0.871、69.5%、95.0%,KNG1 為0.870、84.0%、75.4%,ANXA2 為0.816、80.2%、68.3%,HSPA5 為0.680、90.1%、39.7%;四蛋白測定板靈敏度、特異性分別87.5%、80.5%,能檢測88.6%的早期OSCC 和91.6%的OSCC,亦可評估高危口腔潛在惡變風險,有望運用至臨床。
4.代謝組學
唾液代謝組學與機體生理、病理狀態相關,反映基因、RNA、蛋白質的效應,表達存在性別、年齡、吸煙、受刺激狀態等差異,既往口腔癌唾液代謝組學研究涉及甜菜堿、透明質酸、氨基酸等。
新近研究表明,VOCs(揮發性有機化合物)與機體病理狀態強相關。Shigeyama 等[20]首次通過ZSM-5/聚二甲基硅氧烷雜化膜與氣相色譜-質譜聯用的薄膜微萃取技術,研究了12 例OSCC 與8 例健康對照組唾液,發現兩組分別有42、73 種內源性VOCs(35 種相同),12 種在OSCC 表達頻率改變;3-庚酮、1,3-丁二醇、1,2-戊二醇僅在OSCC 的T1、T2 階段表達。該研究建立了OSCC患者和健康人群唾液代謝組學特征,并初步探討VOCs 作為OSCC 唾液潛在標記物。
Ishikawa 等[21]運用毛細管電泳質譜分析了24例口腔癌患者和44 例健康對照者未受刺激全唾液親水代謝物,發現45 種有統計學差異,SAM 聯合甲基哌啶從健康人群篩查口腔癌AUC 為0.827。差異表達的唾液代謝物有望用于口腔癌篩查;SAM聯合甲基哌啶檢測效果較好,單獨運用不甚明確。
5.口腔微生物群
口腔微生物群包括細菌、病毒、真菌,口腔癌致病因素影響微生物群組成。近年,宏基因組技術有助于研究口腔癌微生物基因組、毒力特性及與機體免疫的相互作用。
Yang 等[22]對197 例不同時期OSCC 和51 例健康個體口腔漂洗樣本的微生物測序,發現梭菌屬(牙周梭桿菌、微小單胞菌、星狀鏈球菌、流感嗜血桿菌和產線梭桿菌AUC 分別0.864、0.883、0.856、0.696、0.800)豐度增加,而鏈球菌(輕型鏈球菌0.780)、嗜血桿菌(副流感嗜血桿菌0.805)、卟啉單胞菌(黏卟啉單胞菌0.857)和放線菌屬隨OSCC 進展減少,牙周梭桿菌、輕型鏈球菌、黏卟啉單胞菌三菌屬研究測定板區分IV 期OSCC 與健康對照組AUC 為0.956。
Lim 等[23]同法分析了52 例口腔、口咽癌患者、11 例高危人群和10 例健康人群口腔漂洗樣本,測定出6 個已知門類和28 個菌屬,羅氏菌、嗜血桿菌、棒狀桿菌、桿狀桿菌、卟啉單胞菌、嗜二氧化碳細胞菌低豐度表達于口腔癌和口咽癌組,毛螺旋菌則高表達,七菌屬測定板AUC、靈敏度、特異性分別0.98、100%、90%,雙重交叉實驗為0.82、90%、61%,該測定板有望用于臨床檢測。
6.小結
相比既往研究,新型口腔癌唾液標記物AUC較高,不受危險因素、慢性牙周炎等影響,為探尋理想標記物提供諸多新進展。期待在以下方面有更深入研究:1.全面測定標記物單獨或聯合AUC,確定靈敏度、特異性最佳結合點,聯合交叉驗證、排列實驗等,篩選理想標記物;2.統一檢測技術質控標準,使研究數據具有可比性;3.對照組設定更多考慮口腔癌危險因素、慢性牙周炎等對特異性的影響;4.關注標記物在口腔癌前病變或狀態的差異表達,以評估癌變風險。綜上,新型口腔癌唾液標記物及聯合測定板顯示較好的檢測效果,但臨床檢測、早期篩查效果暫不明確;加快臨床運用并驗證可靠性及重復性,成為亟待解決的問題。

