熱熔壓敏膠為基質制備的傷柏貼膏皮膚給藥安全性分析
梁秀清, 徐海燕, 劉東文, 何寶凝, 陳韻姿
(佛山市中醫院制劑中心,廣東佛山 528000)
傷柏貼膏是在佛山市中醫院臨床驗方傷柏散的處方基礎上進行研發的新型制劑,具有涼血散瘀、消腫止痛的作用,用于慢性軟組織損傷和勞損,癥見關節腫脹,筋骨疼痛屬瘀血阻絡等。該制劑與原散劑相比,具有載藥量大、使用方便、透氣性好等優點[1-2]。其中,用作基質的熱熔壓敏膠屬于貼膏生產中較前沿的基質,尚未收載于我國藥用輔料名錄中。作為國內首次由廣東省藥監局批準以熱熔壓敏膠為基質的新制劑之一,在研發上處于較領先的地位。為了收集該制劑臨床使用前的數據,本試驗考察了傷柏貼膏在皮膚上的使用安全性,現將研究結果報道如下。
1 材料
1.1 動物KM小鼠,SPF級,18 ~22 g,雌雄各半,由廣州中醫藥大學實驗動物中心提供,動物質量合格證號:0067727。白化豚鼠,普通級,250 ~300 g,雌雄各半,由廣州中醫藥大學實驗動物中心提供,動物質量合格證號:0067727。新西蘭兔,普通級,1.5 ~2.5 kg,雌雄各半,由廣州中醫藥大學實驗動物中心提供,動物質量合格證號:0067727。
1. 2 藥物傷柏貼膏[6 g(生藥)/貼,117 cm2/貼](批號:305J8)及賦形劑貼,均由佛山市中醫院提供;硫化鈉,天津市福晨化學試劑廠生產,批號:20091207;2,4-二硝基氯苯,天津市光復精細化工研究所生產,批號:07713。
2 方法與結果
2.1 急性毒性試驗[3-4]
2.1.1 敷貼劑量的選擇 取昆明(KM)小鼠15只,隨機分成3組,分別為貼敷0.4 cm2/g、貼敷0.5 cm2/g及貼敷0.6 cm2/g組。給藥前將小鼠背部及腹部進行脫毛。禁食不禁水12 h 后,按上述劑量各組小鼠接受傷柏貼膏皮膚貼敷給藥。在給藥24 h 后,各組小鼠均無出現死亡情況,且精神狀態良好,飲食、飲水、活動和二便正常,鼻、眼、口腔無異常分泌物。提示0.4 ~0.6 cm2/g敷貼劑量安全。
2.1.2 一般狀況觀察 取KM 小鼠30 只,雌雄各半,按小鼠最大貼敷劑量(0.6 cm2/g體質量),給予傷柏貼膏貼敷給藥,一日2 次,6 h/次,連續給藥2 次,藥后觀察14 d。每天觀察小鼠精神狀態、活動、毛發光澤度、食欲、進水量、大便、小便、鼻眼、口腔有無異常分泌物、有無死亡。第7、15 天稱體質量。第15 天處死及解剖動物,肉眼觀察主要臟器。
2.1.3 結果 見表1。所有受試小鼠均精神狀態良好,毛色光潔,飲食、飲水、活動和二便正常,鼻、眼、口腔無異常分泌物,體質量變化正常,肉眼觀察主要臟器沒發現異常,未出現不良情況和死亡動物。傷柏貼膏的小鼠貼敷皮膚給藥劑量為61.5 g(生藥)·kg-1·d-1。該貼膏劑[6 g(生藥)/貼,117 cm2/貼]成人臨床每天用量為1 ~2貼,即每天最大用量為12 g(生藥)/d,以成人體質量60 kg 計,平均用藥劑量為0.2 g(生藥)·kg-1·d-1。而本品小鼠的日給藥量是成人最大臨床用量的308倍,提示本貼膏劑安全性較高。
2.2 皮膚過敏性試驗[3-4]
2.2.1 方法 取豚鼠30只,隨機分為5組,即賦形劑對照組,陽性對照組,傷柏貼膏高、中、低劑量組,每組6只,給藥前背部兩側脫毛,脫毛區為5 cm×5 cm。在第0、7、14 天,賦形劑對照組貼予賦形劑,陽性對照組涂予1%的2,4-二硝基氯苯,傷柏貼膏高、中、低劑量組(劑量分別為78.0、39.0、19.5 cm2·kg-1·d-1),貼敷6 h。末次給予相應的藥物致敏后14 h,在激發接觸階段,陽性對照組涂予0.1%的2,4-二硝基氯苯,其余各組再次貼予相應的藥物。6 h 后,觀察72 h 內皮膚過敏反應情況,并按表2皮膚過敏反應評分標準進行評分,計算致敏發生率,再按表3進行皮膚致敏性評價標準,同時密切觀察動物是否有哮喘、站立不穩或休克等嚴重的全身性過敏反應出現。
2. 2. 2 結果 如表4 所示,豚鼠按傷柏貼膏高、中、低劑量及賦形劑皮膚貼敷均無出現水腫及紅斑等過敏反應,并且在觀察過程中豚鼠均無出現哮喘、站立不穩或休克等嚴重的全身性過敏反應。實驗結果表明傷柏貼膏對豚鼠無致敏性。
2.3 皮膚刺激性試驗[3-4]
2.3.1 方法 取家兔8 只,雌雄各半,隨機分為單次給藥組和多次給藥組,每組4只。試驗前24 h對給藥區(背部)進行脫毛處理。去毛范圍左、右各6 cm×6 cm(給藥前檢查去毛皮膚是否因去毛而受損傷,有損傷的皮膚不宜進行試驗)。
單次給藥組:傷柏貼膏,以12 cm2·kg-1·d-1的劑量,直接貼敷于一側已去毛的皮膚上,然后用無刺激性膠布加以固定,另一側貼予賦形劑對照,貼敷6 h。貼敷結束后,除去該貼劑并用溫水清潔給藥部位,在自然光線下,肉眼觀察去除藥物后1、24、48、72 h的皮膚反應,并記錄貼敷部位有無紅斑和水腫等情況。按表2皮膚過敏反應程度的評分標準對皮膚紅斑和水腫進行評分,計算每一觀察時間點各組受試物及賦形劑皮膚反應積分的平均分值,再按表3進行刺激強度評價。多次給藥組:取傷柏貼膏,以12 cm2·kg-1·d-1的劑量,直接貼敷于一側已去毛的皮膚上,然后用無刺激性膠布加以固定,另一側貼予賦形劑對照,連續1周同一時間給藥,每天1次,每次貼敷6 h。貼敷結束后,除去該貼劑并用溫水清潔給藥部位,在每次去除藥物后1 h以及再次貼敷前觀察及記錄紅斑及水腫、貼敷部位是否有色素沉著、出血點、皮膚粗糙或皮膚菲薄情況及其發生時間及消退時間,并對紅斑及水腫進行評分。末次貼敷后,在自然光線下,肉眼觀察去除藥物后1、24、48、72 h的皮膚反應,并記錄貼敷部位有無紅斑和水腫等情況,按表5皮膚刺激性反應評分標準對皮膚紅斑和水腫進行評分,先計算觀察時間點各組積分均值,然后計算觀察期限內每天每只動物刺激積分均值,再按表6皮膚刺激強度評價標準進行刺激強度評價。

表1 傷柏貼膏小鼠皮膚給藥急性毒性試驗Table 1 The changes in symptoms of mice in acute toxicity test for Shangbai Plaste

表2 皮膚過敏反應程度的評分標準[5]Table 2 The scoring standard for skin allergic degrees

表3 皮膚致敏性評價標準[5]Table 3 The evaluation standard for skin sensitization
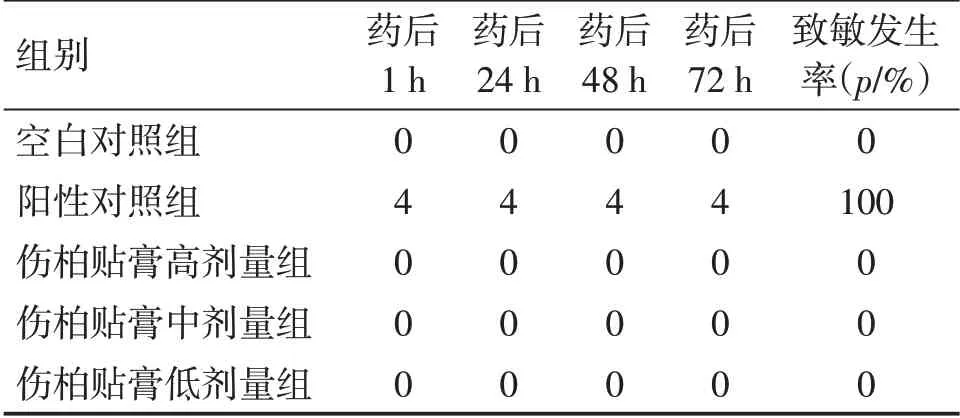
表4 皮膚過敏反應程度的平均分值及致敏發生率Table 4 The average scores and skin sensitization rate for skin allergic degrees (n=6,s/分)
2.3.2 結果 新西蘭兔按傷柏貼膏12 cm2·kg-1·d-1劑量貼敷皮膚給藥,單次給藥組在局部貼敷賦形劑和受試藥的1、24、48、72 h后,貼敷部位均無紅斑和水腫等情況。多次給藥組給藥7 d,在末次局部貼敷賦形劑和受試藥的1、24、48、72 h 后,賦形劑部位均無紅斑和水腫等情況。受試藥部位有輕度紅斑,平均分值(0.25 分)介于0 ~0.49 分之間。觀察期限內,賦形劑組和傷柏貼膏組每天每只動物積分均值分別為0 分及0.1 分,介于0 ~0.49分之間表明傷柏貼膏對新西蘭兔局部皮膚無刺激性。
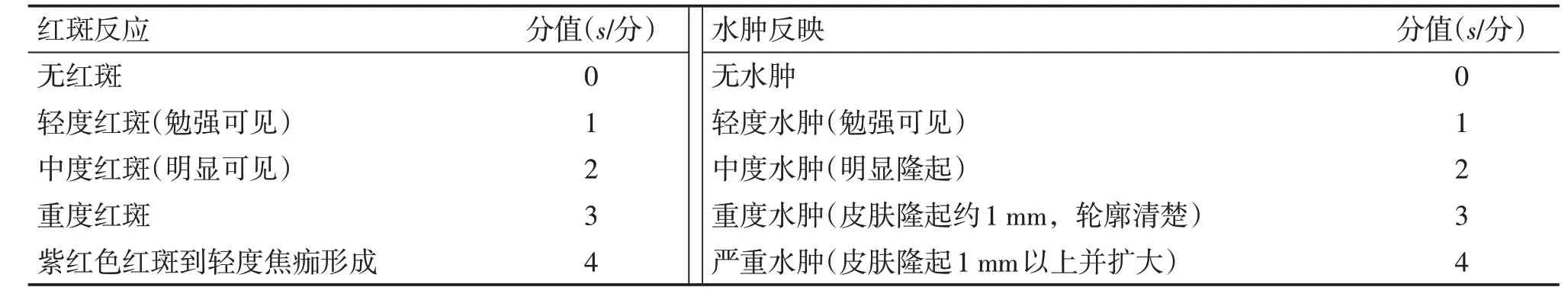
表5 皮膚刺激性反應評分標準[5]Table 5 The scoring standard for skin irritation

表6 皮膚刺激強度評價標準[5]Table 6 The evaluation standard for skin irritation
3 討論
在新制劑的研發過程中,安全性研究一直是不容忽視的部分。雖有研究[6-7]結果表明,熱熔壓敏膠貼劑對皮膚無刺激和致敏性,但因熱熔壓敏膠沒有收載于我國的藥用輔料名錄中,尚無法定標準,國內市面至今沒有經藥監部門批準正式生產的藥品或醫療機構制劑,更未能形成產業化,僅見一些以“醫療器械”名義注冊的產品在市面上流通,這些產品也未見相關的有效性或安全性實驗資料支持,這也為熱熔壓敏膠的應用帶來了一定的不確定性。
本試驗結果表明,傷柏貼膏對小鼠皮膚無全身急性毒性反應,對家兔皮膚無刺激性,對豚鼠皮膚無過敏反應,表明該新制劑是較安全的局部外用藥,此為其在臨床的推廣使用提供了數據基礎。傷柏貼膏作為我院骨傷疾病治療的新劑型補充,既保留了原散劑的療效,又改進了患者的用藥模式,可為醫院制劑的臨床使用發揮更可靠的作用,進一步推動了醫療機構制劑的發展。

