siRNA-SRF對人肺癌A549增殖和侵襲的影響
華海俠 趙敏 顧濤 付占昭 白立立 劉瑞吉
研究表明,血清應答因子(serum response factor,SRF)在癌組織中高表達,伴隨著E-鈣粘蛋白(E-cadherin)、β-catenin(β-連環蛋白)表達的下調,與浸潤深度和淋巴結轉移關系密切,提示SRF可能是腫瘤侵襲和轉移的重要調控機制之一[1]。SRF調控基因表達的主要信號轉導通路有兩條:一是與增殖有關的有絲分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信號,另外一條調控通路是Rho信號依賴的肌動蛋白的細胞動力學改變,提示SRF與腫瘤細胞增殖和細胞動力學改變可能有一定的關聯[2]。因此本研究擬采用RNA干擾技術,構建多條特異性的針對SRF的siRNA并轉染入肺癌A549細胞,采用realtime PCR篩選出干擾效率最高的siRNA-SRF。采用CCK-8法、流式細胞檢測、侵襲實驗、westernblot等方法,觀察SRF表達的下調與細胞增殖和侵襲轉移的關系,進一步研究SRF在肺癌細胞增殖、侵襲轉移中的分子機制。
1 材料與方法
1.1 材料 A549細胞株購自于中科院上海細胞庫;siRNA構建及合成購自于上海吉瑪制藥技術有限公司;細胞培養相關耗材耗材購自于廣州潔特生物過濾制品有限公司;CCK-8細胞增殖試劑盒(日本同仁化學研究所);SRF一抗(sc-335,美國Santa Cruz公司);Trizol及PCR相關試劑(美國Invitrogen公司);免疫組化試劑盒(北京中杉金橋生物技術有限公司)。
1.2 方法
1.2.1 細胞轉染:由上海吉瑪制藥技術有限公司設計并合成4條針對SRF基因的小干擾RNA(small interfering RNA,siRNA),各組基因序列詳為:①SRF-900:sense:5’-GCCGCGUGAAGAUCAAGAUTT-3’,anti-sense:5’-AUCUUGAUCUU CACGCGGCTT-3’;②SRF-951:sense:5’-CGACCUUCAGCAAGAGGAATT-3’,anti-sense:5’-UUCCUCUUGCUCAAGGUCGTT-3’;③SRF-1107:sense:5’-GCAAGGCACUGAUUCAGACTT-3’,anti-sense:5’-GUCUGAAUCAGUGCCU UGCTT-3’;④SRF-1649:sense:5’-GCCACCAUCAUGACGUCAUTT-3’,anti-sense:5’-AUGACGUCAUGAUGGUGGCTT-3’;⑤陰性對照:sense:5’-UUCUCCGAACGUGUCACGUTT
-3’,anti-sense:5’-ACGUGACACGUUCGGA GAATT-3’。調整細胞密度至次融合狀態(匯合率70%~80%),0.2% FBS同步化24 h,按照上海吉瑪制藥技術有限公司《RNA產品使用手冊》進行轉染,轉染條件為siRNA∶RNAi-Mate為1∶3。實驗分組:①空白對照組;②轉染組:加入針對SRF的siRNA及轉染劑siRNA-Mate;③轉染對照組:僅加入與轉染組等劑量的轉染劑siRNA-Mate;④陰性對照組:加入針對陰性對照的siRNA及轉染劑siRNA-Mate。
1.2.2 CCK-8法檢測細胞增殖:調整細胞密度為1×104/孔種植于96孔板,次融合后同步化24 h,按照實驗設計分組(每組10孔),48 h后加入10 μl/孔 CCK-8,37℃培養箱中培養3 h,酶標儀450 nm測定A值,計算抑制率(抑制率=1-試驗組A值/空白對照組A值×100%)。
1.2.3 免疫細胞化學染色:按照文獻[3]方法制備細胞爬片,按實驗設計分組轉染,24 h后4%多聚甲醛固定1 h。采用枸鹽酸高壓修復,一抗過夜(SRF稀釋濃度為1∶100),按照SABC免疫組化試劑盒說明書進行,DAB顯色,蘇木素輕度復染,中性樹膠封片。
1.2.4 流式細胞術檢測細胞周期:按實驗設計分組并誘導,48 h后,制備單細胞懸液,調整細胞密度至1×106/ml。70%乙醇44℃固定過夜,離心棄上清,PBS漂洗3次。加入200 μl 1 mg/ml RNA酶37℃處理30 min。加入400 μl 10 mg/ml PI工作液,避光染色30 min,上機檢測。
1.2.5 基質膠侵襲實驗檢測侵襲能力收集細胞:離心重懸調整細胞密度為1×105cell/ml,在transwell小室上層加入200 μl單細胞懸液,下室沿側壁加入600 μl含10%胎牛血清的1640培養基。37℃,5% CO2培養24 h。取出小室,小心去除濾膜表面未穿膜的腫瘤細胞。95%乙醇固定,吉姆薩染色。鏡下計數侵襲細胞數,取5個視野的平均值。以侵襲細胞的相對數目反映細胞的侵襲能力。
1.2.6 Western blot檢測蛋白表達:RIPA裂解細胞,收集上清12 000 g離心15 min,收集上清,分裝冰凍保存。BCA法測定蛋白濃度,按30~50 μg蛋白/泳道上樣并常規電泳、轉膜,SRF一抗(1∶100)4℃過夜,二抗37℃孵育1 h,加入BCIP/NBT顯色并掃描。采用Image J圖像分析軟件測定條帶的OD值,各組蛋白經內參平衡后,采用與對照組的比值作為該蛋白的相對表達量。
1.2.7 Realtime PCR法檢測mRNA的含量:Trizol提取總RNA,SRF、內參基因GAPDH引物由上海生工生物工程技術服務有限公司設計合成,分別為SRF:5’-CTTAACATGGCATCTTCGACACT-3’,5’-CTTAACCTC
TAATCCCCATTGCT-3’;GAPDH:5’-GGGAAACTGTGG
CGTGAT-3’,5’-TGGGTGTCGCTGTTGAA GT-3’。反應條件:逆轉錄反應(37℃ 15 min,8℃ 5 s),PCR反應(95℃預變性30 s,95℃變性5 s,58℃退火30 s,72℃延伸30 s,共30循環),由RCR儀自帶程序進行分析(2-ΔΔCT法)。
2 結果
2.1 siRNA-SRF對A549細胞mRNA表達的影響 Realtime PCR結果顯示,對肺癌A549給予siRNA-SRF干擾后,4條siRNA均能下調SRF mRNA的表達,siRNA-SRF-900、siRNA-SRF-901、siRNA-SRF-1107、siRNA-
SRF-1649分別是對照組的56.4%、36.4%、25.0%和53.6%,相應的沉默效率分別為43.6%、63.6%、75.0%和46.3%,差異有統計學意義(F=66.042,P<0.05)。轉染對照組、陰性對照組表達水平是空白對照組的94.5%和93.7%,差異無統計學意義(P>0.05)。其中siRNA-SRF-1107基因沉默效率最高,為75.0%。因此選用siRNA-SRF-1107進行后續實驗研究。見表1。
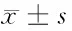

組別SRF mRNA空白對照組1.07±0.09轉染對照組1.10±0.14陰性對照組1.07±0.15siRNA-SRF-9000.54±0.07*#△siRNA-SRF-9010.36±0.05*#△siRNA-SRF-11070.25±0.12*#△siRNA-SRF-16490.52±0.04*#△
注:與空白對照組比較,*P<0.05;與轉染對照組比較,#P<0.05;與陰性對照組比較,△P<0.05
2.2 siRNA-SRF對A549細胞SRF蛋白表達的影響 SRF定位于肺癌A549細胞核內,予以siRNA-SRF-1107干擾后,SRF染色強度明顯減弱。Western blot檢測顯示,予以siRNA-SRF-1107干擾后,轉染組的SRF表達水平明顯下調,是空白對照組的40.1%,差異具有統計學意義(F=142.735,P<0.05)。而陰性對照組和轉染對照組表達水平與空白對照組差異無統計學意義(P>0.05)。見圖1、2,表2。

圖1 siRNA對A549細胞株SRF蛋白表達的影響(免疫細胞化學×200);A 空白對照組;B 陰性轉染組;C 轉染對照組;D siRNA-SRF轉染組

圖2 siRNA對A549細胞株SRF蛋白表達的影響(免疫印跡);A 空白對照組;B 陰性轉染組;C 轉染對照組;D siRNA-SRF轉染組
2.3 siRNA-SRF對肺癌A549細胞增殖、細胞周期的影響 轉染48 h以后,空白對照組、轉染對照組、陰性對照組和轉染組的OD值分別為(1.784±0.326)、(1.663±0.141)、(1.738±0.261)和(0.638±0.170)。轉染入siRNA-SRF-1107后,A549細胞株增殖明顯受限,抑制率為64.24%,與空白對照組相比,差異有統計學意義(P<0.05)。陰性對照組和轉染對照組與空白對照組之間比較,細胞增殖抑制率分別為2.58%和6.78%,差異無統計學意義(P>0.05)。流式細胞儀檢測空白對照組、轉染對照組、陰性對照組和轉染組細胞周期。各組S期細胞百分比分別為(44.72±0.60)%、(43.24±2.97)%、(43.73±1.41)%、(23.90±1.94)%。空白對照組、陰性對照組和轉染對照組在G0/G1、S、G2期百分比方面差異無統計學意義(P>0.05)。而轉染siRNA-SRF-1107后,A549細胞株S期百分比明顯減少(P<0.05)。見表2、3。
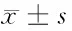

組別SRF蛋白表達水平細胞增殖空白對照組0.51±0.051.784±0.326轉染對照組0.48±0.081.663±0.141陰性對照組0.47±0.151.738±0.261siRNA-SRF-11070.20±0.06*#△0.638±0.170*#△
注:與空白對照組比較,*P<0.05;與轉染對照組比較,#P<0.05;與陰性對照組比較,△P<0.05
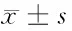

組別細胞周期(S)細胞侵襲空白對照組44.72±0.60144.83±17.42轉染對照組43.24±2.97147.17±12.35陰性對照組43.73±1.41136.83±15.28siRNA-SRF-110723.90±1.94*#△60.50±14.21*#△
注:與空白對照組比較,*P<0.05;與轉染對照組比較,#P<0.05;與陰性對照組比較,△P<0.05
2.4 siRNA-SRF對肺癌A549細胞侵襲能力的影響 通過transwell小室侵襲實驗,檢測空白對照組、轉染組、陰性對照組和轉染對照組的細胞侵襲能力,顯微鏡下計數侵襲細胞數,分別為(144.83±17.42)、(147.17±12.35)、(136.83±15.28)、(60.50±14.21),與空白對照組比較,siRNA-SRF-1107組侵襲細胞數明顯減少(P<0.05),而陰性對照組和轉染對照組與空白對照組比較,差異無統計學意義(P>0.05)。
3 討論
體內研究多發現,SRF的高表達與E-cadherin、β-catenin的缺失(異位)表達密切相關[4,5],亦與基質金屬蛋白酶(MMP)-2、-9表達上調有關[6],且與腫瘤預后相關[7]提示E-cadherin的表達缺失和β-catenin的異位表達(從細胞膜到細胞核)破壞了細胞間的連接,同時伴有MMP蛋白表達的上調,使細胞獲得了更高的運動性和侵襲性,這可能是SRF促進腫瘤細胞轉移和侵襲的機制之一。體外研究則發現采用過表達技術上調肝癌細胞株SRF的表達,能夠使細胞獲得間質細胞表型,促進腫瘤細胞的遷移和侵襲,而基因沉默SRF則引起相反效應,細胞增殖受抑,細胞數量和活力減少,S期細胞百分比下調,同時細胞遷移和侵襲能力下降;采用SRF沉默能產生類似的效果[8-10]。在前列腺癌細胞中,SRF是雄激素受體的重要決定簇,缺少SRF將會抑制前列腺癌細胞的增殖[11,12]。而近年來的文獻也提示,抑制SRF的轉錄能夠有效抑制腫瘤細胞的侵襲和轉移[13-15],提示針對SRF的基因沉默能夠有效抑制腫瘤細胞的增殖和遷移。
本研究選擇了沉默效果最高的siRNA-SRF-1107,有效的下調SRF在肺癌A549mRNA和蛋白的表達水平。利用CCK-8法檢測細胞增殖,發現轉染組細胞增殖明顯受抑,而陰性對照組和轉染試劑對照組對細胞增殖無影響,進一步提示設計的siRNA特異性和靶向性強,采用的脂質體轉染法對細胞增殖無影響。同時使用流式細胞儀檢測細胞周期,發現轉染組細胞被阻滯在G1期,提示SRF可能在A549細胞株中調控細胞周期,與肺癌細胞增殖密切相關。進一步檢測細胞侵襲能力發現,轉染的細胞侵襲能力明顯下降,提示SRF mRNA和蛋白水平的下調能夠減少肺癌A549細胞的侵襲能力。
綜上所述,結合前期在體內實驗結果,本研究提示基因沉默SRF,能夠抑制肺癌A549的增殖,并降低其侵襲能力,SRF可能是防治肺癌治療的一個有效靶點。

