CuSO4對氰化提金貧液中SCN-的沉淀效果以及對共存離子濃度的影響
黨曉娥,淮敏超
(西安建筑科技大學冶金工程學院,陜西省黃金與資源重點實驗室,陜西西安710055)
引 言
氰化法因其工藝簡單、技術成熟等優勢而在黃金提取領域占據主導地位[1]。由于金具有親硫、親銅、親鐵的地球化學性質,在金礦物中多伴生有金屬硫化物,金礦粉浸出過程,金屬硫化物與體系中的有用組分CN-、OH-和[O2]反應生成SCN-、S2O32-、SO32-、SO42-、S2-以及銅、鋅、鐵等金屬氰配合物進入浸出液[2]。某些硫化礦物與體系中的CN-、OH-和[O2]反應生成的中間產物S和S2-又與CN-反應生成SCN-,S的氧化產物S2O32-與CN-反應也生成SCN-[2]。所以,浸金貧液不但含劇毒氰,同時還含銅、鋅及鐵的配合物以及低毒SCN-[3]等有價成分,貧液是一種重要的二次資源,處理過程要最大限度回收這些有價組分。
目前,國內的氰化廠提金貧液均已實現閉路循環,但其循環利用過程,銅、鐵、鋅配合物以及SCN-等離子會在系統中逐漸積累。例如河南某黃金冶煉廠直浸貧液中TCu高達7 g/L,SCN-高達10.1 g/L;陜西潼關某冶煉廠貧液經半酸化法降Cu(CN)43-和SCN-后,系統中TCu和SCN-濃度仍高達2.3 g/L 和4.5 g/L。大量生產實踐證明,當浸液中TCu濃度大于1.0 g/L[4-5]時將失去浸金活性,呈現出“疲勞”現象。大量和SCN-的生成不但增加氰化物的消耗[6],而且使生產過程難以順利進行。因此,冶煉廠定期外排部分貧液是不可避免的。
目前,提金貧液的處理方法有SO2/Air 氧化、H2O2氧化、臭氧氧化以及NaClO 氧化法、酸化法和半酸化法,前四種都是破壞氰化物的方法,造成CN-的浪費,經濟效益低。另外,由于SCN-化學性質非常穩定,前三種方法均不適合處理高含量的SCN-貧液。NaClO 氧化法不能氧化除去鐵氰絡合物[7],臭氧法制取臭氧耗電量大,生產成本高[7]。全酸化[8]和半酸化法工業上應用較多[9-10],全酸化法需空氣吹脫酸化后液-堿液吸收吹脫出的HCN 生產NaCN,生產周期長,處理低濃度貧液經濟效益低或無經濟效益;半酸化法酸化后液無需吹脫HCN,而是直接用石灰中和至pH=10~11 返回浸金過程,該法投資小、流程簡單、經濟效益好。但SCN-去除效果取決于貧液中Cu(CN)43-濃度,越高,除SCN-效果越好。電解氧化法雖可回收銅,但不能回收氰,而且電流效率低,電耗較大[11-12]。高鐵酸鹽[13]氧化法雖可解決H2O2、NaClO法去除SCN-效果不佳的問題,但大量SCN-被氧化消耗掉。離子交換樹脂[14-15]和離子交換纖維[16-17]對SCN-具有很強的吸附能力,但負載SCN-的樹脂需要解吸和再生,操作過程較復雜,且樹脂和纖維生產成本高。Bai 等[18]采用微波輻射-芬頓氧化法去除廢水中的SCN-,SCN-氧化率達到90%以上,但微波氧化應用于工業廢水處理目前技術和設備還不成熟。波茨[19]采用Caro 酸再生氰化物法把SCN-轉化成浸金用的CN-,但設備復雜,目前還處于實驗室研究階段。對于單獨含SCN-的廢水,馮海兵等[20]用60Coγ 和BF-5 型直線電子加速器作為輻照源降解SCN-,發現低濃度時,SCN-與·OH 自由基發生氧化反應被降解,但SCN-濃度高時卻生成穩定的(SCN)2-,降解過程變得困難。李圓圓等[21-22]研究了紫外光催化H2O2和激活過硫酸鹽降解SCN-,SCN-的降解效果都很好,但需要人造紫外光源,電能消耗大,運行成本高,故難以大規模推廣應用。謝鮮梅等[23]采用改性膨潤土復合材料吸附SCN-,具有快速、應用pH 范圍廣、成本低等特點,但負載SCN-的膨潤土材料難以解吸和再生。梁達文[24]采用CuCl 沉淀SCN-,廢水中的SCN-的回收率達94.5%,但引入活性強難以除去的Cl-。王小瑤等[25]采用NaSO3還原法處理某有機制藥廢水中高含量的SCN-,在CuSO4與Na2SO3投加量為1.6 倍化學反應計量時,常溫下可將廢水中的99.85%的SCN-去除。此法除SCN-效果雖好,但加入大量還原劑Na2SO3,處理成本較高。針對目前處理含SCN-方法的不足,有必要研究操作過程簡單、廢水處理量大、生產成本低且能綜合回收SCN-的處理方法。
提金貧液經ZnSO4降Cu(CN)43-后,其中TCu濃度滿足循環要求,但仍含有高濃度SCN-,降銅后液返回系統循環利用過程SCN-會逐漸積累,當其積累到一定程度會影響生產的正常進行。因此,可定期外排一定量的貧液經ZnSO4降Cu(CN)43-后,再用CuSO4沉淀SCN-。本研究以河南某黃金冶煉廠用ZnSO4降后的貧液為研究對象,在分析其元素組成及含量的基礎上,用CuSO4沉淀SCN-,主要研究了沉淀劑用量、沉淀時間、沉淀溫度對SCN-沉淀效果以及對共存離子濃度的影響,研究結果將對黃金工業的可持續發展以及冶金廢水二次資源的綜合利用具有重要指導意義。
1 實驗材料和方法
1.1 材料
提金貧液取自河南某黃金冶煉廠。
貧液沉淀SCN-過程需要的分析純試劑為CuSO4,由國藥集團化學試劑有限公司生產。
貧液中離子濃度分析需要的化學試劑主要有天津市化學試劑二廠生產的分析純甲醛、碘和碘化鉀,有天津市化學試劑一廠生產的分析純FeCl3。
1.2 實驗設備與分析儀器
貧液沉淀SCN-過程需用的主要設備有SHA-B恒溫水浴搖床(上海力辰儀器科技有限公司)。
分析設備主要有723C型可見分光光度計(上海精密儀器儀表有限公司)和7300DV 電感耦合等離子體儀(美國PE公司)。
1.3 ZnSO4沉銅實驗
稱取不同化學反應計量的ZnSO4固體于提金貧液中,并將其以160 r/min 轉速振蕩給定時間后過濾,分析濾液中離子濃度。
1.4 CuSO4沉SCN-實驗
稱取不同化學反應計量的CuSO4固體于100 ml用ZnSO4降銅后的溶液中,并將其以160 r/min 轉速振蕩給定時間后過濾,分析濾液中離子濃度。
1.5 貧液或沉淀后液的分析
(1)銅、鋅和鐵的分析:貧液或沉淀后液用鹽酸處理并稀釋至一定體積后,采用電感耦合等離子體儀分析其中金屬離子濃度。
(2)SCN-的分析:采用FeCl3分光光度法。
1.6 CuSCN質量分析
準確稱取一定質量的沉淀物2份分別用氨水溶解后,一份采用碘量法分析銅含量,一份采用分光光度法分析SCN-濃度。根據分析結果,計算二者的摩爾質量之比,判斷沉淀物化學組成;根據二者的質量總和與分析稱取的沉淀物質量比值,計算沉淀物純度。
2 實驗結果與討論
2.1 降銅后液的來源及性質
項目組前期研究表明,用1.8 倍化學反應計量的ZnSO4室溫處理某貧液,攪拌60 min 可將TCu濃度由6.70 g/L降至1.02 g/L,85%的銅和全部鐵被除去,處理后貧液中TCu濃度滿足貧液循環要求,但處理前后SCN-濃度變化不大。降銅前后溶液中離子濃度如表1所示,降銅過程相關化學反應見式(1)~式(7)[27-28]。
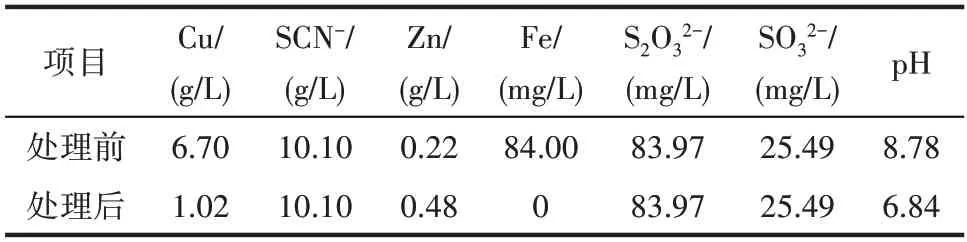
表1 降銅前和降銅后溶液中離子濃度Table 1 Ions concentration in water before and after precipitation copper
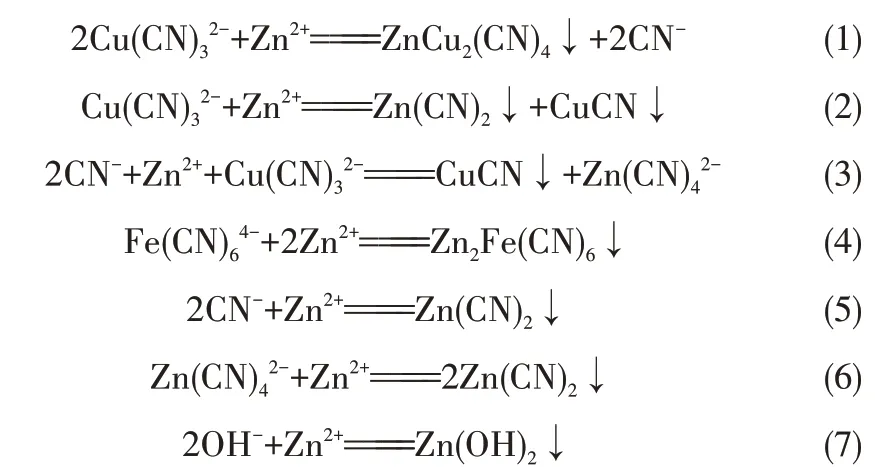
2.2 CuSO4沉SCN-研究
2.2.1 CuSO4加入量的影響 準確量取9 份降銅除鐵后的貧液100 ml 于錐形瓶中,向其中加入化學反應計量倍數的CuSO4后振蕩90 min,分析濾液中離子濃度,實驗結果如圖1和圖2所示。
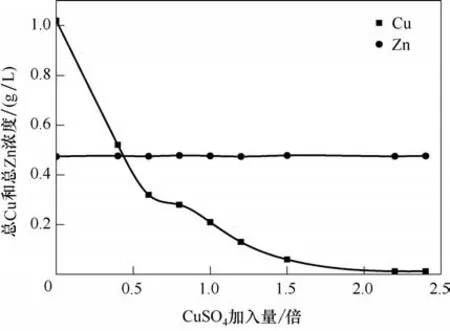
圖1 CuSO4量對銅和鋅濃度的影響Fig.1 Effect of CuSO4 dosage on Cu and Zn concentration
CuSO4降SCN-過程發現,開始產生的灰黑色沉淀逐漸轉變為白色,這是因為開始生成的Cu(SCN)2黑色沉淀的溶度積大于白色沉淀CuSCN 的溶度積,Cu(SCN)2在水溶液中極不穩定分解成穩定的CuSCN[29-30],相關化學反應如下
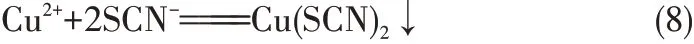
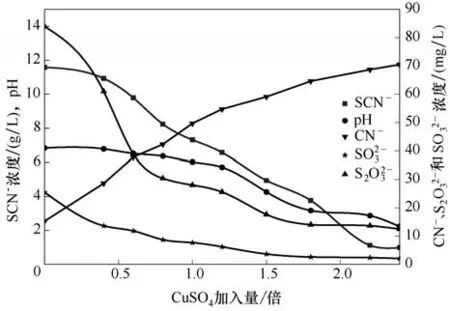
圖2 CuSO4量對各離子濃度及pH的影響Fig.2 Effect of CuSO4 dosage on ions concentration and pH
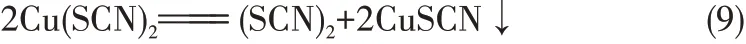
提金貧液中還含有少量還原性陰離子SO32-,SO32-會和加入的CuSO4發生反應生成白色沉淀CuSCN,同時還原性SCN-離子也和部分Cu2+發生反應生成CuSCN。相關化學反應如下
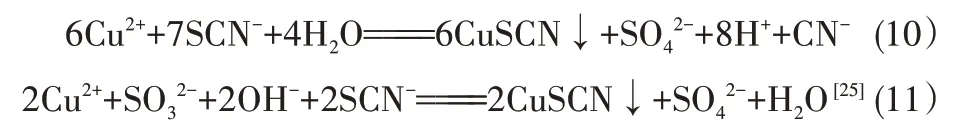
由圖1 可知,隨著CuSO4加入量的增加,沉淀后液中TCu濃度逐漸降低。TCu濃度降低可能有以下三方面的原因:一是當CuSO4加入量小于1.0倍化學反應計量倍數時,pH 大于6.0,此時加入的Cu2+發生式(8)~式(10)反應生成CuSCN;二是加入的Cu2+部分被貧液中還原性陰離子SO32-還原成Cu+,Cu+再和貧液中SCN-反應生成CuSCN,具體化學反應見反應式(11);三是當CuSO4加入量大于1.0 倍理論加入量時,pH 小于6.0,此時Cu(CN)43-穩定性降低,釋放出CN-和Cu+。由于降銅除鐵后的貧液中SCN-濃度高達10.10 g/L,而TCu濃度僅有1.02 g/L,所以釋放的Cu+會優先和貧液中大量存在SCN-反應生成CuSCN沉淀。相關化學反應如式(12)~式(13)所示。
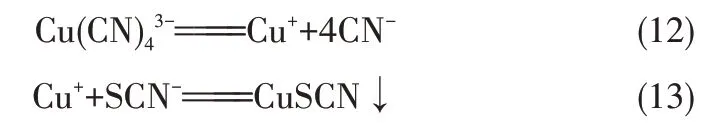
在CuSO4沉淀SCN-過程中,加大CuSO4加入量,體系pH 會逐漸降低。當加入量為化學反應計量的1.6 倍時,pH 降至2.36,此時SCN-濃度降到1.26 g/L,SCN-去除率達到88%,同時溶液開始呈現藍綠色。當其加入量為沉淀SCN-所需化學反應計量的2.2 倍時,SCN-濃度降到12.78 mg/L,SCN-去除效果很好。溶液之所以呈現藍綠色,是因為CuSO4本身為強酸弱堿鹽,CuSO4加入量增加,沉淀后液酸度增加,加入的CuSO4在溶液中以Cu2+形態存在。由于體系pH逐漸降低,SO32-和S2O32-的穩定性變差,且失去其還原性,因此其濃度也會隨之降低,進而影響式(11)反應的發生,此時TCu濃度的降低可能主要與反應式(10)有關。SO32-和S2O32-在酸性溶液中主要反應如式(14)~式(15)所示。
圖2 表明,隨著CuSO4加入量的增加,沉淀后液中SCN-濃度逐漸降低,主要是因為發生式(8)~式(11)反應生成CuSCN沉淀的緣故。
在CuSO4沉淀SCN-過程,隨著CuSO4加入量的增加,體系的pH 逐漸降低。但pH 過低,則貧液中失去還原性,同時其穩定性也降低,轉化成SO2氣體,惡化操作環境。所以后續實驗保持沉淀過程體系pH 控制在6~7,此時隨著CuSO4加入量的增加,沉淀后液中SCN-濃度相比未調整pH 時變小,TCu濃度也變小。當CuSO4加入量為化學反應計量的1.6 倍時,處理后溶液中SCN-濃度為1.25 g/L,未調整pH 時SCN-濃度為1.26 g/L,可看出對SCN-去除效果影響不大,這是由于貧液中SO32-濃度本身較低,且后期實驗控制pH 在6~7,所以依靠式(11)反應降SCN-的量很少,說明CuSO4降SCN-過程主要發生式(8)~式(10)反應。
另外,從圖1 也可發現,CuSO4沉淀SCN-前后體系中的Zn濃度并未發生變化。
2.2.2 沉淀時間的影響 準確量取7 份100 ml降銅除鐵后的貧液于250 ml 錐形瓶中,分別加入1.6 倍化學反應計量的CuSO4后于常溫振蕩不同時間后過濾,分析濾液中離子濃度,實驗結果如圖3所示。
圖3 表明:延長沉淀時間,SCN-濃度由10.10 g/L下降到1.26 g/L,同時TCu濃度由1.02 g/L 降到12.7 mg/L,S2O32-和SO32-濃度也有所降低,60 min 左右系統中沉淀反應達到基本平衡。

圖3 沉淀時間對各離子濃度的影響Fig.3 Effect of precipitation time on ions concentration
2.2.3 沉淀溫度的影響 準確量取5份100 ml降銅除鐵后的溶液于250 ml 錐形瓶中,分別加入1.6 倍理論值的CuSO4后于不同溫度下振蕩60 min 后過濾,分析濾液中離子濃度,實驗結果如圖4所示。
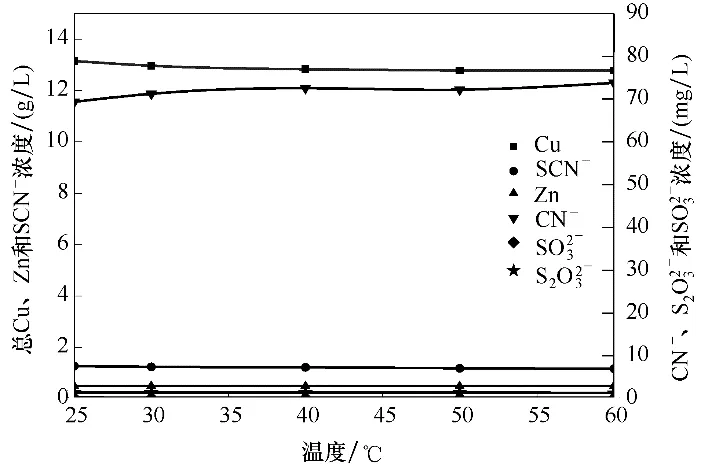
圖4 沉淀溫度對各離子濃度的影響Fig.4 Effect of precipitation temperature on ions concentration
圖4 表明,隨著沉淀溫度的升高,沉淀后液中SCN-濃度有所降低,但降低幅度不大,沉淀溫度對其他離子濃度影響也不大。因此,CuSO4沉淀SCN-以室溫進行為宜。
上述實驗表明,對于高濃度SCN-提金貧液,用CuSO4在常溫下可快速沉淀SCN-,同時大部分銅也被除去。CuSO4沉SCN-較佳條件為:CuSO4的加入量為化學反應計量的1.6 倍,沉淀時間為60 min,沉淀溫度為室溫。
2.3 重復實驗
按照以上條件進行重復實驗,實驗結果如表2所示。
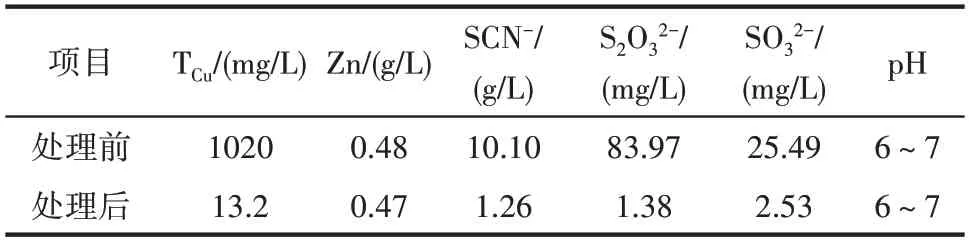
表2 CuSO4降SCN-后濾液中離子濃度Table 2 Ions concentration in water after SCN-precipitated with CuSO4
表2 表明,貧液經ZnSO4降銅除鐵和CuSO4降SCN-后,TCu由6.70 g/L 降至13.2 mg/L,SCN-由10.10 g/L 降到1.26 g/L,SCN-的去除率達87.5%,貧液中的鐵全部被除去和SO32-濃度也大幅度降低。由于沉淀Cu 和沉淀SCN-過程都加入SO42-,且沉淀SCN-過程pH 保持在6~7,沉淀后液需用石灰乳進一步中和至pH≈10,滿足氰化浸金過程對介質pH的要求。另外,中和過程同時有40%~50%的SO42-和一些金屬離子也被沉淀除去,貧液浸金活性得到一定程度恢復,可返回調漿工序循環利用,從而實現有毒貧液的“零”排放。
2.4 沉淀物的組成
為了進一步確定沉淀物的物相組成,對2.2.1 節實驗中1.6 倍化學反應計量CuSO4沉淀SCN-后的沉淀物進行X衍射分析,其XRD譜圖如圖5所示。
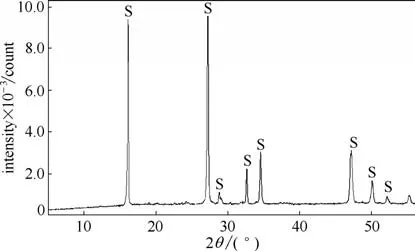
圖5 沉淀物的X衍射譜圖(S代表CuSCN的衍射峰)Fig.5 XRD patterns of precipitate
由圖5 可看出,沉淀物衍射峰尖銳,結晶性能良好,分別在16.2°、27.3°等處有明顯的衍射峰,其各衍射峰對應的D 值數據與β-CuSCN 標準卡片JCPDS的數據卡片(卡片號29-0581)相吻合,且無雜峰出現,所以CuSO4沉淀SCN-后得到沉淀物為CuSCN,與理論分析結果相吻合。
經分析,CuSO4沉淀SCN-后得到沉淀物中Cu∶SCN 摩爾比接近1∶1,且其純度可達97%以上。CuSCN 用途廣泛,是一種性能優良的無機防污顏料,用作船底防污涂料其穩定性比CuCl更好[24]。
3 結 論
(1)對于經ZnSO4降銅和除鐵后的氰化貧液,濃度雖大大降低,但SCN-濃度仍很高。以CuSO4作沉淀劑,當CuSO4加入量為化學反應計量的1.6 倍時,常溫下攪拌貧液60 min,SCN-的去除率達到87.5%以上,滿足其循環過程對SCN-濃度的要求,同時得到純度達97%以上的CuSCN產品。
(2)采用CuSO4沉淀SCN-過程,貧液pH較高時,由于參與Cu2+的還原反應生成SO42-,還原產物Cu+再與SCN-反應生成CuSCN 沉淀;貧液pH 較低時,和SO32-不能穩定存在。正是由于以上兩原因,導致貧液中S2O32-和SO32-濃度大幅度降低。

