基于電化學工作站利用修飾電極測定物質含量的開放實驗設計
王培龍 高 慧 郭傳友
(淮北師范大學 a.信息學院;b 化學與材料科學學院,安徽 淮北 235000)
在儀器分析中用于測定物質含量的方法很多,例如,高效液相色譜法[1]、高效氣相色譜法[2]、毛細管電泳法[3]、熒光光譜法[4]、原子吸收光譜法[5]和原子發射光譜法[6]等。電化學工作站作為其中的一種儀器測定設備,具有體積小、價格便宜、操作簡單等諸多優勢,應用前景廣闊,可對本科高校的學生進行推廣。但是在本科教學中涉及該設備的實驗非常少,在淮北師范大學的儀器分析實驗教學中也僅涉及了該設備的陽極溶出法,還有很多功能未能介紹給學生。因此,利用教師的科研平臺將一些成熟實驗設計成開放性實驗,使感興趣的學生進入實驗室進行實踐操作,可進一步熟悉電化學工作站操作,以及電化學測定物質含量的原理,加深對理論知識的理解,提高動手操作能力,為科學研究奠定基礎。與電化學工作站配套使用的電極有著非常重要的作用,不同的修飾電極對不同的物質有不同的響應效果,本文通過制備L-甲硫氨酸的修飾電極,配合電化學工作站的循環伏安法和差分脈沖伏安法測定物質含量,利用origin作圖軟件處理數據,引導學生對測定結果進行分析。學生熟悉完整的實驗過程后,可引導學生自主查閱文獻,進行不同修飾電極的制備,測定不同的物質含量,對測定結果進行獨立處理分析,有效培養學生的科研創新能力。
1 實驗目的和要求
(1)初步掌握L-甲硫氨酸修飾電極的制備方法;
(2)熟悉掃描電鏡的使用方法;
(3)掌握電化學工作站循環伏安法和差分脈沖掃描伏安法;
(4)掌握利用origin軟件處理數據的方法;
(5)對實驗數據能進行初步分析。
2 實驗原理
利用循環伏安法對碘離子進行循環掃描,并得到碘離子的氧化信號,在裸的玻碳電極上修飾L-甲硫氨酸,提高碘離子的響應信號強度,根據其濃度與信號的響應關系求出樣品中的碘濃度。
3 實驗內容
3.1 修飾電極的制備
將裸露的玻碳電極用0.05 μm氧化鋁拋光粉在一張細砂紙上拋光,然后依次用硝酸(1:1),乙醇和二次亞沸水沖洗。沖洗干凈后將其在雙倍蒸餾水中超聲處理,并在空氣中干燥。經過上述步驟,大多數物理吸附的物質從電極表面去除,電極在空氣中自然干燥。
將上述電極浸入含有5mL 2.5×10-3mol L-1L-甲硫氨酸儲備溶液和5ml pH 6.0 PBS的10ml聚合溶液中。在15 s靜置時間后,以150 mV s-1的脈沖幅度在2.3V和-0.7V之間進行7個循環的電聚合。用二次亞沸水沖洗除去未反應的L-甲硫氨酸并在空氣中干燥后,得到L-甲硫氨酸修飾的玻碳電極。
3.2 修飾電極的表征
分別將玻碳電極和修飾電極用掃描電鏡進行掃描,觀察電極表面的形貌變化。
3.3 碘離子電化學響應循環伏安曲線測定
分別使用玻碳電極和修飾電極對1.00×10-4mol L-1的碘離子(pH=3的磷酸緩沖液)進行循環伏安掃描,觀察電化學信號。
3.4 食用鹽中碘離子含量測定
3.4.1 標準曲線的測定
分別配制5.00×10-5,7.50×10-5,1.00×10-4,2.50×10-4,5.00×10-4,7.50×10-4, 1.00×10-3mol L-1的碘離子標準溶液,使用修飾電極通過差分脈沖伏安法測定對應的響應電流,根據電流信號與濃度的關系做出標準曲線。
3.4.2 食鹽中碘的測定
將10.000g食鹽和0.100g抗壞血酸溶于100mL pH 3.0的磷酸緩沖液中,配制成樣品溶液,使用修飾電極通過差分脈沖伏安法測定對應的響應電流,通過標準曲線求出食鹽中碘含量,并與標準值對比,求出偏差。
4 數據處理
在本科實驗教學中,涉及工作曲線法測定物質含量通常使用的是坐標紙作圖,但在實際的科研工作中,通常使用的是origin作圖軟件進行數據處理,本實驗采用origin進行數據處理,指導學生初步掌握origin的基本功能。
(1)打開origin作圖軟件,導入3.3中的數據,將掃描電壓值設置為X軸,將響應電流值設置為Y軸,同時,選中X軸和Y軸的值,點plot里的line鍵,分別做出碘離子在玻碳電極和修飾電極上的循環伏安圖。
(2)打開origin作圖軟件,3.4中的數據導入origin中,將掃描電壓值設置為X軸,響應電流值設置為Y軸,同時選中X軸和Y軸的值,點plot里的line鍵,分別做出不同濃度下的差分脈沖曲線,在曲線中找出每個濃度下對應的最大響應電流值,新建一個文件,將濃度輸入設置為X軸,將對應最大響應電流值輸入設置為Y軸,使用anslysis里的線性擬合做出標準曲線。在標準曲線中找到食鹽中碘離子的響應電流值,讀出對應的橫坐標值即為食鹽中碘含量。

圖1 玻碳電極(A)和L-甲硫氨酸修飾電極(B)的掃描電鏡圖
5 結果分析
(1)當玻碳電極表面沒有任何修飾時,如圖1(A)的掃描電鏡圖所示,其表面光滑沒有任何物質,說明清洗的很干凈。當玻碳電極表面修飾了L-甲硫氨酸時,典型的L-甲硫氨酸分子均勻排列,氨基酸具有良好的穩定性和較大的活性位點,電化學沉積和粘附均勻[7],能增加電解質和電極的接觸面積。
(2)如圖2(A)所示,在正電勢下,發現了一個在0.68V的氧化峰,這對應于I-到I2的電氧化。在反向電位下,相應的還原峰出現在0.39V處,這對應于I2向I-的可逆單電子電荷轉移。碘化物在修飾電極上的循環伏安圖如圖2(B)所示,其0.68V處的氧化峰非常小,而明顯的氧化峰集中在0.93V的更高正電勢上,表明I2可能進一步電氧化為IO3-。在反向掃描中,觀察到兩個在0.79 V和0.39 V的還原峰,最有可能分別對應于IO3
-到I2和I-的電還原。此外,修飾電極的氧化電流大于玻碳電極的氧化電流,表明修飾電極的電催化活性更高。這歸因于L-甲硫氨酸對碘的富集作用。一方面,L-甲硫氨酸在電極表面上的沉積提供了較大的表面積,這有利于電解質與電極的接觸。另一方面,在此酸性條件下(pH 3.0),氨基酸分子鏈的活性基團-NH2被質子化為-NH3+,從而通過靜電吸引I-。
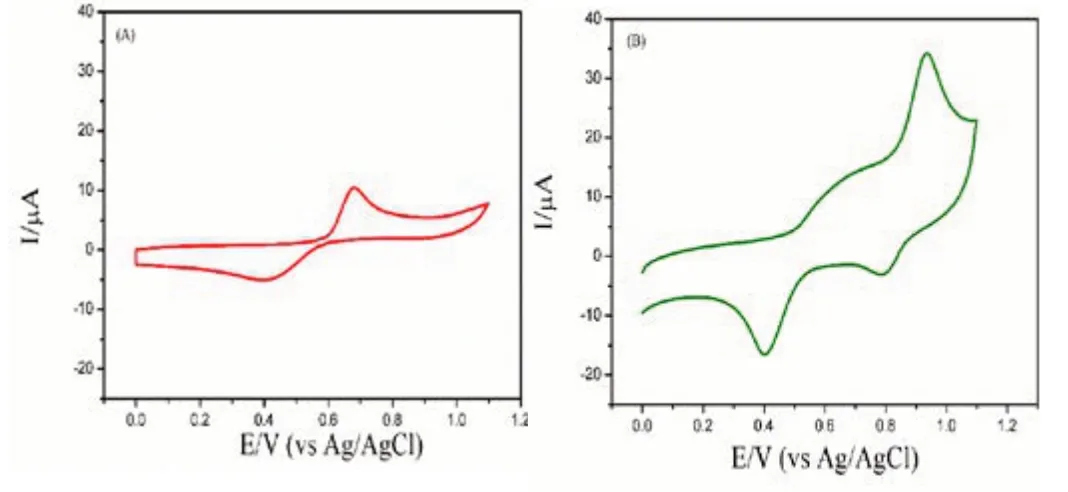
圖2 碘離子在玻碳電極(A)和L-甲硫氨酸修飾電極(B)上的循環伏安曲線

圖3 碘離子的標準曲線圖
(3)根據碘離子的濃度與峰電流之間的關系(如圖3)做出相應的線性方程為:lgI = 5.4996 + 1.2107lgC(R = 0.990 8),表明修飾電極對碘具有較高的催化活性。通過標準曲線,得到食用鹽中碘含量為22.1 mg kg-1,真值為22.5 mg kg-1偏差為1.7%,取得非常好的實驗效果。
6 思考和討論
(1)目前修飾玻碳電極的材料有哪些?各種材料有哪些優缺點?
(2)將修飾材料修飾到電極上的方法有哪些?
(3)目前利用電化學方法主要檢測哪些物質的含量,檢測限和線性范圍如何?
(4)利用電化學工作站測定物質含量能否實現多組分測定,目前的文獻中最多實現了幾種物質的同時測定?
(5)利用電化學方法實現了哪些復雜樣品中物質含量的測定?樣品的前處理方法是怎樣的?
(6)自主設計一種修飾電極,并通過電化學工作站測定某種實際的樣品含量。
7 結語
依托現有的科研平臺,通過電化學工作站設計開放性實驗,培養本科高校學生的實驗操作能力和獨立思考解決問題的能力,解決實驗課時不足的現實問題,充分利用學生的課余時間培養其科研興趣,為本科教學的深入發展提供新思路。

