不同寄主對小線角木蠹蛾幼蟲消化解毒酶的影響
王秀吉,路 浩,馮宇倩,宗世祥*
(1.北京林業大學省部共建森林培育與保護教育部重點實驗室,北京 100083;2.中國林業科學研究院林業新技術研究所森林病原整合生物學研究室,北京 100091)
小線角木蠹蛾Streltzoviellainsularis屬鱗翅目Lepidoptera木蠹蛾科Cossidae,是一種重要的林木蛀干害蟲,在中國北方地區廣泛分布。除成蟲期裸露生活,小線角木蠹蛾的其它各蟲態均在樹干的皮層、木質部和韌皮部內群居隱蔽生活,危害初期不易被發現,出現被害狀后已難以防治,因此每年都需要消耗大量的人力財力移植新樹(Bai,2012)。小線角木蠹蛾的寄主眾多,包括國槐Sophorajaponica、銀杏Ginkgobiloba、洋白蠟Fraxinuspennsylvanica、榆樹Ulmuspumila、欒樹Koelreuteriapaniculata、香椿Toonasinensis、毛桃Amygdaluspersica、旱柳Salixmatsudana、蘋果Maluspumila等12目16個科的20余種植物(Yangetal.,2014)。目前對小線角木蠹蛾的研究多集中在生物學特性和防治方法(Qin &Gao,1989;Zhang &Meng,2001;Bai,2012),而其對寄主適應機制方面的研究還未見報道。
昆蟲抵御植物的化學防御主要依賴于解毒酶(Schuler,2011),尤其多食性昆蟲體內通常擁有多種解毒酶,如細胞色素P450酶(cytochrome P450,P450)、谷胱甘肽S轉移酶(glutathione S-transferases,GST)、羧酸酯酶(carboxylesterase,CarE)等(Vogeletal.,2014)。P450酶是昆蟲體內的一個超大解毒酶家族,它可以氧化代謝多種外源和內源物質,保護昆蟲免受植物中次生代謝物、殺蟲劑等化合物的侵害,它還參與昆蟲體內激素和信息素的合成、脂肪酸代謝、角質層的形成等(Feyereisen,2005;Sztaletal.,2012)。GST酶可以催化谷胱甘肽與植物中的親電子有毒分子結合,增加其溶解性并被昆蟲代謝分解(Francisetal.,2001)。植物化感物質可誘導GST酶活性,例如,當麥長管蚜Sitobionavenae幼蟲取食抗性小麥品種(具有高濃度的酚類化合物)時,其體內的GST活性會增加(Leszczynskietal.,1994)。CarE酶能夠催化多種含有酯和酰胺的內源性或異生性化合物水解,同時它也是一種糖蛋白,這一特性可能在其催化過程中發揮了重要作用(Wheelocketal.,2005;Gopalapillaietal.,2005)。異源物質或殺蟲劑都可以影響植食性昆蟲體內的CarE酶活性,例如,在甜菜夜蛾Spodopteraexigua中,取食大白菜的幼蟲CarE活性最高,但如果用玉米幼苗飼喂甜菜夜蛾,CarE酶活性則會降低近60%(Zhangetal.,2011)。與取食其他食物的種群相比,取食卷心菜的煙粉虱Bemisiatabaci具有更高的CarE活性(Avicoretal.,2013)。目前已證實蘆丁(吲哚生物堿)等植物化感物質可以誘導昆蟲體內的CarE酶(Ghumareetal.,1989;Gaoetal.,1998)。
當昆蟲克服植物的防御屏障后,還需要進一步進行組織的分解和營養的吸收(Vogeletal.,2014)。昆蟲消化酶是消化食物的重要蛋白,一般來說,昆蟲的消化酶活性在一定程度上體現出昆蟲所需營養的種類和寄主中各類營養物質被昆蟲利用的狀況(Wangetal.,2007)。小線角木蠹蛾是林木蛀干害蟲,主要以木頭為食物,木頭通常由3種物質聚合而成:纖維素、半纖維素和木質素,其中纖維素約占木頭重量的45%,半纖維素約占25%(Geibetal.,2010)。纖維素完全降解需要3種酶的共同作用,即:內切-β-1,4-葡聚糖酶(endo-β-1,4-glucanase,EG;EC.3.2.1.4),外切-β-1,4-纖維二糖水解酶(exo-β-1,4-cellobiohydrolase,CBH;EC.3.2.1.91)和β-葡萄糖苷酶(β-glucosidase,EC.3.2.1.21)(Clarke,1997)。木聚糖酶(xylanases)則是水解半纖維素的主要消化酶,其底物是復合物,包括木聚糖、木葡聚糖、阿拉伯半乳聚糖、半乳葡甘露聚糖和葡甘露聚糖等(Shallom &Shoham,2003)。木聚糖是植物細胞中的主要結構多糖,也是構成半纖維素的主要成分。目前已有一些對蛀干害蟲消化酶研究的報道,Jiangetal.(1996)比較了3種不同亞科天牛的纖維素酶的活性。Huang and Wang(2008)研究了黃粉蟲Tenebriomolitor的纖維素酶并探究了纖維素酶的最適反應條件。Duanetal.(2009)分別比較研究了中國圓田螺Cipangopaludinachinensis和松墨天牛Monochamusalternatus體內纖維素酶系。Geibetal.(2009)發現光肩星天牛Anoplophoraglabripennis幼蟲取食最喜食寄主糖槭Acersaccharum、第二喜食寄主針櫟Quercuspalustris后,消化道內纖維素酶系的3種酶顯著高于取食不喜食寄主豆梨Pyruscalleryana和人工飼料的幼蟲。Shietal.(2011)對植食性昆蟲蝗蟲Acrididaesp.、食葉昆蟲桑蠶Bombyxmori和蛀干昆蟲天牛的消化酶進行比較,發現蝗蟲和天牛的纖維素酶和木聚糖酶活性整體都顯著高于桑蠶。當分別用以麥麩和橡樹木屑為底物的飼料飼喂Morimusfunereus,取食前者的幼蟲纖維素酶高于后者(Dojnovetal.,2013)。Oppertetal.(2010)比較研究了昆蟲綱8個目68個種的昆蟲纖維素酶活性,其中涉及到7個科10種鞘翅目昆蟲,是目前為止涵蓋類群最廣和種類最多的纖維素酶的比較研究。
目前,對昆蟲適應寄主的解毒和消化機制的研究主要集中在食葉害蟲上,對于蛀干害蟲還知之甚少。本文以小線角木蠹蛾為研究對象,將幼蟲從初始寄主銀杏分別轉移到3種喜食樹種和4種普通寄主上,通過測定分析幼蟲解毒消化酶活性的差異以及寄主的次生代謝物質和營養物質含量,探究其與寄主適應性的關聯性,為闡明小線角木蠹蛾對寄主的適應機理提供生理學依據。
1 材料與方法
1.1 供試昆蟲
小線角木蠹蛾幼蟲采自北京市海淀區北清路(40°05′N,116°16′E)的銀杏行道樹體內,將伐砍的受害銀杏木段帶回實驗室中,剖出10齡幼蟲,選擇體長相同、體型一致的小線角木蠹蛾幼蟲待接種。
1.2 接種方法
選用洋白蠟、國槐、銀杏、旱柳、欒樹、香椿、毛桃7種寄主樹種,其中洋白蠟、國槐和銀杏是小線角木蠹蛾的喜食樹種,其余4種是據文獻記載曾被危害過的普通寄主樹種(Yangetal.,2014)。實驗所用寄主樹種的選取均基于之前的研究(Zhang &Meng,2001;Bai,2012;Yangetal.,2014)、野外調查和幼蟲在實驗室飼喂過程中的表現。喜食寄主受小線角木蠹蛾幼蟲危害嚴重,受害地區更加廣泛,在實驗室內飼喂時幼蟲的取食量和排糞量大;而普通寄主僅在個別地區發現受到危害,在實驗室飼喂幼蟲時,取食量和排糞量明顯較少。所有樹種的樹枝均采自北京林業大學校園內(116°35′N,40°02′E),取粗細一致約4 cm(20~30年樹齡)的枝干,用自來水沖洗干凈,室溫下晾干。將枝段鋸成長6 cm的小段,每個樹種準備10段作為接種木段,木段兩端用石蠟封住,防止水分散失。隨后在木段上挖多個小洞穴(直徑6 mm/深30 mm),每個樹種用毛筆接種70頭幼蟲到洞穴中。最后把木段分別放入塑料盒中(直徑10 cm/高9 cm),盒蓋上扎孔透氣。每天檢查木段,如發現幼蟲跑出洞穴則再次放入,共喂養15 d。
1.3 寄主植物次生代謝物質和營養物質的測定
將寄主木段用去離子水清洗干凈后,放置于60℃的烘箱(DHG-9140A,一恒,上海)中72 h直至干燥。將徹底干燥的木段去除樹皮并劈成小塊,用YF-150B研磨機(永利,瑞安)研磨成細粉,并過40目篩。將研磨后的木頭粉末儲存在-20℃的冰箱中備用。
1.3.1次生代謝物質含量的測定
用Folin-Ciocalteu法(Singleton&Rossi,1965)測定木頭粉末樣品中總酚的含量。將粉末樣品(0.25 g)在20 mL 80%乙醇中萃取16~18 h。萃取完成后,將100 μL萃取液和2.5 mL 1 ∶10稀釋的Folin-Ciocalteu試劑加入到50 mL容量瓶中,靜置4 min,然后加入2 mL 7.5%碳酸鈉溶液,輕輕混合搖勻。將反應體系溶液在室溫下放置2 h,然后使用TU-1810紫外分光光度計(普析,北京)在760 nm處測定溶液的吸光度值。在反應體系中加入溶劑作為空白對照。以沒食子酸在反應體系中的濃度作為橫坐標,吸光度值作為縱坐標,制作標準曲線。
用氯化鋁比色法測定寄主粉末中的類黃酮含量(Zivcaketal.,2017)。將0.25 g粉末樣品用20 mL 80%乙醇萃取16~18 h,然后向0.5 mL萃取液中依次加入1.5 mL 95%乙醇、0.1 mL 1 M乙酸鉀、0.1 mL 10% 氯化鋁和2.8 mL蒸餾水,將混合溶液在室溫下靜置30 min,然后使用紫外分光光度計在415 nm處測定溶液的吸光度值。用等體積的蒸餾水代替10%氯化鋁作為空白對照。以槲皮素在反應體系中的濃度作為橫坐標,吸光度值作為縱坐標,繪制標準曲線。
用美國分析化學家協會(AOAC)的方法測定寄主樣品中的單寧含量。將1 g的木頭粉末樣品加入到100 mL容量瓶中,隨后加入20 mL 70%乙醇并混合均勻,將混合溶液在90℃水浴狀態下回流15 min。溶液冷卻至室溫并過濾,把殘余物用70%乙醇萃取3次,并合并濾液。將濾液轉移至100 mL的容量瓶中。然后把2 mL的濾液與10 mL 10%碳酸鈉在50 mL的容量瓶中混合,加入25 mL水和2.5 mL Folin-Denis試劑,混合搖勻,在室溫下靜置1.5 h。最后,使用紫外分光光度計在680 nm處測定溶液的吸光度值。以單寧酸在反應體系中的濃度作為橫坐標,吸光度值作為縱坐標,繪制標準曲線。
1.3.2營養物質含量的測定
使用硝酸-乙醇法測定寄主木頭粉末中的纖維素含量(Siddhantaetal.,2009)。將1 g木頭粉末和25 mL硝酸-乙醇(硝酸:乙醇=1 ∶4)加入250 mL錐形瓶中混合,并在沸水浴中加熱60 min。隨后倒出硝酸-乙醇溶液,再加入25 mL新鮮的硝酸-乙醇溶液,再次將樣品在沸水浴中加熱60 min,該過程重復3次。上述步驟完成后,用10 mL硝酸-乙醇溶液洗滌錐形瓶中的樣品,然后用100℃的蒸餾水洗滌。最后,將樣品用10 mL乙醇溶液洗滌錐形瓶并在105℃下干燥。錐形瓶中的剩余殘留物即為纖維素。
使用DNS比色法定量測定寄主樣品中的半纖維素含量(Huetal.,2008)。將1.5 g的木頭粉末和50 mL的2 M鹽酸加入燒杯中混合,隨后把燒杯100℃水浴1 h。過濾上清液,用去離子水洗滌殘余物,將洗滌液體與第一次過濾的上清液合并。把濾液定容至1000 mL,加入1 mL 0.5 M氫氧化鈉中和,然后與1.5 mL DNS試劑混合均勻。將混合溶液煮沸5 min,然后在冰水浴中冷卻。最后,將5 mL去離子水加入煮沸的溶液中并靜置24 h。使用TU-1810紫外分光光度計在540 nm處測定溶液的吸光度值。使用葡萄糖作為還原糖繪制標準曲線。
1.4 幼蟲消化酶和解毒酶活性測定
1.4.1粗酶液的制備
冰浴下解剖小線角木蠹蛾幼蟲,取出腸道,用冰冷的pH7.2,0.1 M PBS緩沖液沖洗腸道后,立即放入滅菌離心管中,加入適量的PBS緩沖液稀釋,冰水浴中勻漿2 min破碎消化道組織,勻漿液于8 000 g,4℃離心10 min,上清液即為粗酶液,分裝后置于-20℃冰箱中保存備用。
1.4.2解毒酶活性測定
昆蟲細胞色素P450酶的主要成分為血紅素,因此酶液提取物中的P450酶活性將通過測定血紅素過氧化物酶的活性來定量(Penillaetal.,2007)。將20 μL粗酶提取物轉移到含有200 μL 6.3 mM 3,4,5-四甲氧基苯乙烯(TMBZ)溶液的微量培養板的孔中[10 mg TMBZ溶于5 mL無水甲醇中,與15 mL pH5.0 0.25 M乙酸鈉緩沖液混合]。然后,向每個孔中加入80 μL pH7.2 0.0625 M磷酸鉀緩沖液和25 μL 3%過氧化氫溶液。為每一塊板制備兩個對照孔,孔內含有相同的溶液,僅用20 μL磷酸鉀緩沖液代替酶液,將微量板在25℃條件下溫育30 min。最后使用SpectraMax 190酶標儀在630 nm處測定吸光度值。用不同濃度的馬心臟VI型細胞色素C(0.0025-0.02 nM,Sigma Aldrich)繪制血紅素過氧化物酶的標準曲線。
采用Habigetal.(1974)的方法測定酶液中GST酶的活性。將150 μL 50 mM還原型谷胱甘肽(GSH)和50 μL 50 mM 1-氯-2,4-二硝基苯(CDNB)加入到2.78 mL 100 mM pH6.5磷酸鈉緩沖液中。然后,在混合液中加入20 μL粗酶提取液,輕輕混勻液體,然后在20℃溫育3 min。將不含酶提取物的3 mL反應混合溶液作為對照組。使用動力學(時間掃描)算法,用紫外分光光度計在340 nm處,每隔10 s讀取1次,反應時間10~12 min,測定樣品的吸光度值。根據CDNB-谷胱甘肽的消光系數9.6 mmol/cm計算酶活性。
根據Van Asperen(1962)的方法測定粗酶提取物中的CarE酶活性。將0.1 mL粗酶提取液(對照組用PBS溶液)和2 mL 3×10-4mM α-NA—毒扁豆堿(1 ∶1)丙酮溶液混合均勻,并在35℃水浴10 min。隨后加入1 mL顯色試劑(1%固藍B鹽+5%SDS;體積比為2 ∶5)終止反應,并使用紫外分光光度計在600 nm下測定吸光度值。使用不同濃度的α-萘酚溶液繪制標準曲線。基于標準曲線計算粗酶液反應體系中產生的α-萘酚量。
1.4.3消化酶活性測定
粗酶液中各纖維素酶組分活性采用Geibetal.(2009)的方法測定。CBH以1%微晶纖維素(MC)為底物,EG酶以1%羧甲基纖維素(CMC)為底物,β-葡萄糖苷酶以1%水楊苷(salicin)為底物進行測定。用稀釋后的100 μL粗酶液與200 μL 1%底物充分混合,37℃條件下水浴30 min,隨后加入300 μL DNS溶液,對照組此時加入底物,混勻后立即沸水浴5 min,室溫冷卻后進行離心,混合液5倍稀釋后用紫外分光光度計于540 nm測定吸光值。用不同濃度梯度的葡萄糖溶液繪制標準曲線,計算各纖維素酶組分的活性。
木聚糖酶活性采用DNS比色法進行測定,取2.00 mL經過適當稀釋的酶液,在37℃下水浴10 min,再加入2.0 mL 100 mg/mL的木聚糖溶液37℃水浴30 min,隨后加入5 mL DNS試劑混合均勻以終止酶反應,對照組此時加入木聚糖溶液,沸水浴加熱5 min后冷卻至室溫,加水定容至25 mL,在540 nm處測定吸光值。用不同濃度梯度的木糖溶液繪制標準曲線,計算木聚糖酶的活性。
1.5 數據分析
實驗數據均用平均值±標準誤表示,原始數據用SPSS 22.0軟件進行單因素方差分析,若存在顯著差異,則用Turkey法進行多重比較,顯著水平為P<0.05。喜食寄主和普通寄主的次生代謝物和營養物質之間的群組差異,以及分別取食這兩組寄主的幼蟲酶活性之間的群組差異均使用t檢驗進行比較。
2 結果與分析
2.1 不同寄主植物次生代謝物質含量
普通寄主樹種中的總酚含量顯著高于喜食寄主(t-test=11.221,P<0.0001)。在喜食寄主中,國槐的總酚含量最高,其次是銀杏和洋白蠟。在普通的寄主樹種中,毛桃的總酚含量顯著高于其他樹種,并且其他3種樹的總酚含量沒有顯著差異。由圖1A可知,7個寄主樹種中的總酚含量存在顯著差異[df=6,56,F=353.620,P<0.0001]。
普通寄主樹種的類黃酮平均含量是喜食寄主平均類黃酮含量的約7倍(t=5.126,P<0.0001)。3種喜食寄主樹中類黃酮的含量之間無顯著差異,在普通寄主樹種中,毛桃的類黃酮含量顯著高于香椿,其次是欒樹和旱柳,由圖1B可知,在7種寄主中,類黃酮的含量存在顯著差異(df=6,56,F=447.110,P<0.0001)。
普通寄主樹種的單寧含量顯著高于喜食寄主樹種(t=2.403,P=0.027)。在普通寄主中,毛桃的單寧含量最高,其次是香椿、欒樹和旱柳。在喜食寄主中,國槐的單寧含量低于銀杏和洋白蠟,銀杏和洋白蠟的單寧含量高于旱柳,7種寄主樹種的單寧含量之間存在顯著差異(df=6,56,F=402.103,P<0.0001)(圖1 C)。
2.2 不同寄主營養物質含量
喜食寄主和普通寄主的纖維素含量沒有顯著差異(t=1.188,P=0.253),但是7種寄主樹種的纖維素含量仍然存在顯著差異(df=6,56,F=13.922,P<0.0001)(圖2 A),其中香椿的纖維素含量最高,其次是旱柳,國槐、銀杏、欒樹、洋白蠟和毛桃的纖維素含量之間沒有顯著差異。
喜食寄主和普通寄主的半纖維素含量無顯著差異(t=1.342,P=0.196),7個寄主樹種之間的纖維素含量也不存在顯著差異(df=6,56,F=2.222,P=0.102)(圖2 B)。
2.3 幼蟲蛋白濃度
分別取食7種寄主樹種的小線角木蠹蛾幼蟲的蛋白濃度存在顯著差異(df=6,56,F=19.946,P<0.001)(圖3 A)。用洋白蠟飼喂的幼蟲蛋白濃度最高,取食欒樹、銀杏、國槐和毛桃的幼蟲蛋白濃度之間沒有顯著差異,飼喂香椿和旱柳的幼蟲蛋白濃度顯著低于飼喂洋白蠟、欒樹和銀杏的幼蟲。
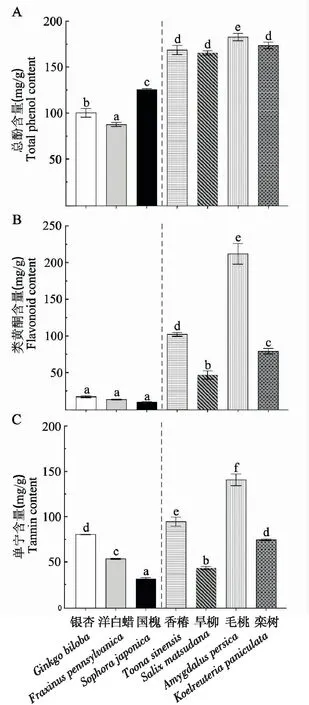
圖1 小線角木蠹蛾幼蟲7種寄主樹種的次生代謝物含量Fig.1 Secondary metabolite contents in seven hosts of Streltzoviella insularis larvae
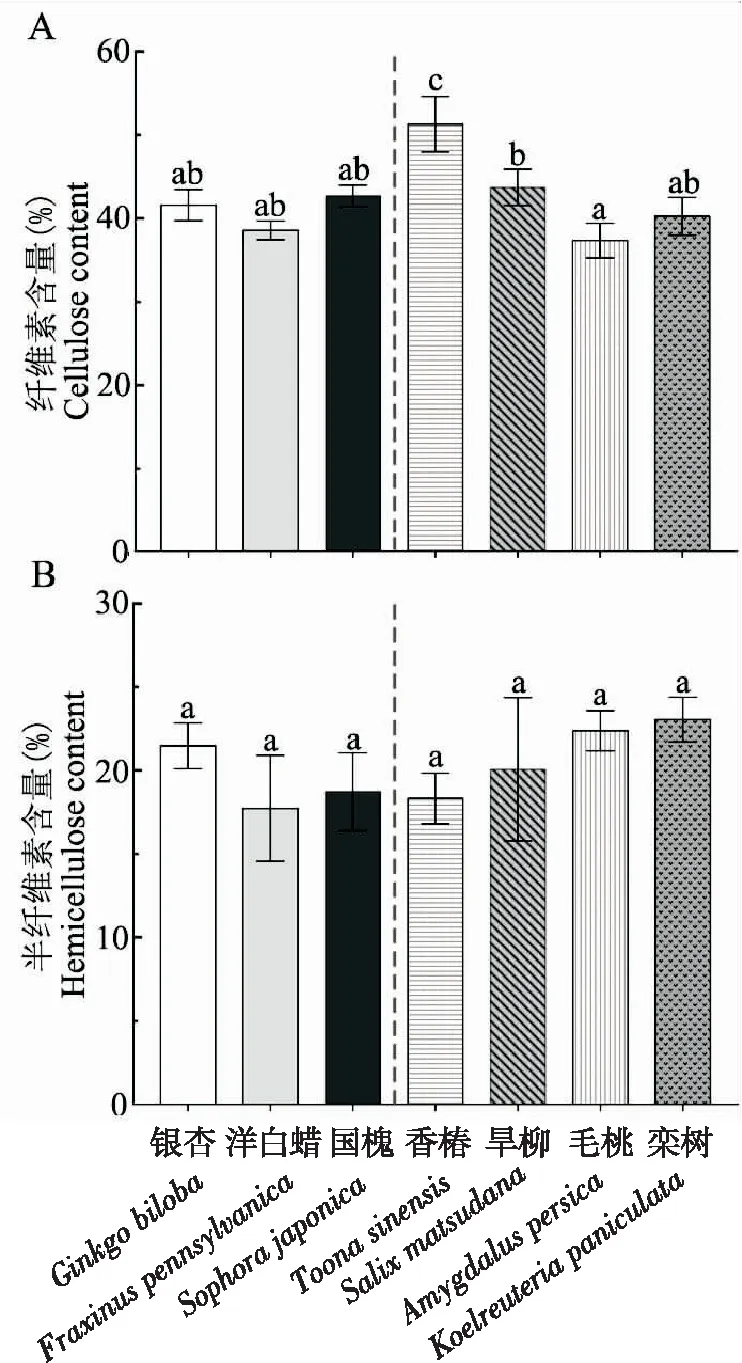
圖2 小線角木蠹蛾幼蟲7種寄主樹種的營養含量Fig.2 Nutrients in seven hosts of Streltzoviella insularis larvae
2.4 取食不同寄主幼蟲解毒酶活性比較
共解剖取食7種寄主的210頭小線角木蠹蛾幼蟲用于酶活性的測定,結果表明不同寄主對幼蟲消化道內3種解毒酶P450、GST和CarE活性均存在顯著影響。
飼喂普通寄主的小線角木蠹蛾幼蟲P450酶活性顯著高于飼喂喜食寄主的幼蟲(t= 4.351,P<0.0001)。取食不同的寄主樹種顯著影響小線角木蠹蛾幼蟲P450酶活性(df=6,56,F=88.771,P<0.0001)(圖3 B),飼喂香椿和旱柳的幼蟲P450酶活性較高,其次是取食毛桃、國槐和欒樹的幼蟲,飼喂銀杏和洋白蠟的幼蟲P450酶活性最低,且活性相近。
取食普通寄主樹種的幼蟲GST酶活性約是取食喜食寄主幼蟲的1.3倍(t=3.192,P=0.003)。飼喂不同樹種的幼蟲GST酶活性如圖3C所示(df=6,56,F=28.283,P<0.0001),取食香椿的幼蟲GST酶活性顯著高于取食其它寄主的幼蟲(圖3 C),取食旱酶柳、欒樹和國槐的幼蟲GST酶活性之間沒有顯著差異,用銀杏、洋白蠟和毛桃喂養的小線角木蠹蛾幼蟲具有最低的GST酶活性(圖3 C)。
用喜食寄主喂養的幼蟲CarE酶活性顯著低于取食普通寄主樹種的幼蟲(t=4.286,P<0.0001)。不同的寄主樹種顯著影響幼蟲的CarE酶活性(df=6,56,F=21.074,P<0.001)(圖3 D),飼喂香椿和旱柳的幼蟲CarE酶活性顯著較高,其次是欒樹和洋白蠟,用國槐、毛桃和銀杏喂養的幼蟲CarE酶活性低于用其他寄主樹種飼喂的幼蟲。

圖3 取食7種不同寄主的小線角木蠹蛾幼蟲蛋白濃度和3種解毒酶的活性Fig.3 Protein concentration and activities of three detoxification enzymes in Streltzoviella insularis larvae feeding on seven different host trees
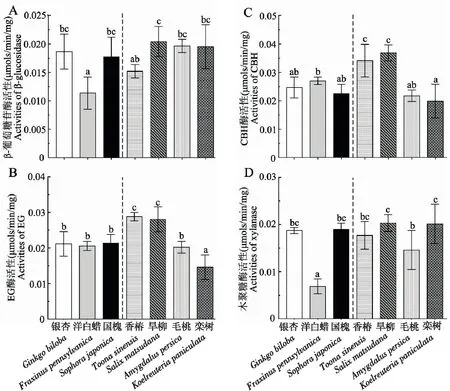
圖4 取食7種不同寄主的小線角木蠹蛾幼蟲消化酶的活性Fig.4 Digestive enzyme activities in Streltzoviella insularis larvae feeding on seven different host trees
2.5 取食不同寄主幼蟲消化酶活性比較
用不同寄主樹種飼養的小線角木蠹蛾的β-葡萄糖苷酶活性如圖4A所示(df=6,56,F=7.938,P<0.0001)。取食普通寄主的幼蟲β-葡糖苷酶活性顯著高于取食喜食寄主的幼蟲(t=2.389,P=0.022)。用旱柳飼喂的幼蟲β-葡萄糖苷酶活性最高,但與取食毛桃、欒樹、銀杏、國槐和香椿的幼蟲β-葡萄糖苷酶活性之間沒有顯著差異,取食洋白蠟的幼蟲β-葡萄糖苷酶活性最低,約是取食旱柳幼蟲的一半。
取食普通寄主與喜食寄主的幼蟲EG酶活性之間沒有顯著差異(t=1.310,P=0.200)。但是取食不同的寄主顯著影響幼蟲的EG酶活性(df=6,56,F=21.025,P<0.0001)(圖4 B),取食香椿和旱柳的幼蟲EG酶活性顯著高于取食其他寄主的幼蟲,用國槐、銀杏、洋白蠟和毛桃飼喂的幼蟲EG酶活性之間沒有顯著差異,用欒樹飼喂的幼蟲EG酶活性最低。
飼喂7種不同寄主樹種的幼蟲CBH酶活性如圖4C所示(df=6,56,F=16.642,P<0.0001)。取食普通寄主與喜食寄主的幼蟲CBH酶活性之間沒有顯著差異(t=1.769,P= 0.087)。用旱柳和香椿喂養的幼蟲CBH酶活性顯著高于取食其它寄主的幼蟲,其次是取食洋白蠟、銀杏、國槐和毛桃的幼蟲,用欒樹飼喂的幼蟲CBH酶活性最低。
飼喂普通寄主的幼蟲木聚糖酶活性略高于飼喂喜食寄主的幼蟲(t=2.056,P=0.049)。取食7種不同寄主樹種的幼蟲木聚糖酶活性存在顯著差異(df=6,56,F=18.652,P=0.003)(圖4D)。用旱柳飼喂的幼蟲中木聚糖酶活性最高,但與取食欒樹、國槐、銀杏、香椿和毛桃的幼蟲之間沒有顯著差異,取食洋白蠟的幼蟲木聚糖酶活性顯著低于取食其他寄主的幼蟲,僅僅約為取食旱柳幼蟲酶活的1/3。
3 結論與討論
大多數的植食性昆蟲都受寄主植物生理狀態和營養狀況的影響(Guoetal.,2010),同時,植物體內的次生代謝物質也會影響昆蟲的取食(Vogeletal.,2014)。昆蟲體內的酶系是昆蟲適應寄主植物生化機制的重要組成部分,當一些昆蟲取食的植物中含有大量具有殺蟲活性的植物次生代謝物質時(如酚類、單寧、煙堿、除蟲菊素類等),會誘導昆蟲體內的解毒代謝機制,提高昆蟲對寄主植物的適應能力;而昆蟲取食營養構成不同的寄主植物時,其體內的消化分解系統也會隨之產生變化,影響昆蟲對寄主植物的適應狀況。本研究用7種不同的寄主樹種飼喂小線角木蠹蛾幼蟲,并測定了其解毒酶和消化酶活性。將銀杏上的幼蟲人為轉接到其他寄主,目的在于研究其對不同寄主的適應機制,通過測定相關酶的活性來反應其適應的差異,而不涉及寄主選擇。研究結果表明,取食不同寄主的小線角木蠹蛾幼蟲的解毒酶和消化酶之間均存在顯著差異,取食普通寄主幼蟲中平均解毒酶活性(P450、GST和CarE)和平均消化酶活性(β-葡萄糖苷酶和木聚糖酶)顯著高于取食喜食寄主的幼蟲,其中普通寄主的平均次生代謝物含量較高(總酚、類黃酮和單寧)。因此,相比于喜食寄主,普通寄主(香椿、毛桃和欒樹)對幼蟲特定解毒酶的誘導性更強,但是取食普通寄主和喜食寄主的幼蟲消化酶差異并不明顯,整體而言,喜食寄主更有利于小線角木蠹蛾的取食。在野外調查中,小線角木蠹蛾對喜食寄主的危害也更加嚴重,而僅在局部地區的普通寄主上發現了小線角木蠹蛾,因此本研究結果與野外的調查一致。
3.1 解毒酶
昆蟲的解毒酶可以作用于一系列的植物次生代謝物質,其中P450、GST和CarE是害蟲體內重要的解毒酶系,它們在對外源化合物的解毒代謝和殺蟲劑的抗性機制中發揮了重要作用。P450是昆蟲體內功能最為多樣的一類解毒酶(Lietal.,2007 b)。在該研究中,取食普通寄主的幼蟲P450酶活性是取食喜食寄主的約1.33倍,該結果與之前的研究結果一致,取食飼喂胡蘿卜Daucuscarota(非喜食寄主)的南方灰翅夜蛾幼蟲Spodopteraeridania的P450酶活性高于取食利馬豆Phaseoluslunatus(喜食寄主)(Brattsten,1992)。飼喂兩種普通宿主的茶黃薊馬Scirtothripsdorsalis的P450酶活性也高于飼喂喜食寄主野茶樹Camelliaassamica(Dhiraj,2016)。本研究發現,從銀杏上轉移到旱柳和香椿的幼蟲P450酶活性分別是轉移到銀杏上幼蟲酶活性的1.712和1.606倍,該結果與其他報道一致,P450酶在適應不同寄主的過程中具有關鍵作用,P450酶可以代謝多種植物化感物質(Desprésetal.,2007;Alonetal.,2010;Schuler,2011;Lietal.,2007 b)。此外,P450酶的誘導還與昆蟲對寄主植物的攝食頻率有關(Zengetal.,2007)。
本研究結果表明,取食普通寄主的小線角木蠹蛾幼蟲GST酶活性高于取食喜食寄主的幼蟲。有研究發現日本金龜子Popilliajaponica僅少量取食普通寄主,其誘導GST酶活性高于取食喜食寄主的幼蟲(Adesanyaetal.,2016)。目前,已有很多關于在鱗翅目昆蟲和以落葉樹為食的昆蟲中,GST酶對植物內抗蟲化合物作用的研究。在鱗翅目昆蟲中,當取食非喜食寄主植物時GST酶活性會增加,而十字花科和傘形科植物對于鱗翅目昆蟲的GST酶誘導性最強(Yu,1996)。在桃蚜Myzuspersicae中,十字花科植物中含有硫代葡萄糖苷和異硫氰酸酯,可能是誘導昆蟲體內大量GST酶的原因(Francisetal.,2010)。本研究還發現,取食不同的寄主會顯著影響小線角木蠹蛾幼蟲的GST酶活性,這與光肩星天牛的研究結果一致,當用4種寄主分別飼喂光肩星天牛后,成蟲體內的GST酶活性差異達到了顯著水平(Yanetal.,2016),光肩星天牛幼蟲取食糖槭樹后,GST酶基因也發生了上調(Masonetal.,2016)。已有研究證實,楊樹體內的苯酚、香豆酸、丁香酸、水楊酸等次生物質會對光肩星天牛幼蟲的GST活性產生不同程度的影響,取食欒樹、柳樹、銀杏、洋白蠟、國槐的幼蟲GST酶活性之間均不存在顯著差異(Zhangetal.,2011)。Rigsbyetal.(2015)研究發現取食不同寄主的白蠟窄吉丁AgrilusplanipennisGST酶活性之間也沒有顯著差異,這可能與上述情況類似,該研究選用的3種寄主雖然分別是抗性物種和易感性物種,但所含的誘導GST酶的化合物種類或含量可能很相近,導致酶活性差異不顯著。目前GST酶被證實在抵御植物次生代謝物的過程中發揮了解毒作用(Lietal.,2007b),在昆蟲攝入次生代謝物后,GST酶可以保護細胞抵御有毒物質的侵害,同時它還在保護細胞被氧化和運輸內生性親脂化合物上具有不可替代的作用(Weinholdetal.,1990)。
CarE酶也是昆蟲體內的一種重要解毒酶,但目前關于其在寄主適應方面的研究還較為有限。本研究結果表明,取食喜食寄主的小線角木蠹蛾幼蟲CarE活性顯著低于取食普通寄主的幼蟲。用6種不同抗性的楊樹品種接種光肩星天牛幼蟲,發現其體內的CarE酶活性差異也非常大,且酶活性變化趨勢與楊樹品種的抗蟲性呈負相關(Lietal.,2007 a)。本研究還發現取食欒樹的幼蟲CarE酶活性顯著高于其他樹種,欒樹中含有豐富的沒食子酸鹽衍生物和氰脂類化合物(Yangetal.,1999)。目前已確定植物次生代謝物質糖苷蘆丁和吲哚生物堿可以分別誘導斜紋夜蛾Spodopteralitura和麥長管蚜的CarE酶進行代謝解毒(Ghumareetal.,1989;Caietal.,2009),楊樹中的苯甲酸、鄰苯二酚和兒茶酸能夠影響光肩星天牛幼蟲的CarE酶活性(Zhangetal.,2011)。CarE酶還能夠參與酶其他有毒物質如植物源殺蟲劑(擬除蟲菊酯)的代謝,也間接支持了CarE酶參與降解植物次生代謝物的假定(Usmani &Knowles,2001;Yangetal.,2005)。
3.2 消化酶
纖維素和半纖維素降解后釋放的碳水化合物是蛀干昆蟲的主要營養來源。在該研究中,取食不同寄主的小線角木蠹蛾幼蟲β-葡萄糖苷酶活性之間雖然差異較小,但仍存在顯著差異(P=0.022),并且取食喜食寄主和普通寄主的小線角木蠹蛾幼蟲EG酶和CBH酶活性之間沒有顯著差異。這一結果與Geibetal.(2009)的結果一致,該研究報道了光肩星天牛取食最喜食寄主(糖槭)和第二喜食寄主(針櫟)的EG和CBH酶活性之間沒有顯著差異,而取食第二喜食寄主(針櫟)的幼蟲β-葡萄糖苷酶活性顯著高于取食最喜食寄主(糖槭)的幼蟲。取食4種不同寄主的雄性和雌性光肩星天牛的酶活性之間也不存在顯著差異(Lietal.,2008)。在本研究中,喜食寄主和普通寄主中的纖維素和半纖維素含量沒有顯著差異,因此,無法確定纖維素含量是否影響幼蟲纖維素酶活性。
在昆蟲體內,纖維素水解成葡萄糖需要纖維素酶系EG酶、CBH酶和β-葡萄糖苷酶的協同作用下才能完成,其中EG酶水解纖維素鏈的內部β-1,4鍵,通常作用于非晶纖維素;CBH從纖維素的非還原端釋放纖維二糖,主要作用于結晶纖維素;而β-葡萄糖苷酶水解纖維二糖或更長的纖維素鏈以釋放葡萄糖,因此只能作用于寡糖,這三種酶都不能單獨分解纖維素(Ljungdahl &Eriksson,1985)。小線角木蠹蛾3種纖維素酶的平均活性的順序是CBH>EG>β-葡萄糖苷酶。Suoetal.(2004)測定了松墨天牛幼蟲的纖維素酶,結果表明CBH>EG>β-葡萄糖苷酶,這與本研究結果一致。然而,桑天牛Aprionagermari中3種纖維素酶的酶活性順序為:EG>β-葡萄糖苷酶>CBH(Yinetal.,1996)。它們的差異可能與其寄主體內的結晶纖維素比例有關,松樹(松墨天牛的主要寄主樹種)和小線角木蠹蛾寄主的結晶纖維素比例高于桑樹(桑天牛的主要寄主樹種),因此,這些昆蟲需要相對較高的CBH酶活性才能降解。在整個反應體系中,通過特定的底物可以測定某一種纖維素酶的活性,但無法消除其他纖維素酶產生的影響,因此本結果只能反應特定發揮關鍵作用的酶的活性。
在自然界中,木聚糖是木頭中含量最多的一類半纖維素。與纖維素相比,半纖維素具有更強的結構異質性,它以碳水化合物(主要為木糖)、糖酸和乙酰酯為線性聚合物的側基,這些側基阻止了半纖維素原纖維的填充,并使半纖維素為非結晶狀(van Rensburgetal.,2000)。本研究發現小線角木蠹蛾幼蟲木聚糖酶的活性與纖維素酶系非常接近,說明其對木聚糖的分解能力很強,也側面反映出木聚糖也是其重要的營養來源之一。喜食寄主中的半纖維素含量與普通寄主之間無顯著差異,但是,取食喜食寄主與取食普通寄主的幼蟲之間木聚糖酶活性存在顯著差異。其中雖然洋白蠟的半纖維素含量沒有明顯低于其他樹木,但取食洋白蠟的幼蟲木聚糖酶活性顯著低于取食其他寄主的幼蟲,因此洋白蠟中可能含有較多的其他半纖維素。半纖維素是一種成分混雜的底物(混合物),其水解需要多種不同的酶攻擊多糖或寡糖中的特定糖苷鍵來實現(Zverlovetal.,2003),這些側基可以防止半纖維素堆積或結晶(van Rensburgetal.,2000)。
目前,對于小線角木蠹蛾纖維素酶和木聚糖酶的來源還尚未明確。光肩星天牛和一些甲蟲的體內具有強大的酶庫,能夠自行分解纖維素、木聚糖和其他細胞壁多糖(McKennaetal.,2016),這些昆蟲中一些編碼消化酶(降解纖維素或半纖維素)的基因來源于細菌或真菌,從而豐富了體內的基因家族(Kirschetal.,2014)。雖然光肩星天牛腸道中的微生物并不直接分泌消化酶,但在昆蟲營養循環和營養物質生物合成的過程中,仍然起著至關重要的作用,它們可以幫助天牛在營養不良的條件下生存(Ayayeeetal.,2014;Scullyetal.,2014)。相比之下,一些白蟻Macrotermesbellicosus(以木材為食的昆蟲)缺少一些編碼類似EG酶或CBH酶功能的基因家族,共生體的基因組包含許多相同的基因家族,在它們體內這些功能由共生體提供(Ohtokoetal.,2000;McKennaetal.,2016)。此外,光肩星天牛還具有降解木聚糖的能力,其糖苷水解酶第5家族的一些基因參與合成光肩星天牛體內降解植物中主要半纖維素(木聚糖)的酶(McKennaetal.,2016)。Matoub &Rouland(1995)從白蟻體內純化出兩種木聚糖酶。咖啡漿果蛀蟲Hypothenemushampei的消化道也發現了木聚糖酶基因(Beatrizetal.,2012)。但是,纖維素酶和木聚糖酶在小線角木蠹蛾幼蟲消化道內的分布及來源還有待于進一步探究。

