秦巴山區魔芋白絹病病原菌的鑒定及生物學特性的測定
崔月貞,郝興順*,魏芳勤,張春輝,王曉娥,陳永剛,蒙天竣,李 旭
(1.陜西省漢中市農業科學研究所,陜西 漢中 723000;2.甘肅省慶陽市西峰區農業技術推廣中心,甘肅 慶陽 745000)
魔芋為多年生草本植物,因富含葡甘露聚糖,故其具有重要的藥用和保健功效,成為重要的經濟作物之一[1],在國內外市場潛力巨大,具有廣闊的開發應用前景[2]。隨著魔芋生產規模的擴大、企業數量的增加和產業鏈的延伸,魔芋產業成為云南、貴州和陜西等地農民脫貧致富奔小康和地方財政增收的骨干經濟項目[3-4]。
陜西省秦巴山區為我國最大的魔芋主產區域之一,而漢中位于秦巴腹地,該地海拔約500 m,屬亞熱帶濕潤季風性氣候,年降水量800~1000 mm,年均氣溫約14 ℃,土壤疏松肥沃,適宜魔芋半野生生活習性,是大力發展綠色、無公害魔芋產業的天然理想場所[5-6]。但是,近年來隨著秦巴山區魔芋種植面積的不斷擴大,重茬嚴重,導致土傳性病害嚴重發生,特別是魔芋白絹病持續加重,造成魔芋減產20%~40%[7],且一直呈上升趨勢,嚴重影響了病魔芋產量和經濟效益,成為制約秦巴山區魔芋生產發展和產業化開發的主要因素之一[8]。目前,關于湖北、云南和貴州等地區的魔芋白絹病原菌生物學特性、分類地位和藥劑防治等均有相關研究[9-10],而關于秦巴漢中魔芋白絹病的研究較少。因此,本研究擬對分離自秦巴漢中魔芋白絹病病原菌進行形態觀察及16 S rDNA序列鑒定,并對其進行生物學特性測定,以期為秦巴山區該病害的診斷和綜合防治提供依據。
1 材料與方法
1.1 供試材料
供試魔芋病樣于2018年采自陜西漢中種子魔芋種植區。供試培養基為馬鈴薯瓊脂培養基(PDA)。供試魔芋苗為盆栽條件下1年齡的繁育苗,品種為花魔芋(Amorphophalluskonjac)。
1.2 試驗方法
1.2.1 病原菌的分離與致病性測定 采用常規組織分離法,選取具有癥狀典型的新鮮魔芋標本,從病斑、病健交界處用刀片切取約0.5 cm2的病組織塊,75%乙醇消毒10 s,然后0.1%的升汞消毒1 min,再用無菌水清洗3次后置于平板上培養,對分離物進行純化培養和4 ℃保存備用。
致病性測定:采用致傷接種法,將魔芋種子播種于直徑25 cm的塑料花盆中,在溫度為20~30 ℃的室內培育植株至4葉時,選用健康長勢均勻的魔芋植株,用消毒后的昆蟲針在莖基部制造微傷口,將分離物在PDA培養基上培養5 d后打成直徑6 mm的菌餅接種于傷口處,以無菌平板培養基為對照,保濕48 h,室溫培養,3次重復,連續觀察魔芋植株發病情況并記錄數據。出現典型癥狀后對發病植株進行再分離,按照柯赫氏法則[11]確定病原菌。
1.2.2 病原菌的形態學和16 S rDNA-ITS序列分析鑒定 病原菌的形態學鑒定:將菌株接于PDA培養基上25 ℃培養10~15 d觀察菌絲和菌核,并在顯微鏡下拍照[12]。
16 S rDNA-ITS 序列分析:提取病原菌基因組DNA,將病原菌接種于PDA液體培養基,于27 ℃、180 r/min搖床振蕩培養5~6 d后收集菌絲,稱取0.1 g至研缽,加入0.3 mL 10%(w/v)的Chelex-100無菌溶液,充分研磨后,轉移至1.5 mL離心管,在旋渦混合器上振蕩5 s后沸水浴10 min ,冷卻至室溫后12000 r/min離心10 min,取上清液可作為PCR擴增模板,或-20 ℃保存備用。擴增引物為ITS1和ITS4,擴增條件為:95 ℃預變性5 min,95 ℃變性30 s,55 ℃退火30 s,72 ℃延伸8 min,30個循環;最后在72 ℃下延伸10 min,終止反應。50 μL擴增反應體系:2×Power Taq Mixture 25.0 μL,ITS1和ITS4(10 μmol/L)各2.0 μL,DNA模板 2.0 μL,ddH2O 19.0 μL,0.8%凝膠電泳檢測。將具有特異性條帶的擴增產物送至北京華大基因生物有限公司進行測序,將測序結果在GenBank數據庫中進行比對并構建系統發育樹,確定該病原菌的分類學地位。
1.2.3 生物學特性測定 將病原菌分別置于不同溫度、pH值、碳源和氮源條件下培養,測量菌落直徑,具體方法參考文獻[13]。
1.2.4 數據分析 采用Clustal X 1.8 和Mega 4.0 軟件構建系統發育樹,采用SPSS 19.0軟件進行數據分析,采用Excel 2010制圖。
2 結果與分析
2.1 田間癥狀
田間發病初期,魔芋莖基部出現水漬狀病斑,且呈不規則下陷,可在病斑周圍土壤中長出放射狀的白色菌絲,病斑漸漸呈淺褐色腐爛流水,后期深褐色組織逐漸軟腐下陷,引起植株倒苗死亡。
2.2 病原菌的分離及致病性測定
選取多個具有典型癥狀的病斑進行分離培養,共得到3株真菌分離物,依次編號為M1、M2和M3,對其進行致病性測定,用針刺接種法分別回接到健康魔芋植株上,5~6 d后,M3開始發病,癥狀與田間癥狀一致,對照無癥狀(圖1)。根據柯赫氏法則,從病斑處再次分離病原物并接種測定,確定菌株M3為魔芋白絹病致病菌,并對其進行后續研究。
2.3 病原菌的形態學鑒定
病原菌M3在PDA平板上25 ℃培養4 d后,菌落近圓形,初為白色放射狀菌絲發達,背面呈淡淺黃色,5 d后開始形成菌索,初為淺黃色,漸漸形成菜籽狀菌核,直徑為1.2~2.3 mm,顏色逐漸加深,至茶褐色,具有蘑菇氣味。電子顯微鏡下,菌絲具有隔膜,多在分支處(圖2)。
2.4 基于rDNA-ITS序列的系統發育學分析
提取病原菌M3的基因組DNA,經PCR擴增和測序,獲得rDNA-ITS序列為553 bp,所測序列在GenBank中進行同源序列比對,下載相似性99%以上的序列,經過多重序列比較后,構建了系統發育樹,菌株M3與羅耳阿太菌Atheliarolfsii(KY640625.1)序列相似性為100%,且發育樹聚在一起(圖3),結合形態學特征,進一步鑒定病原菌M3為羅耳阿太菌Atheliarolfsii。

圖1 魔芋白絹病癥狀及致病性測定
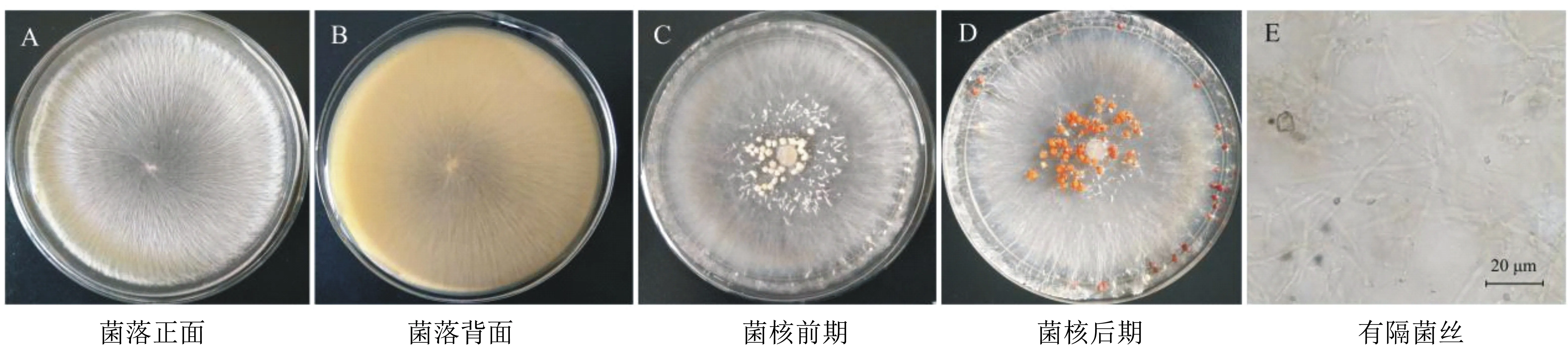
圖2 病原菌M3形態特征

圖3 病原菌M3系統發育樹
2.5 病原菌的生物學特性
2.5.1 不同溫度對病原菌菌絲生長的影響 病原菌M3的生長溫度為8~36 ℃,5~28 ℃時病原菌隨著溫度的升高,生長速度不斷加快,28 ℃時達到最大值,菌落平均直徑達8.49 cm,28 ℃以后菌落生長顯著下降(P<0.05)。由此可知,病原菌M3的最適生長溫度為26~28 ℃(圖4)。

圖4 溫度對菌株M3菌絲生長的影響
2.5.2 不同pH值對病原菌菌絲生長的影響 病原菌M3在pH值為4~11的培養基上均可生長,菌落直徑在pH=7時最大,其次為pH=8,菌落直徑分別為7.65 cm和7.51 cm,顯著大于其他pH值的培養基(圖5)。
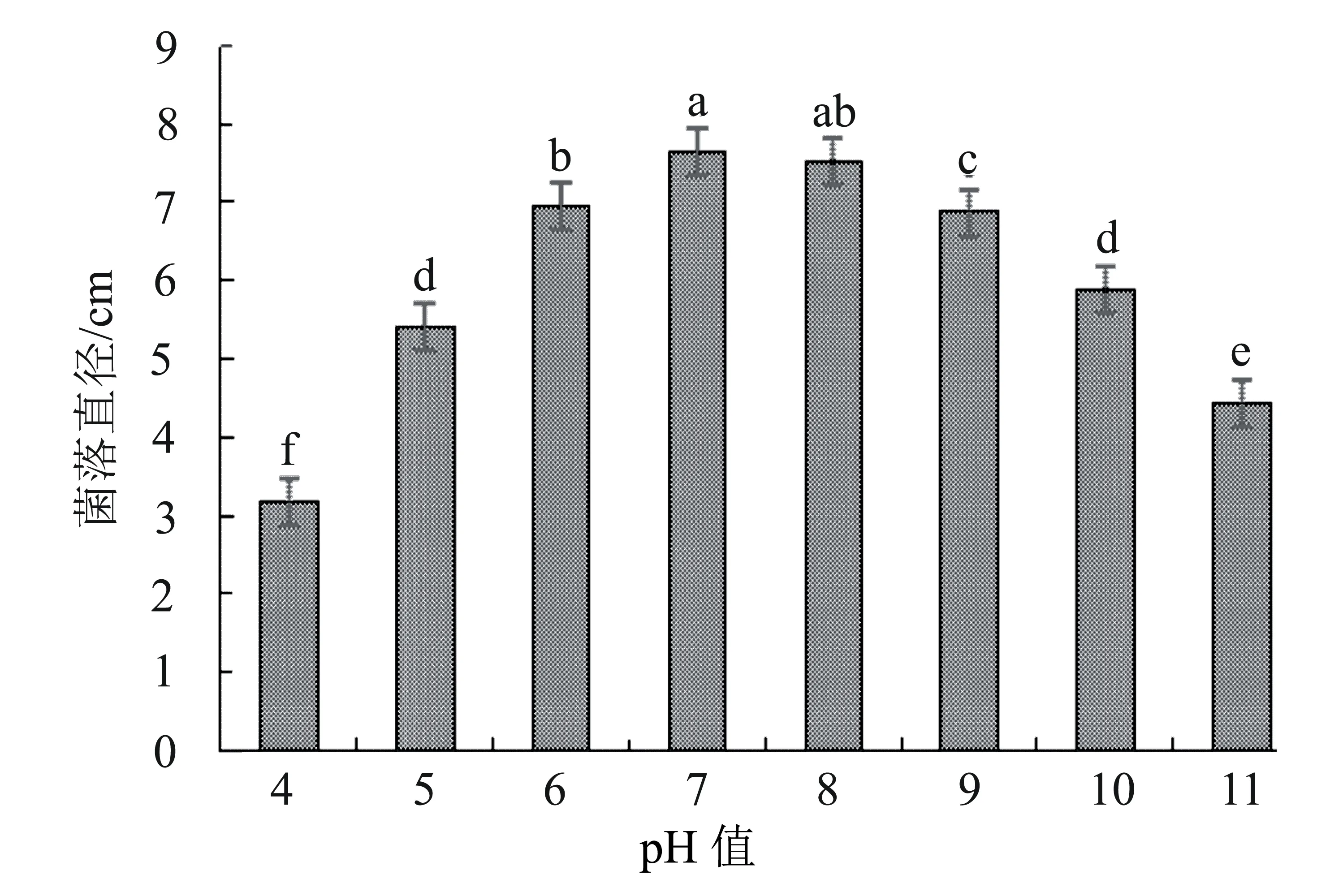
圖5 不同pH值對菌株M3菌絲生長的影響
2.5.3 不同碳源對病原菌菌絲生長的影響 病原菌M3的最適碳源為麥芽糖,菌落生長速度最快,直徑達8.28 cm,顯著大于其他處理;其次為麥芽糖和蔗糖,菌落直徑分別為7.33 cm和7.24 cm,兩者之間差異不顯著(P>0.05);其他碳源對病原菌生長影響的順序為果糖>糊精>可溶性淀粉>乳糖,其中果糖和糊精之間差異不顯著(P>0.05)(圖6)。
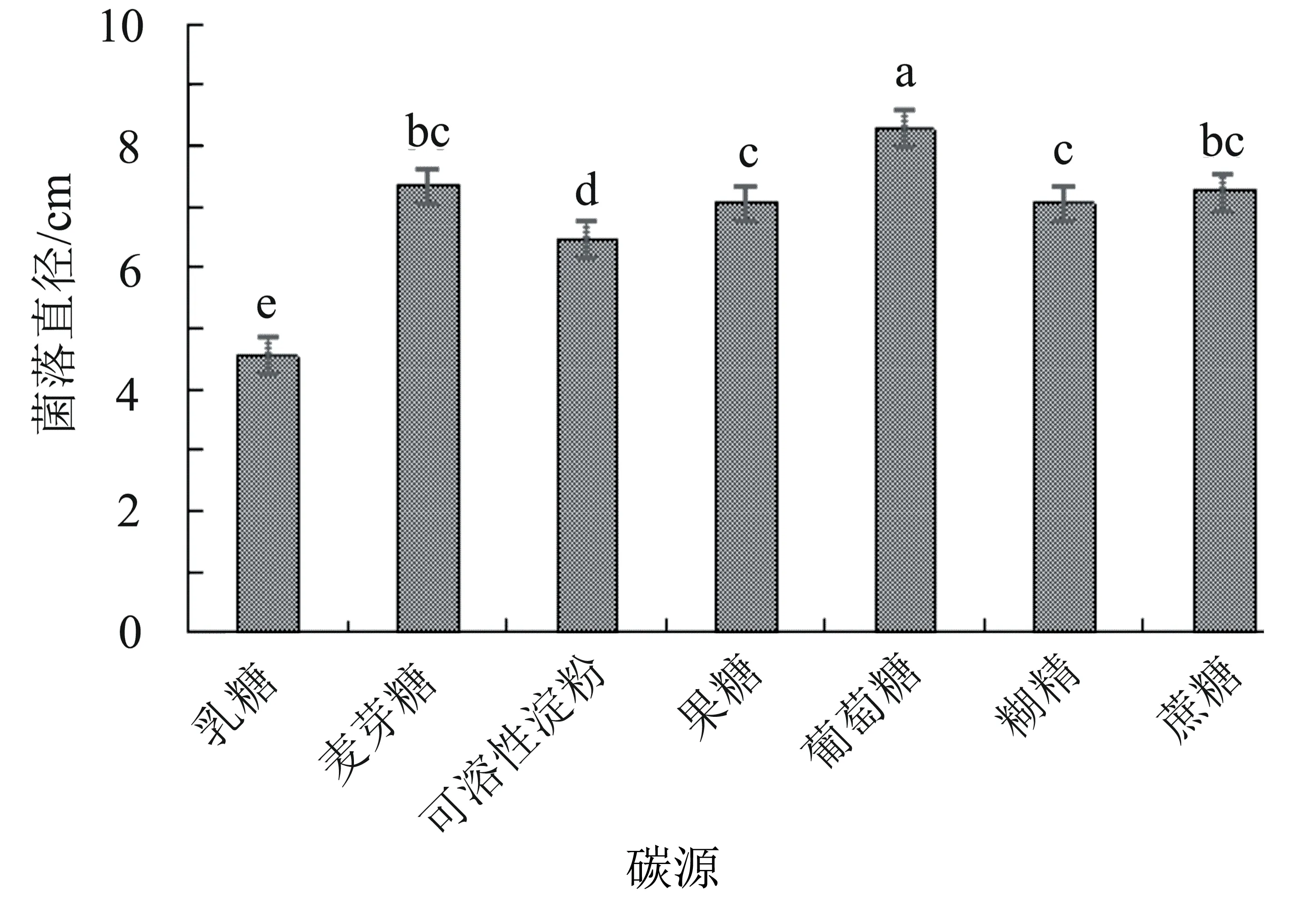
圖6 碳源對菌株M3菌絲生長的影響
2.5.4 不同氮源對病原菌菌絲生長的影響 病原菌M3的最適氮源為酵母粉,菌落直徑達7.09 cm,顯著大于其他處理(P<0.05);其次為蛋白胨和硫酸銨,菌落直徑分別為5.85 cm和5.81 cm,兩者之間差異不顯著;其他碳源對菌落生長影響的順序為牛肉膏>硝酸鉀>硝酸銨,其中牛肉汁和硝酸鉀之間差異不顯著(圖7)。
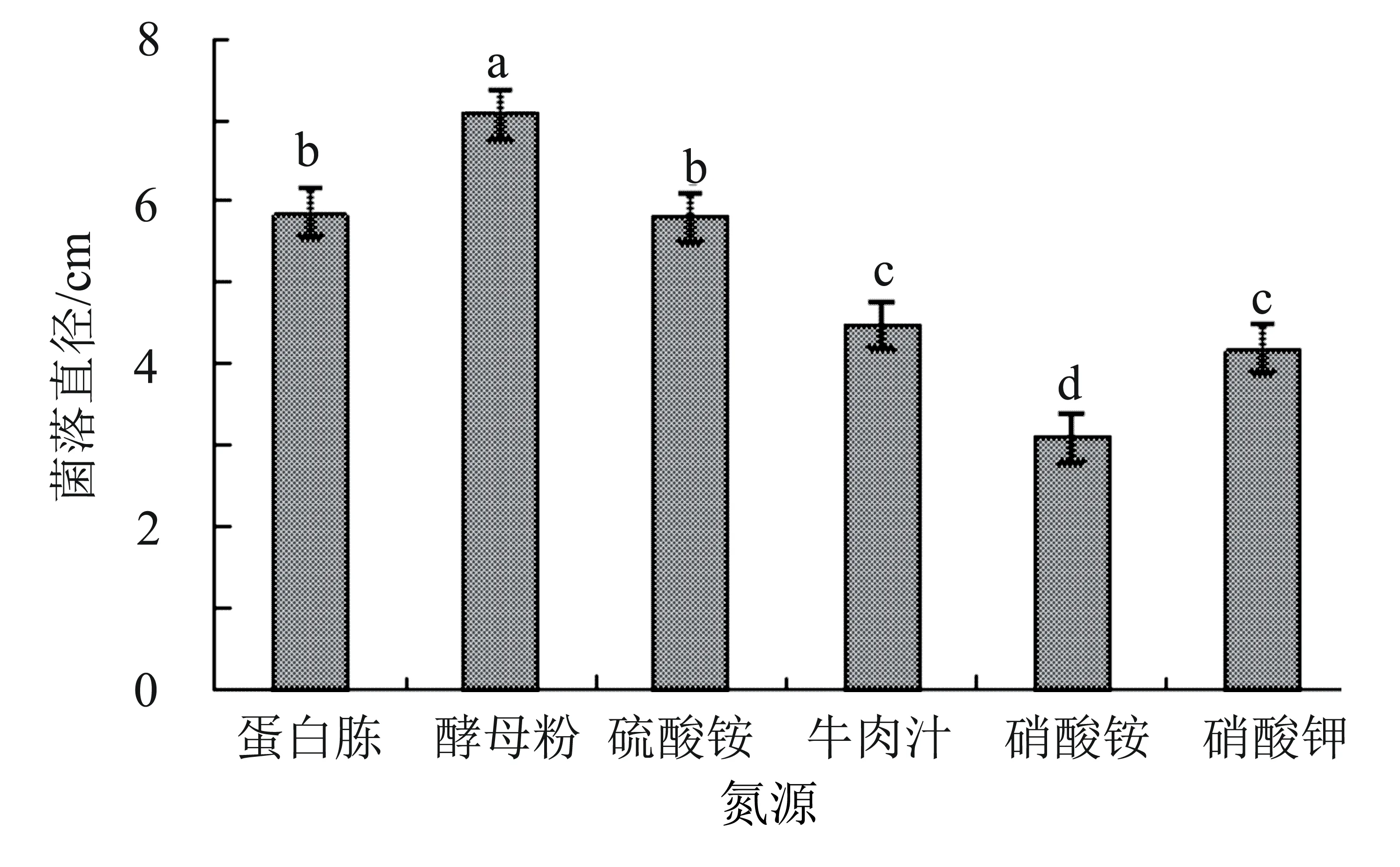
圖7 氮源對菌株M3菌絲生長的影響
3 討論
在植物病原菌分類和鑒定應用中,傳統鑒定方法與基因組DNA序列分析的結合,可極大提高植物病原物種類鑒定的準確性[14],因此本研究結合形態學觀察和16 S rDNA-ITS序列分析,將菌株M3鑒定為羅耳阿太菌Atheliarolfsii,屬于半知菌亞門,其無性態為齊整小核菌Sclerotiumrolfsii[15],與胡紅杏[16]、李利軍[17]等的研究結果一致,這表明云南、湖北和陜西等地分離獲得的病原菌為同一分類地位的菌株,暫時還未發現新的生理小種,但多位學者分離獲得的均為無性態Atheliarolfsii、為何不易分離到有性態齊整小核菌,原因還有待進一步探究。
本研究發現,白絹病病原菌最適生長pH值為7,碳源利用以麥芽糖最好、乳糖最差,氮源利用以酵母粉最好、硝酸銨最差,這與已報道的湖北該菌最適pH值為4~5,最適碳源為可溶性淀粉,最適氮源為硝酸銨的結果[16]不一致,這可能與地域差異或菌株自身適應性有關,但具體原因還有待一步分析。陜西安康白絹病病原菌最適生長溫度為30 ℃,最佳pH值為7[17],這與本研究結果基本一致,原因可能在于安康和漢中同為秦巴山區病原菌生物學特性相似。
嚴凱[18]和廖文月[19]等選用傳統化學農藥代森錳鋅、氯溴異氰尿酸和甲基硫茵靈等對魔芋白絹病進行了防效試驗,但近年來農業部大力推進化肥農藥雙減,積極探索資源節約、環境友好的現代農業發展之路[20],而現代生物農藥即微生物農藥、植物源農藥、抗生素類農藥和農藥增效劑成為必然選擇,因此,下一步有必要對魔芋白絹病進行現代生物農藥的篩選應用。
4 結論
本文通過形態學鑒定和16 S rDNA-ITS序列分析鑒定,菌株M3為半知菌亞門羅耳阿太菌Atheliarolfsii,科學準確地鑒定了秦巴山區魔芋白絹病病原菌的分離地位。并明確了菌株M3的最適生長溫度為28 ℃、最適pH值為8、最適碳源為麥芽糖、最適氮源為酵母粉等生物學特性,這為該病害的綠色防控和綜合治理提供了科學依據。

