蝙蝠葛諾林堿對原代培養大鼠皮層神經元氧糖剝奪損傷的保護作用*
倪嵐,徐旭林,呂青,郭蓮軍
(華中科技大學同濟醫學院基礎醫學院藥理學系, 武漢 430030)
蝙蝠葛(Menispermum dauricum,DC),又名北豆根,為防己科藥用植物蝙蝠葛的藤莖,廣泛分布在我國東北、華北、華東等地。DC在我國很早就被用于治療心腦血管疾病。現代藥理學研究顯示,從DC根莖提取的有效成分如蝙蝠葛酚性堿、蝙蝠葛蘇林堿等具有抑制L型鈣通道、抗血小板聚集[1]、降壓、抗心律失常和抗腦缺血等作用[2]。蝙蝠葛諾林堿(Daurinoline)是一種從蝙蝠葛根莖中分離提取的單體物質,前期研究發現,蝙蝠葛諾林堿對家兔頸內動脈及基底動脈平滑肌具有明顯的舒張作用[3-4],對小鼠軟腦膜微循環障礙亦有良好的改善[5]。然而,蝙蝠葛諾林堿對神經細胞缺血再灌損傷是否具有保護作用,筆者尚未見文獻報道。因此筆者設計本實驗,采用原代培養大鼠皮層神經元,通過氧糖剝奪(oxygen and glucose deprivation,OGD)再灌注的方法來模擬腦缺血再灌損傷,觀察缺血再灌后蝙蝠葛諾林堿對大鼠皮層神經元的保護作用。并進一步觀察細胞內活性氧(reactive oxygen species,ROS)、線粒體膜電位(mitoehondrial membrane potential,MMP)的改變來探討其作用機制,為其臨床應用提供實驗依據。
1 材料與方法
1.1實驗動物 1~3 d齡的Sprague & Dawley(SD)乳鼠,清潔級,合格證號:00020736,華中科技大學同濟醫學院實驗動物中心提供,許可證號:SCXK(鄂)20150007。動物房自然采光,室溫(25±1) ℃,相對濕度(50±10)%。
1.2實驗藥物 蝙蝠葛諾林堿(淡黃色粉末,純度>95%,同濟醫學院藥理學系提供)臨用前用稀鹽酸配成0.1,1,10 μg·mL-1的濃度,過濾除菌,于4 ℃避光保存,備用;連二亞硫酸鈉(批號:07032)購自南京化學試劑一廠;細胞培養所需試劑胎牛血清(批號:1587602)購自Gibco公司,-20 ℃保存;NeurobasalTMMedium(批號:1551304)、B27(批號:1769984)均購自Gibco公司;胰酶(trypsin,批號:J150009)購自HyClone公司,L-多聚賴氨酸(P1399),阿糖胞苷(批號:w10562)均購自Sigma公司;其余試劑均為國產市售分析純。MTT檢測試劑盒(批號:C0009)、ROS檢測試劑盒(批號:S0033)和線粒體膜電位試劑盒(批號:C2006)均購自碧云天有限公司(江蘇,中國)。流式用磷酸鹽緩沖液(10XPBS,g·L-1:NaCl 80.0,KCl 2.0,Na2HPO4·12H2O 36.3,KH2PO42.4,pH值7.2-7.4),用前稀釋至1倍使用。
1.3實驗儀器 311型二氧化碳(CO2)培養箱(美國Thermo公司);SW-CJ-2FD型超凈工作臺(蘇凈集團蘇州安泰空氣技術有限公司);IX-71型倒置相差顯微照相系統(OLYMPUS公司);ELX8全自動酶標儀(德國Biotek儀器公司)。
1.4方法
1.4.1大鼠皮層神經元原代培養 取1~3 d齡的SD乳鼠,75%乙醇消毒后,斷頭并迅速剝離出全腦,取腦后仔細分離出大腦皮層,用D-Hanks液清洗后剪成組織塊約1 mm3,加入等體積0.25%胰蛋白酶37 ℃消化15 min。DMEM/F12培養液(含10%胎牛血清,100 μg·mL-1青霉素,100 μg·mL-1鏈霉素)終止消化后將組織塊吹打成細胞懸液,200目不銹鋼篩選網過濾,2000×g離心10 min,棄上清液,在細胞沉淀中加入DMEM/F12培養液,重懸細胞,通過顯微鏡觀察,計數板計數,調整細胞密度至5×105·mL-1,接種在預先用0.1%多聚賴氨酸處理的培養板或培養皿內,置CO2培養箱內培養。24 h后換液成Neurobasal培養液(含10% B27,100 μg·mL-1青霉素,100 μg·mL-1鏈霉素),第3天加入阿糖胞苷(20 μmol·L-1)作用24 h抑制神經膠質細胞生長。以后隔天換液,直到相關實驗結束[6]。
1.4.2OGD模型制備與實驗分組 取培養8 d的皮層神經元,利用拆信封法隨機分為正常對照組;模型對照組;蝙蝠葛諾林堿(0.1,1,10 μg·mL-1)預處理組,每組 6孔(n=6),重復3次。蝙蝠葛諾林堿在OGD前24 h給予。上述各組孵育24 h后,正常組加入200 μL含糖的Earle’s液,模型對照組和給藥組加入2 mmol· L-1連二亞硫酸鈉的無糖Earle’s液,于CO2培養箱內(37 ℃,5% CO2,95% O2)孵育4 h后進行細胞活性檢測[7-8]。
1.4.3噻唑藍(MTT)測定細胞存活率 OGD結束后,向接種細胞的96孔板中加入MTT(5 g·L-1,每孔200 μL),培養箱(37 ℃,5%CO2,95%O2)孵育4 h。孵育結束后將上清液去除,每孔加入二甲基亞砜(DMSO)150 μL,氣浴震蕩儀震蕩10 min使深藍色甲臜充分溶解,用全自動酶標儀測定各孔在570 nm處的吸光度(A)值。細胞存活率=(測定組A570-測定空白A570)/(正常組A570-測定空白A570)×100%。
1.4.4細胞內ROS測定 應用二氯二氫熒光素二乙酯(2,7’-dichlorofluorescin diacetate,DCFH-DA)熒光探針進行細胞內ROS的檢測。DCFH-DA本身沒有熒光,可以自由穿過細胞膜進入細胞,被細胞內的脂酶水解生成DCFH。而DCFH不能通透細胞膜,進而使探針負載于細胞內。細胞內ROS氧化無熒光的DCFH生成有熒光的DCF。DCF的熒光可用于反應細胞內的活性氧水平。細胞按“1.4.1”項操作處理后,加入稀釋好的10 μmol·L-1DCFH-DA,37 ℃孵育30 min后,用無血清細胞培養液洗滌細胞3次,充分去除未進入細胞內的DCFH-DA。DCF的熒光強度利用流式細胞儀檢測。實驗結果以正常組為100% 進行換算[9]。
1.4.5細胞內MMP的測定[10]培養細胞加入適當體積的JC-1工作液,37 ℃孵育20 min,用無血清細胞培養液洗滌3次,以充分去除細胞外的JC-1,然后加入JC-1緩沖液0.3 mL,用流式細胞儀檢測。JC-1單體激發光490 nm,發射光530 nm;JC-1聚合物激發光525 nm,發射光590 nm。實驗結果以正常組為100%進行換算。
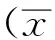
2 結果
2.1蝙蝠葛諾林堿對培養皮層細胞活性的影響 細胞形態學變化:正常組神經元胞體飽滿,邊緣光滑,有較強折光性;損傷組神經元細胞核固縮,胞體膨脹甚至破裂,細胞膜不完整,折光性差,給藥后這種情況明顯改善,見圖1。
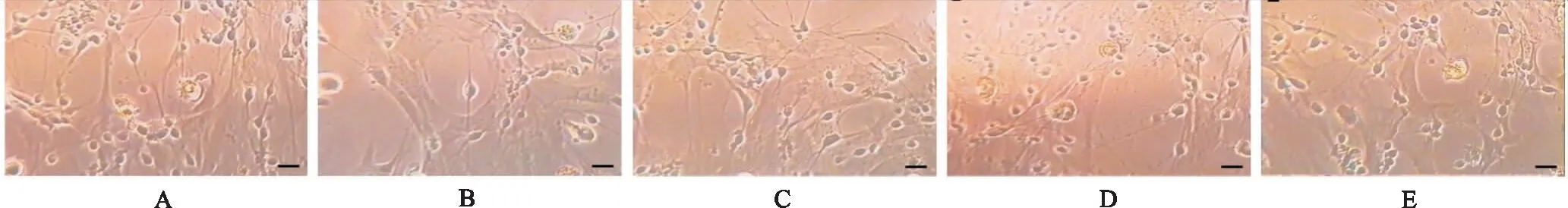
2.2蝙蝠葛諾林堿對培養皮層元細胞存活率MTT實驗的影響 正常對照組的神經元百分存活率為(100±29.12)%,模型對照組神經元百分存活率為(54.11±6.62)%,與正常對照組比較,模型對照組神經元的百分存活率明顯降低(P<0.05);蝙蝠葛諾林堿小劑量處理組神經元的百分存活率為(67.53±10.54)%,與模型對照組比較存活率明顯升高(P<0.05);中劑量處理組的細胞存活率為(71.50±9.79)%,與模型對照組比較存活率明顯升高(P<0.05);大劑量處理組的細胞存活率為(87.48±5.29)%,與模型對照組比較存活率明顯升高(P<0.05),見圖2。
2.3蝙蝠葛諾林堿對OGD-R引起細胞內ROS增加的影響 流式細胞實驗的結果表明,經OGD-R處理的細胞,胞內DCF熒光強度顯著增高,而蝙蝠葛諾林堿處理后,胞內DCF熒光強度明顯降低。統計結果顯示,與OGD模型對照組比較,1和10 μg·mL-1的蝙蝠葛諾林堿降低細胞內ROS比例高達230.09%和354.05%(P<0.05),而低濃度(0.1 μg·mL-1)蝙蝠葛諾林堿對OGD誘導產生的ROS無顯著性影響,見圖3。
2.4蝙蝠葛諾林堿對OGD-R引起MMP下降的影響 蝙蝠葛諾林堿顯著降低OGD-R所致的線粒體膜去極化程度,表現為紅色熒光增強,綠色熒光減弱。與模型對照組比較,蝙蝠葛諾林堿(1,10 μg·mL-1)分別降低MMP為24.66%和37.88%(P<0.05),而低濃度(0.1 μg·mL-1)作用不明顯,見圖4。
3 討論
腦缺血再灌注損傷與ROS的過量產生密切相關,其發生過程包括:DNA的氧化損傷后易導致基因突變或細胞死亡;蛋白質中與功能有關的氨基酸成分對自由基或脂質過氧化的中間產物特別敏感,使酶活性、生物膜和細胞的功能、代謝發生異常變化,膜脂質過氧化,導致細胞膜在內的所有膜性結構細胞器受損,而引起相應功能障礙[11]。本研究通過利用DCFH-DA熒光探針檢測大鼠原代培養皮層神經元缺血缺氧損傷后ROS含量的變化,實驗結果顯示,OGD模型中神經元細胞ROS含量明顯增加,而蝙蝠葛諾林堿劑量依賴性減低細胞內ROS水平,提示蝙蝠葛諾林堿對神經細胞缺血再灌注損傷的保護作用,可能與減少細胞內活性氧的產生有關。
A.正常對照組;B.OGD組;C.蝙蝠葛諾林堿(0.1 μg·mL-1)組;D.蝙蝠葛諾林堿(1 μg·mL-1)組;E.蝙蝠葛諾林堿(10 μg·mL-1)組。
圖1 5組神經元形態學變化(×250)
A.normal control group;B.OGD group;C.daurinoline(0.1 μg·mL-1)group;D.daurinoline(1 μg·mL-1)group;E.daurinoline(10 μg·mL-1)group.
Fig.1Morphologicalchangesofneuronsinfivegroups(×250)
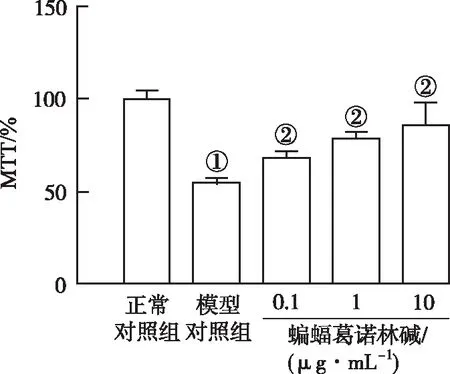
①與正常對照組比較,P<0.05;②與模型對照組比較,P<0.05。
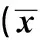
①Compared with normal control group,P<0.05;②compared with model control group,P<0.05.

線粒體是神經元凋亡信號的中心中轉站和能量轉換場所,產生三磷酸腺苷為細胞提供能量。另一方面線粒體產生的活性氧簇介導分子信號,觸發急性凋亡激活物的釋放,也是細胞死亡通路的整合元件。在腦缺血再灌注損傷中,很多因素如胞質及線粒體基質Ca2+超載、氧化應激過度、能量耗竭、誘導凋亡的Bcl-2家族蛋白等均可促進線粒體的通透性轉換孔(mitochondrial permeability transitionpore,MPTP)不可逆過度開放[12],導致線粒體跨膜電位崩解,呼吸鏈解耦聯,線粒體基質滲透壓升高,線粒體腫脹,外膜破裂,最終導致依賴Cyt-c和caspase途徑的細胞凋亡[13]。本實驗發現大鼠原代培養皮層細胞OGD損傷后,細胞內ROS的產生增多,線粒體跨膜電位降低。蝙蝠葛諾林堿可劑量依賴性穩定線粒體膜電位。
綜上所述,在原代培養的大鼠皮層細胞OGD-R模型中,蝙蝠葛諾林堿通過抑制細胞內ROS產生,穩定線粒體膜電位,保護線粒體的功能,從而發揮對缺血再灌注損傷的神經保護作用。
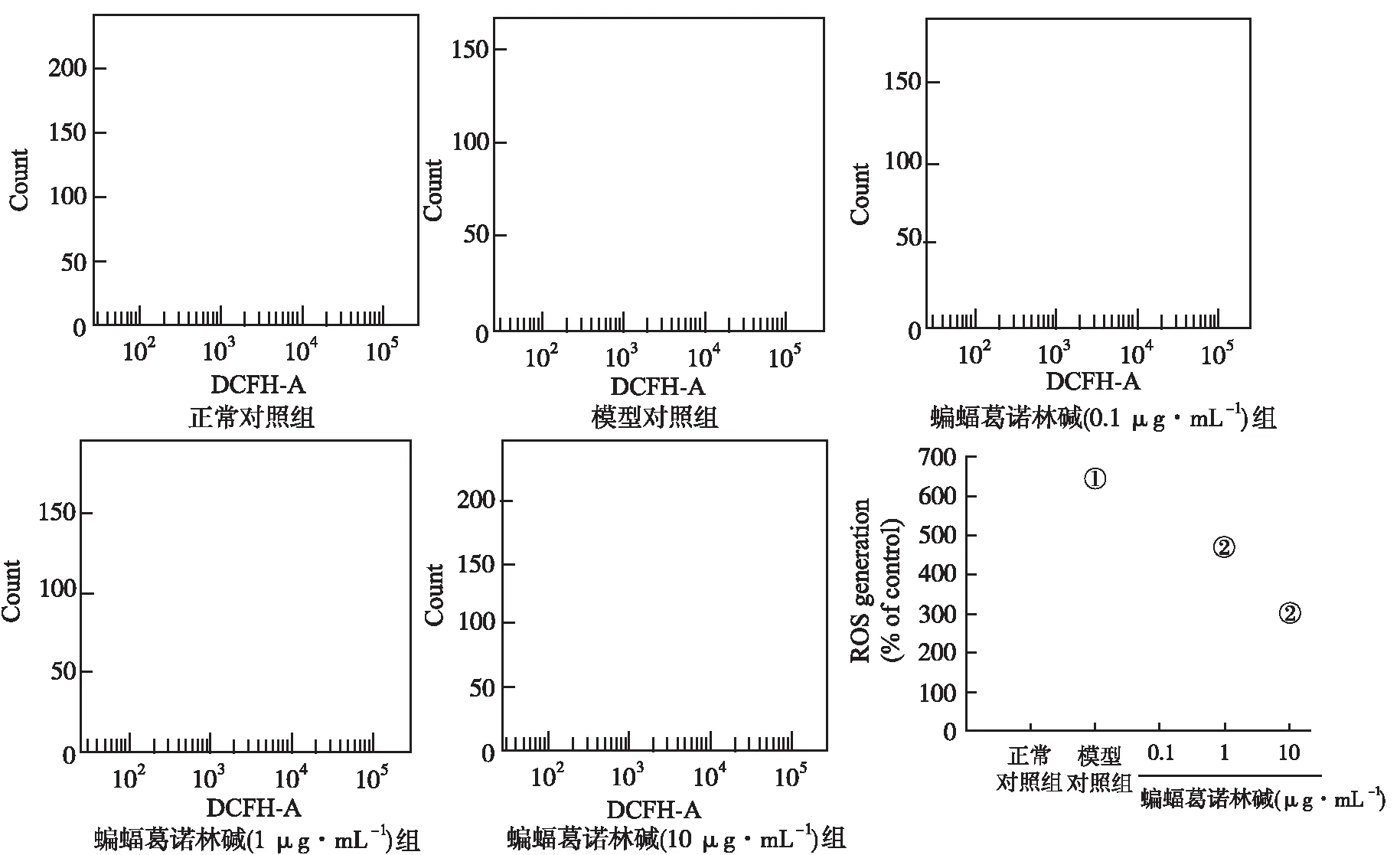
①與正常對照組比較,P<0.05;②與模型對照組比較,P<0.05。
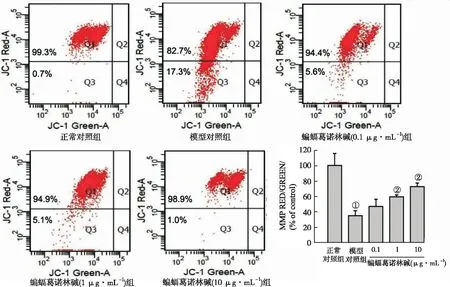
①與正常對照組比較,P<0.05;②與模型對照組比較,P<0.05。

