動(dòng)脈栓塞術(shù)與微波消融術(shù)治療肝海綿狀血管瘤患者臨床療效對(duì)比研究*
李陸鵬,曹廣劭,曹會(huì)存,劉建文,劉玉巖
肝海綿狀血管瘤(cavernous hemangioma of liver,CHL)是一種無明顯癥狀和體征的常見肝臟良性腫瘤,病程較長(zhǎng),腫瘤直徑大于5 cm時(shí)可引起腹脹、腹痛等壓迫癥狀,并具有血管瘤破裂出血的風(fēng)險(xiǎn)。現(xiàn)階段,多采用外科手術(shù)治療瘤體直徑>5cm的患者,但手術(shù)治療過程創(chuàng)傷大,風(fēng)險(xiǎn)高,容易誘導(dǎo)眾多并發(fā)癥的發(fā)生[1,2]。隨著微創(chuàng)和介入放射學(xué)技術(shù)的發(fā)展,經(jīng)導(dǎo)管動(dòng)脈栓塞術(shù)(transcatheter arterial embolization,TAE)和微波消融創(chuàng)傷小,治療后預(yù)后較好,備受臨床醫(yī)生和患者的青睞。已有研究顯示TAE和微波消融治療CHL患者效果良好[3,4]。我們采取TAE和微波消融治療了CHL患者,比較了兩種方法治療各自的優(yōu)缺點(diǎn),現(xiàn)報(bào)道如下。
1 資料與方法
1.1 一般資料 2014年1月~2018年4月在我院綜合介入科就診的CHL患者74例,男性35例,女性39例;年齡范圍為32~55歲,平均年齡為(43.48±10.34)歲。經(jīng)影像學(xué)檢查并符合CHL的診斷標(biāo)準(zhǔn)[5],有明顯的腹痛腹脹和壓迫周圍組織癥狀或瘤體直徑>5 cm,無行介入治療的禁忌證。其中單個(gè)病灶43例,兩個(gè)及以上病灶31例;瘤體直徑為5~10 cm者54例,瘤體直徑≥10 cm者20例;腫瘤在肝右葉者28例,肝左葉者26例,兩葉均有20例。排除標(biāo)準(zhǔn):①伴有嚴(yán)重的中樞和外周神經(jīng)性疾病、皮膚病、血液系統(tǒng)疾病或惡性腫瘤;②嚴(yán)重的腹腔積液或惡液質(zhì);③治療前3月內(nèi)服用過損傷肝功能的藥物。將患者分成兩組,兩組一般資料比較具有良好的可比性(P>0.05)。所有患者簽署知情同意書,本研究經(jīng)我院醫(yī)學(xué)倫理委員會(huì)審核通過。
1.2 治療方法 在行微波消融治療時(shí),使用KY-2000系列微波消融治療儀(南京康友醫(yī)療科技有限公司)和Voluson730Pro彩色多普勒超聲診斷系統(tǒng)(上海涵飛醫(yī)療器械有限公司)。術(shù)前禁食、禁飲,術(shù)中予以補(bǔ)液和全程生命體征監(jiān)測(cè)。術(shù)前設(shè)計(jì)好最佳穿刺點(diǎn)及路徑,避開膈肌、肝靜脈、膽管、門靜脈等重要結(jié)構(gòu)。對(duì)于孤立,且遠(yuǎn)離肝臟重要結(jié)構(gòu)的瘤體,給予常規(guī)局部麻醉,在超聲引導(dǎo)下進(jìn)行定位、穿刺。對(duì)于周圍組織較為復(fù)雜,距離肝臟或周圍重要組織結(jié)構(gòu)較近的瘤體,給予常規(guī)全身麻醉,在腹腔鏡下探查、顯露病灶。在超聲引導(dǎo)下進(jìn)行定位和穿刺。對(duì)所有患者均行兩圓相交消融技術(shù)進(jìn)行微波消融治療,儀器輸出功率為50~74 w。根據(jù)瘤體大小確定治療時(shí)間為8~15 min。術(shù)畢,在膈下或肝下置管引流,給予止痛、預(yù)防感染、護(hù)肝治療和護(hù)理,直至患者病情恢復(fù),出院[6];在行TAE時(shí),患者取仰臥位,行局部麻醉,采用Seldinger技術(shù)插管,穿刺右側(cè)股動(dòng)脈,將導(dǎo)管送至病灶動(dòng)脈,行DSA下造影,明確CHL的部位、大小、數(shù)目和血供情況。然后,經(jīng)2.8 F微導(dǎo)管(日本Terumo公司)注入平陽(yáng)霉素(吉林敖東藥業(yè)集團(tuán)延吉股份有限公司,國(guó)藥準(zhǔn)字:H20123357)與碘化油(LaboratorieGuerbet,批準(zhǔn)文號(hào):H20050307)的混合乳劑,根據(jù)瘤體血供及大小決定用量,行栓塞治療。拔出導(dǎo)管并實(shí)施止血和局部包扎[7]。
1.3 血生化檢測(cè) 使用DP180型全自動(dòng)生化分析儀(東唐電子科技有效公司)檢測(cè)。
1.4 視覺模擬評(píng)分(visual analogue score,VAS)的實(shí)施 采用VAS評(píng)分評(píng)估疼痛程度,評(píng)分范圍為0~10分,分值越高,疼痛程度越嚴(yán)重。0分為無疼痛,10分代表難以忍受的最劇烈的疼痛[8]。
1.5 療效判斷 根據(jù)WHO實(shí)體瘤療效評(píng)價(jià)標(biāo)準(zhǔn),在術(shù)后6個(gè)月,使用CT檢查測(cè)量并計(jì)算瘤體變化,以CT顯示的CHL最大橫截面測(cè)量其垂直徑線長(zhǎng)度,其平均縮小率=(治療前平均面積-治療后平均面積)/術(shù)前平均面積×100%(平均面積=瘤體最大橫截面垂直徑線的乘積)。瘤體完全消失為完全緩解(complete remission, CR);瘤體縮小率達(dá)50%記為部分緩解(partial remission, PR);瘤體縮小率<50%,但增大不超過25%記為穩(wěn)定(stable,SD);瘤體最大橫截面積增大超過25%記為進(jìn)展(progress,PD)。總有效率=(CR+PR)例數(shù)/總例數(shù)×100%。
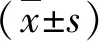
2 結(jié)果
2.1 兩組療效比較 經(jīng)x2檢驗(yàn),兩組總有效率無統(tǒng)計(jì)學(xué)差異(P>0.05,表1)。

表1 兩組患者治療后6個(gè)月療效[n(%)]比較
2.2 兩組肝功能指標(biāo)變化的比較 治療前,兩組肝功能指標(biāo)水平差異無統(tǒng)計(jì)學(xué)意義(P>0.05);治療后,微波消融組血清ALT和AST水平顯著低于TAE組(P<0.05,表2)。
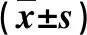
表2 兩組肝功能指標(biāo)比較
與TAE組比,①P<0.05
2.3 兩組VAS評(píng)分比較 治療后,微波消融組VAS評(píng)分顯著低于TAE組(P<0.05,表3)。
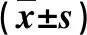
表3 兩組VAS評(píng)分比較
與TAE組比,①P<0.05
2.4 兩組不良反應(yīng)發(fā)生率比較 經(jīng)Fisher概率計(jì)算,微波消融組不良反應(yīng)發(fā)生率與TAE組比,差異無統(tǒng)計(jì)學(xué)意義(P>0.05,表4)。

表4 兩組不良反應(yīng)發(fā)生率[n(%)]比較
3 討論
CHL生長(zhǎng)緩慢且少有臨床癥狀。研究指出,CHL發(fā)病率占全部良性肝腫瘤的73%左右[9]。CHL發(fā)病復(fù)雜,肝毛細(xì)血管組織感染、肝組織局部壞死、肝內(nèi)區(qū)域性血循環(huán)停滯、肝內(nèi)出血、發(fā)育異常等均可導(dǎo)致其發(fā)病。較多學(xué)者認(rèn)為肝臟內(nèi)部血管異常所造成的良性先天性或后天緩慢生長(zhǎng)的組織畸形是主要的發(fā)病原因。CHL患者瘤體可在腹腔內(nèi)幾乎不受限制地生長(zhǎng)。當(dāng)生長(zhǎng)到一定程度后可引起上腹部疼痛、腹脹以及周圍臟器壓迫癥狀,嚴(yán)重者甚至可導(dǎo)致其自發(fā)破裂或Kasabach-Merritt綜合征、Budd-Chiari綜合征等嚴(yán)重并發(fā)癥。一般情況下,CHL對(duì)肝功能無明顯異常,但在治療過程中可能由于手術(shù)創(chuàng)傷而對(duì)肝功能造成影響[10,11]。本研究結(jié)果顯示,治療后,兩組患者血清ALT和AST水平與治療前相比,均顯著升高,但微波消融組血清ALT和AST水平顯著低于TAE組。總體而言,經(jīng)微波消融對(duì)CHL患者肝功能的影響較小。因TAE治療后,瘤體周圍正常肝組織缺血壞死,此時(shí),血清ALT和AST在肝臟酶學(xué)中的活性最強(qiáng),治療本身可能造成其水平升高。此外,TAE還可導(dǎo)致膽管系統(tǒng)輕度缺血,有可能引起膽管水腫和狹窄,造成膽汁淤積,導(dǎo)致一過性黃疸。微波消融治療在超聲引導(dǎo)下進(jìn)行,避開了膈肌、肝靜脈、膽管、門靜脈等重要結(jié)構(gòu),對(duì)肝臟的損傷較小,故而微波消融組肝功能指標(biāo)變化程度較TAE組要小,但本研究亦發(fā)現(xiàn)兩組患者總有效率無統(tǒng)計(jì)學(xué)差異,說明兩種方法治療都有效[12-15]。
腹部疼痛是瘤體直徑>5 cm的CHL患者的主要臨床癥狀,且在治療過程中,由于肝臟周圍組織器官較為復(fù)雜,手術(shù)操作帶來的損傷等亦會(huì)導(dǎo)致患者出現(xiàn)術(shù)后疼痛。本研究結(jié)果顯示,兩組患者治療后VAS評(píng)分逐漸降低,且術(shù)后12 h、24 h和48 h時(shí)微波消融組VAS評(píng)分均顯著低于TAE組,說明經(jīng)微波消融進(jìn)行治療,CHL患者術(shù)后疼痛程度較采用TAE治療要輕。考慮系微波消融治療過程中對(duì)于瘤體周圍組織較為復(fù)雜的患者采取腹腔鏡直視下進(jìn)行手術(shù),能有效減少對(duì)健康肝臟組織的損傷,且避開了膽管和重要的血管,并可根據(jù)瘤體大小進(jìn)行多點(diǎn)、分次消融操作,可確保瘤體被徹底、完全消融,治療效果顯著,減少了術(shù)中病灶的殘留,可有效治療疾病本身所帶來的疼痛感。而在TAE治療過程中,有可能引起肝包膜血管栓塞,且對(duì)于瘤體直徑越大者,所需注入的栓塞劑較多,容易引起不同程度的疼痛感[16,17]。
CHL由許多擴(kuò)張的大小不等的血竇組成,表現(xiàn)為肝動(dòng)脈分支畸形。在進(jìn)行外科手術(shù)治療時(shí),創(chuàng)傷大,風(fēng)險(xiǎn)高,容易引起較多不良反應(yīng)的發(fā)生。微波消融術(shù)通過穿刺直接到達(dá)病灶,直接通過高頻率的微波產(chǎn)生高熱從而導(dǎo)致瘤體組織壞死,無需進(jìn)行肝臟切開,且避免了將病灶處的肝臟與周圍組織分離的步驟,可顯著縮短手術(shù)時(shí)間,降低患者術(shù)中出血量,手術(shù)創(chuàng)傷較小,進(jìn)一步避免了由于麻醉時(shí)間長(zhǎng)及出血量大導(dǎo)致的術(shù)后不良反應(yīng),故而發(fā)熱、肝膿腫、膽管狹窄和肝衰竭等常見不良反應(yīng)發(fā)生率較低[18,19]。CHL的血供主要來自肝動(dòng)脈,TAE治療以此為基礎(chǔ),注入平陽(yáng)霉素及碘化油的混合乳劑進(jìn)行栓塞治療,可導(dǎo)致CHL患者體內(nèi)血栓形成,使得血竇閉塞,進(jìn)而控制瘤體繼續(xù)生長(zhǎng),從而達(dá)到預(yù)防破裂出血的治療目的,有效緩解臨床癥狀。其中,平陽(yáng)霉素發(fā)揮抑制血管內(nèi)皮增生的作用,是一種溫和的血管硬化劑,可破壞血竇內(nèi)皮并使其閉塞,碘化油則作為一種載體,與平陽(yáng)霉素乳化后,可促進(jìn)局部高濃度的藥物緩釋作用,而達(dá)到硬化性栓塞作用。此外,該藥還可選擇性地沉積于CHL瘤體內(nèi),存留時(shí)間較長(zhǎng),導(dǎo)致異常血竇血栓形成和機(jī)化,使血管瘤成為纖維樣結(jié)構(gòu),促進(jìn)瘤體皺縮而達(dá)到治療的目的[20,21]。在治療過程中,對(duì)正常肝組織所產(chǎn)生的創(chuàng)傷小,手術(shù)可在一定程度上控制不良反應(yīng)的發(fā)生,故而兩組患者治療后,微波消融組不良反應(yīng)發(fā)生情況與TAE組比較,差異不具有統(tǒng)計(jì)學(xué)意義,推測(cè)該結(jié)果的獲得還可能與術(shù)后積極的對(duì)癥支持治療措施等密切相關(guān)。
綜上所述,TAE和微波消融治療CHL患者均有很好的臨床療效,術(shù)后不良反應(yīng)發(fā)生率低,對(duì)肝功能指標(biāo)的影響較小,但微波消融治療可在直視下進(jìn)行,進(jìn)入路徑可控可選,消融效果可辨,術(shù)后疼痛發(fā)生率較低,值得臨床進(jìn)一步研究與應(yīng)用。但TAE治療對(duì)CHL來說,更符合腫瘤發(fā)生學(xué)的邏輯,對(duì)儀器設(shè)備和技術(shù)要求可能更高,可以總結(jié)的經(jīng)驗(yàn)也應(yīng)該更多,也是值得探討的治療方法。

