2型糖尿病患者血漿中PAI-1及sVCAM-1水平與耳鳴的相關性研究*
王 慶,羅 茂
(1.樂山市市中區人民醫院耳鼻喉科,四川樂山 614000;2.西南醫科大學藥物研究中心,四川瀘州 646000)
隨著當代醫學對2型糖尿病(T2DM)的深入研究,人們認識到T2DM本身并不會對患者生命造成較大威脅,而其引發的血管、腎臟、視網膜損害將嚴重影響患者生活質量[1]。近年來,聽力損害作為T2DM的并發癥,正逐漸受到衛生領域重視,相關調查報告顯示,糖尿病患者并發聽力障礙風險為健康人群的2倍,其特征常見雙側對稱性、漸進性、不可逆性病變[2],且多以高頻聽力損害為主,表現為耳鳴、耳聾等癥狀,為患者日常生活帶來諸多不便。由于T2DM患者主觀感受、聽覺感受并不能確切反映其實際的聽力情況,因而并發耳鳴癥狀在早期并不容易察覺,即便通過純音測聽試驗也不能做出有效診斷[3]。然而全面的聽力學檢查項目較多,且試驗程序復雜,對測試儀器與測試者經驗要求較高,早期篩查診斷仍較為困難。基于此,本研究檢測了T2DM產生的全身性病變相關標志物,分析了這些標志物與并發耳鳴之間的潛在聯系,取得一定成果,現報道如下。
1 資料與方法
1.1一般資料 對2017年4月至2019年3月樂山市市中區人民醫院收治的64例T2DM并發耳鳴患者(觀察組)及148例單純T2DM患者(對照組)臨床資料進行回顧性分析。觀察組男性34例,女性30例;年齡60~88歲,平均(76.33±5.41)歲;T2DM病程為7~20年,平均(14.94±3.26)年;空腹血糖(FPG)水平為(9.47±1.35)mmol/L,糖化血紅蛋白(HbA1c)水平為(8.82±0.73)%;耳鳴殘疾度量化表(THI)評分為(27.95±6.89)分。對照組男性76例,女性72例;年齡48~81歲,平均(65.12±9.50)歲;病程為3~18年,平均(11.60±4.18)年;FPG水平為(8.60±1.22)mmol/L,HbA1c水平為(8.26±0.59)%。納入標準:(1)臨床表現及口服葡萄糖耐量試驗(OGTT)檢測結果均符合T2DM相關診斷標準;(2)年齡40~90歲;(3)中耳及前庭功能正常。排除標準:(1)診斷為外耳道栓塞、中耳炎、耳硬化癥、內耳畸形、鼓膜穿孔、梅尼埃病等耳部疾病因素或病毒感染、噪聲、爆震、外傷、中毒、顳頜關節疾病等直接因素引起的耳鳴;(2)存在意識、精神障礙而無法對耳鳴狀況進行如實描述;(3)臨床資料不完整。
1.2方法 患者空腹狀態下常規采集肘靜脈血5 mL,乙二胺四乙酸二鈉(EDTA)抗凝管保存,30 min內通過3 000 r/min轉速離心機內處理≥20 min,提取上清液保存于樣品管,在-80 ℃冰箱中凍存待測;確保批量測試周期≤3個月,測試采用纖維酶原激活物抑制物-1(PAI-1)、可溶性血管細胞黏附分子-1(sVCAM-1)、3-硝基酪氨酸(3-NT)、神經生長因子(NGF)對應酶聯免疫吸附法(ELISA)試劑盒(購自伊萊瑞特生物科技有限公司),測試前24 h將血漿樣品轉移至4 ℃冰箱緩慢解凍,測試前30 min將血漿樣品與試劑盒轉移至實驗臺上平衡至室溫,在此期間準備好稀釋液、工作液、洗滌液、底物溶液、終止液等所需試劑,取96孔板分別標記空白孔、樣品孔及多個標準孔;向空白孔、樣品孔與首級標準孔中分別加入稀釋液、血漿樣品與標準品溶液,逐級稀釋標準品溶液并確保每孔液體體積均為100 μL,混勻后覆膜在37 ℃恒溫箱中溫育1 h;傾去孔內液體后甩干,加生物素化抗體工作液100 μL,混勻后覆膜在37 ℃恒溫箱中溫育1 h;傾去液體后每孔加入洗滌液350 μL,浸泡2 min后傾去,重復洗滌3次后在吸水紙上盡量拍干,每孔加酶結合物工作液100 μL,混勻后覆膜在37 ℃恒溫箱中溫育30 min;傾去液體后甩干,以上述方法洗滌5次并拍干,每孔加入底物溶液90 μL,混勻后覆膜、加蓋避光在37 ℃恒溫箱中溫育約15 min,終止時間以半數標準孔休閑肉眼可見顯色即可,以底物溶液相同順序加入終止液50 μL;通過酶標儀在450 nm波長處測量每孔光密度(A),以空白孔數據校正背景,將孔梯度濃度與A值繪制為標準曲線并擬合出回歸方程,計算對應樣品孔血漿樣品中對應物質的濃度水平。
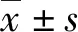
2 結 果
2.1兩組各指標比較 觀察組血漿PAI-1、sVCAM-1、3-NT、NGF水平均明顯高于對照組,差異均有統計學意義(P<0.05),見表1。

表1 兩組患者血漿PAI-1、sVCAM-1、3-NT、NGF水平比較
2.2預測診斷效能分析 血漿PAI-1、sVCAM-1、3-NT、NGF單獨預測T2DM患者并發耳鳴ROC曲線AUC>0.5,Youden指數對應cut-off值分別為8.06 mmol/L、58.50 ng/mL、269.79 pg/mL、4.16 ng/mL;4個指標聯合預測的ROC曲線AUC為0.796,均明顯大于單獨預測指標(P<0.05)。見圖1、表2。

圖1 各指標單獨及聯合預測T2DM患者并發耳鳴的ROC曲線

表2 ROC曲線參數
注:與聯合預測比較,*P<0.05;-表示無數據。
2.3相關性分析 觀察組患者血漿PAI-1、sVCAM-1、3-NT、NGF水平與THI評分均表現出顯著正相關性(r>0,P<0.05),見表3。

表3 各指標與觀察組THI評分的Pearson相關性分析
3 討 論
PAI-1屬于纖溶系統的重要組成部分,其主要功能是通過抑制纖維酶原激活物(PA)活性,以調節整個纖溶系統平衡[4]。T2DM患者在血糖逐漸升高及糖耐量下降的同時,血管內皮細胞功能失調,PAI-1過度釋放,纖溶抑制可隨之出現,引起血液高凝狀態,能促進血栓形成,心、腦血管病變風險極大增加[5],是獨立于體質量指數(BMI)、胰島素抵抗指數(HOMA-IR)、糖尿病家族史等已知因素以外的危險因素。有關研究指出,血液流變學異常可增加微血管循環負擔,不僅基底膜增厚,管狀內皮細胞也將出現病理增生,與糖尿病視網膜病變機制相仿,可加重耳蝸毛細胞內脂肪沉積作用,形成典型的微循環障礙,進而導致聽覺損害[6]。本研究結果顯示,觀察組血漿PAI-1水平明顯高于對照組,與THI評分有明顯正相關性,ROC曲線顯示PAI-1≥8.06 mmol/L可高風險提示為耳鳴,這表明血漿PAI-1能一定程度預測T2DM并發耳鳴及其嚴重程度,臨床檢測可通過參考閾值進行早期篩查診斷。
sVCAM-1是免疫球蛋白超家族成員之一,主要由活化的血管內皮細胞、平滑肌細胞、巨噬細胞及成纖維細胞表達,其配體為整合素家族的極遲抗原-4(VLA-4),二者結合能介導細胞間相互黏附作用[7]。T2DM導致的廣泛炎性反應,將促使動脈粥樣硬化病變進程加快,并觸發血管內皮細胞受損,白細胞更易于向內皮下結構募集,刺激其過度表達sVCAM-1[8]。據相關研究報道,內耳血流供應主要依賴于小腦前下動脈分支,且由于其他代償動脈較少,一旦血管發生病變導致內耳缺血,即便成功達成再灌注,也難以恢復耳蝸正常電位[9]。本研究中,觀察組血漿sVCAM-1水平明顯高于對照組,與THI評分正相關性良好,sVCAM-1≥58.50 ng/mL可提示存在較高耳鳴風險。
T2DM由于存在葡萄糖自身氧化、蛋白質非酶促糖基化、多元醇通路過度激活等作用產生廣泛的氧化應激,不僅可進一步損害胰島β細胞,還將減少外周組織對胰島素的敏感性[10]。3-NT作為蛋白質硝基化的主要產物,是T2DM患者體內一氧化氮被超氧陰離子氧化為過氧亞硝基陰離子(ONOO-)后造成蛋白質氧化損傷的主要證據[11]。有學者認為,ONOO-能對多種生物大分子產生過氧化與硝基化作用,能導致DNA鏈斷裂與多聚核苷酸二磷酸核糖基聚合酶(PARP)激活,對神經病變與微血管病變均有較強促進作用[12]。本研究發現,觀察組血漿3-NT水平明顯高于對照組,與THI評分有明顯正相關性(r=0.473,P=0.011),其cut-off值為269.79 pg/mL,因此T2DM患者3-NT水平越高,越容易并發更嚴重的耳鳴,早期檢測可一定程度反映患者微血管病變及神經病變的程度。
NGF是最早發現的神經營養因子,不僅能維持神經細胞生理活動,還可促進新生血管形成等非神經組織生理活動。既往研究已證實隨著糖尿病病程延長,血管內皮細胞損害與非酶促糖基化反應加劇,NGF表達與HbA1c生成量同時增高[13]。針對糖尿病視網膜病變患者而言,視網膜低氧狀態可誘發視神經細胞過度表達NGF以產生代償性保護作用,由于能提高新生血管網增生效率,將進一步損害視功能[14]。趙振鹿等[15]在研究中提出,T2DM患者耳蝸小血管管壁增厚明顯,血管紋則有顯著萎縮,螺旋神經節細胞出現明顯缺失,神經纖維則明顯減少,第Ⅷ顱神經纖維束結構變得更為松散,導致部分神經軸索分裂為碎片,從而引起聽力障礙。本研究也發現,觀察組血漿NGF水平明顯高于對照組,與THI評分正相關性良好,其水平大于或等于4.16 ng/mL者更易于出現耳鳴,且聯合應用上述指標能提高對T2DM患者并發耳鳴的早期預測診斷效能,可作為全面聽力學功能測試前的迅速聯合篩檢項目應用于臨床。
4 結 論
糖尿病并發耳鳴早期確診相對困難,有必要通過簡便易行的檢測方法提供診斷與評估信息。血漿PAI-1、sVCAM-1、3-NT、NGF水平作為生化指標,均已證實與T2DM患者并發耳鳴嚴重程度存在確切正相關性。盡早通過實施聯合檢測,可為臨床干預提供指導,具有較高預測價值。

