三陰性乳腺癌細胞膜表面EGFR和c-Met的單分子水平共定位研究
柴彬彬,王麗,李勁濤,張曉菲,夏陽,吉元,盛望,韓曉東
北京工業大學 a.生命科學與生物工程學院;b.固體微結構與性能研究所;北京 100124
乳腺癌是女性最常見的惡性腫瘤,已成為癌癥致死的第二大病因[1]。三陰性乳腺癌(triple negative breast cancer,TNBC),是指孕激素受體(PR)、雌激素受體(ER)、人表皮生長因子受體2(HER2)均為陰性的浸潤性乳腺癌,占所有乳腺癌病例的10%~20%,與非TNBC 相比其惡性程度更高[2]。由于缺乏有效的靶向治療,TNBC 患者的預后普遍較差[3]。因此,尋找TNBC 治療靶點和治療方式是當前的研究熱點。
表皮生長因子受體(epidermal growth factor receptor,EGFR)是酪氨酸激酶受體ErbB 家族的4個成員之一,是一種跨膜糖蛋白。EGFR 通過多種機制異常激活,包括受體過度表達、突變、配體依賴性受體二聚化、配體非依賴性激活等,并且與多種人類癌癥的發生有關[4]。EGFR 與配體表皮生長因子(EGF)結合后形成二聚體,誘導其自身磷酸化,從而啟動下游信號通路,促進細胞增殖,抑制凋亡和促進細胞侵襲[5]。
間質表皮轉化因子(cellular mesenchymal-ep?ithelial transition factor,c-Met)即肝細胞生長因子受體,是由原癌基因c-met 編碼的受體酪氨酸激酶,屬于RON 亞族,與配體肝細胞生長因子(he?patocyte growth factor,HGF)具有高度結合性[6]。配體與c-Met 在胞外區結合后,誘導c-Met 磷酸化,激活多種細胞內信號傳導途徑,促進腫瘤細胞的增殖、遷移和侵襲[7]。c-Met 通路的失調在胃癌、肺癌、結腸癌、乳腺癌、膀胱癌等多種人類癌癥中均有報道。
EGFR 和 c-Met 在 TNBC 中 的 異常 高表 達 ,使之成為受關注的治療TNBC 的重要藥物靶點。有研究利用免疫共沉淀的方法,鑒定了EGFR/c-Met復合物的存在[8],但尚未對它們的聚合形式進行細胞學直觀驗證。
結合已有經驗,我們在三陰性乳腺癌細胞中用EGFR 和c-Met 特異的核酸適配體介導鏈接納米金顆粒,采用掃描電子顯微鏡的單分子成像技術,在納米尺度對EGFR 和c-Met 在細胞膜表面的表達數量及聚集狀態及二者共定位關系進行了表征,探究了EGFR 和c-Met 的共定位關系及相互作用機制,為更清晰地了解蛋白功能及調控機制提供了新的可視化研究手段,也為藥物研發和開展精準靶向治療研究提供參考。
1 材料與方法
1.1 材料
三陰性乳腺癌MB-231 細胞系購于美國ATCC;鏈霉親和素修飾的納米金顆粒(10 和30 nm)由NANOCS 公司合成;特異性結合EGFR 的核酸 適 配 體 TuTu22(5′-TGCCGTTTCTTCTCTTTCGC TTTTTTTGCTTTTGAGCATG-3′)[9]和特異性結合 c-Met 的 核酸適配體 SL1(5′-ATCAGGCTGGATGGT AGCTCGGTCGGGGTGGGTGGGTTGGCAAGTCTGAT-3′)[10]由生工生物工程股份有限公司合成;ITO 導電玻璃購于上海聚笛玻璃公司。
1.2 MB-231細胞培養
在生物安全柜中將ITO 玻璃置于75%酒精中浸泡10 min,紫外燈照射30 min 后放入24 孔板中,接種 3×104/孔 MB-231 細胞,培養 24 h 后每孔加入1 mL 4%多聚甲醛固定細胞30 min,加入PBS 反復洗滌ITO 玻璃5 次,晾干后備用。
1.2.1 單一標記 將20 nmol/L 生物素標記的c-Met 配體室溫敷育在ITO 導電玻璃上,于濕盒中敷育2 h,用超純水清洗干凈,晾干后將鏈霉親和素標記的金顆粒(30 nm)超純水稀釋至1/10,滴在細胞上,濕盒中敷育2 h,超純水清洗ITO 導電玻璃5 次后洗凈,晾干待測。用同樣方法在別組ITO 導電玻璃以30 nm 的金顆粒標記EGFR,超純水反復沖洗后晾干。
1.2.2 共同標記 以上述方法用納米金顆粒(30 nm)單一標記c-Met 后,用同樣方法繼續在本組ITO 導電玻璃上以10 nm 的金顆粒標記EGFR,超純水反復沖洗后晾干。
1.3 掃描電鏡表征
實驗設備為FEI 公司的Quanta 600 環境掃描電鏡(ESEM),采用二次電子(SE)探頭和背散射電子(BSE)信號成像,加速電壓10~20 kV,放大倍率500~200 000。
1.4 統計分析
用imageJ 軟件隨機選擇細胞不同位置的照片5 張進行分析統計。分別統計2 種膜蛋白的單體、二聚體、多聚體數量及比值,分析異源二聚體和多聚體的形態并計算比例。
2 結果
2.1 MB-231細胞表面EGFR、c-Met單分子成像
圖1 是三陰性乳腺癌MB-231 細胞在不同倍數下的背散射電子像。圖1A 為1400 倍鏡下拍攝的細胞群照片,MB-231 細胞能夠平整分散地在ITO 導電玻璃上自然生長,可以開展高分辨成像研究。圖1B、C 清晰展現了50 000 倍鏡下局部細胞膜表面的單分子成像,細胞膜上存在大量30 nm 金顆粒偶聯的 EGFR 和 c-Met,背景清晰,可以進行統計分析。
2.2 MB-231細胞表面EGFR、c-Met單分子聚合形態觀察

圖1 納米金顆粒(30 nm)標定EGFR、c-Met 在掃描電鏡下的細胞和單分子成像

圖2 納米金顆粒(30 nm)標定EGFR、c-Met 在掃描電鏡下的單分子成像
圖2 是三陰性乳腺癌MB-231 細胞膜表面EGFR、c-Met 在50 000 倍鏡下的背散射電子像。由于一個膜蛋白只能連接一個納米金顆粒,即圖中每一個金顆粒代表一個膜蛋白,因此納米金顆粒的聚集狀態實際反映了膜蛋白的聚合形態。圖2C 是EGFR、c-Met 表達的定量統計直方圖。經計算,EGFR 單體、二聚體、多聚體的占比分別為48.60%、29.83%、21.57%,c-Met 單體、二聚體、多聚體的占比分別為38.24%、27.66%、34.10%。總體來說,在正常狀態下,EGFR 和c-Met 主要存在形式為包括二聚體在內的多聚體,這與前期研究結果相同,因此,我們將繼續利用這一方法共同標記2 種蛋白。
2.3 MB-231細胞表面EGFR、c-Met形成異源二聚體和多聚體
圖3 是三陰性乳腺癌MB-231 細胞膜表面EGFR 和c-Met 在100 000 倍鏡下的背散射電子像。利用10 和30 nm 的金顆粒對細胞膜表面的EGFR、c-Met 進行共定位,圖片清晰地展示了在正常狀態下,細胞膜表面不僅存在EGFR、c-Met各自的單體、同源二聚體和多聚體,二者還能結合形成異源二聚體和異源多聚體。圖3B 是EGFR和c-Met 表達的定量統計直方圖。經計算,EGFR和c-Met 單體、二聚體、多聚體所占比例分別為50.15%、25.57%和24.28%。其中,異源二聚體占二聚體總數的13.71%,異源多聚體占多聚體總數的24.42%。該結果證實了EGFR、c-Met 異源二聚體和多聚體的存在,也預示著這2 種膜蛋白可能存在結構和功能上的相互作用,共同協同調控下游通路。
3 討論
在三陰性乳腺癌細胞中,EGFR 和c-Met 同時過表達。它們激活促進細胞生長、侵襲和轉移的多種信號傳導途徑,主要包括Ras/ERK 和PI3K/AKT 途徑。當前,能夠抑制 EGFR 和 c-Met 通路的分子靶向藥物主要有單克隆抗體和單靶點或多靶點的酪氨酸激酶抑制劑。Cetuximab 和Panitu?mumab 等單克隆抗體特異性結合EGFR 的胞外域,Gefitinib、Erlotinib 等小分子抑制劑結合在胞內酪氨酸激酶域上的ATP 位點。但大量臨床數據表明,隨著時間的推移,EGFR 治療存在耐藥性。
同樣地,HGF 或c-Met 的單克隆抗體能夠防止HGF 與受體連接、受體二聚化,并誘導降解c-Met[11]。c-Met 的酪氨酸激酶抑制劑,例如Crizo?tinib 和 Cabozanix 已被美國 FDA 批準上市[12],Cap?matinib、AMG337 等特異性更強的小分子抑制劑也處于臨床研究階段。
研究表明,c-Met 可能是導致EGFR 酪氨酸激酶抑制劑獲得性耐藥的關鍵因素[13]。基于此,有研究選定EGFR 和c-Met 的抑制劑Lapatinib 和Foretinib 在 TNBC 的 MB-231 細胞系中進行協同治療,彌補了單一療法的不足,提高了治療效率[14]。我們的研究確定了二者異源聚合現象的存在,我們認為針對TNBC 的一種新的潛在治療方法是聯合靶向 EGFR 和 c-Met。
總之,本研究驗證了在三陰性乳腺癌細胞膜表面EGFR 和c-Met 會形成異源二聚體和多聚體,明確了其占據一定的比例。結合2 種膜蛋白的結構和功能特性研究,我們推測2 個蛋白的功能發揮有一定的相關性。這將在后續研究中得到證實,并進一步揭示EGFR 和c-Met 在腫瘤發生發展中的功能、調控機制及相互作用關系,為開展精準靶向治療提供新的科研手段。
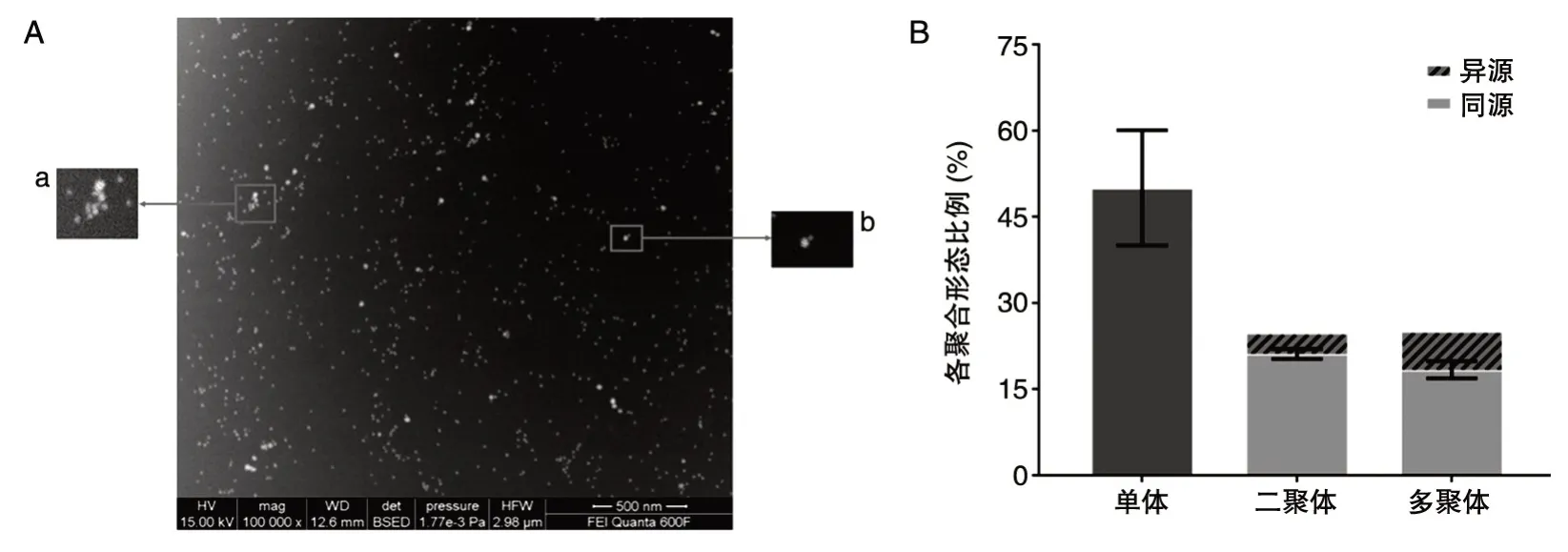
圖3 納米金顆粒標定EGFR(10 nm)和c-Met(30 nm)在掃描電鏡下的共定位成像

