基于液質聯用技術的環二核苷酸cGAMP定量檢測方法的建立與評估
郭增林,韓秋影,毛劼,王娜,周濤,陳媛
國家生物醫學分析中心,北京 100850
病毒感染是人類面臨的重大健康威脅之一。近年來重大疫情的產生多與病毒感染相關,如SARS 病毒、寨卡病毒、諾如病毒等。目前,對大多數病毒的感染,仍缺乏有效治療手段,難以應對病毒感染所導致的嚴重后果。因此,從病毒感染的共性機制入手,尋找有效的抗病毒策略,將可能為預防病毒感染、治療相關疾病提供新的思路。
病毒感染細胞后,在胞內釋放其核酸物質(DNA 或RNA)。正常生理條件下,機體可以快速識別并清除這些外來核酸物質。研究表明,環鳥苷酸-腺苷酸(cyclic GMP-AMP,cGAMP)合成酶(cGAMP synthase,cGAS)是細胞質內核酸物質DNA 的感受器。cGAS 與胞質中的DNA 結合后,催化腺嘌呤核苷三磷酸(ATP)和鳥嘌呤核苷三磷酸(GTP)合成環二核苷酸 cGAMP[1-2],cGAMP 作為第二信使結合接頭蛋白質STING 后[3-4],磷酸化TBK1 和 IRF3[5-6],促進β干擾素(IFN-β)產生,并激活NF-κB 信號通路,從而發揮清除病毒感染、維持機體穩態的作用[7-8]。cGAMP 作為cGAS 的直接產物,其表達量可以指征cGAS 的激活情況。目前,仍缺乏行之有效的檢測細胞中cGAMP 的手段,因此需要建立快速準確的定量檢測方法。
液相色譜串聯質譜聯用技術近年來進展較大。該技術是高效液相色譜和質譜技術的結合,具有選擇性強、靈敏度高、準確性好等特點[9-10],是目前公認最好的復雜樣品分析技術之一,已廣泛應用于生物醫藥、食品安全、環境科學、臨床等眾多領域[11-12],成為現代分析方法中必不可少的組成成分。
本研究基于液相色譜-質譜多反應監測技術(liquid chromatography-mass spectrometry/multiple reaction monitoring,LC-MS/MRM),建立了 cGAMP的定量分析方法,為進一步探討cGAS 的功能調控機制提供有力的技術支撐。
1 材料與方法
1.1 材料
組織細胞淋巴瘤細胞U937 來自本實驗室細胞庫;RPMI1640 培養基(邁晨公司);optiMEM 培養基(Gibco 公司);鯡魚精DNA(HT-DNA)、佛波醇12-十四酸酯13-乙酸酯(PMA)(Sigma 公司);逆轉錄試劑盒(TaKaRa 公司);IRF3、p-IRF3、βactin 單克隆抗體(Abcam 公司);轉染試劑 Li?po2000(Invitrogen 公司);SYBR Green 熒光定量試劑盒(ABI 公司);TRIzol Reagent、乙腈(Thermo?Fisher 公司);Qtrap6500 三重四極桿質譜儀;Ther?mo Ultimate 3000 雙三元液相色譜儀。
1.2 細胞培養
U937 細胞系在含10%胎牛血清的RPMI1640培養基中培養,恒溫培養箱設定參數為37℃、5%CO2。根據細胞狀態和密度,進行細胞傳代或其他實驗。
1.3 脂質體轉染
取對數生長期細胞,設定對照組(僅轉染試劑)和HT-DNA 刺激組(轉染試劑和HT-DNA),按3×105/孔的密度接種于 24 孔板,加 PMA 后于恒溫培養箱中培養36 h 使細胞分化。分化后,根據轉染試劑使用說明書推薦的體系進行HT-DNA 轉染,刺激6 h 后收樣。
1.4 RNA提取及熒光實時定量PCR實驗
TRIzol 法提取細胞總RNA,根據逆轉錄試劑盒說明書進行逆轉錄反應。將熒光實時定量PCR(qRT-PCR)反應體系在96 孔板中混勻,每個樣本和待測目的基因設3 個復孔,800 r/min 離心5 min,于熒光實時定量PCR 儀中反應(反應條件:95℃預變性 5 min,95℃變性 15 s,60℃退火30 s,72℃延伸 1 min,共 40 個循環)。2-ΔΔCt表示目的基因在對照組和實驗組中表達的倍比關系。引物信息見表1。
1.5 蛋白質提取及蛋白質免疫印跡實驗
吸去24 孔板中的培養基,用PBS 緩沖液洗滌2 次,加入細胞裂解液后,4℃混旋 30 min,4℃、15 000 r/min 離心20 min,收集上清,加入上樣緩沖液,沸水煮樣后進行SDS-PAGE,采用濕轉方式進行轉印,室溫封閉1 h,在4℃條件下用一抗(1∶1000)孵育過夜,次日從4℃條件下取出膜,TBST緩沖液洗膜3 次,每次5 min,室溫孵育二抗(1∶5000)1 h,再 用 TBST 緩沖液 洗 膜 3 次 ,每 次 5 min,顯影。β-actin 作為內參。

表1 定量PCR引物信息
1.6 液相色譜-質譜聯用技術檢測cGAMP含量
吸去24 孔板中的培養基,PBS 緩沖液洗滌2次,加入萃取液(甲醇∶乙腈∶水按體積比4∶4∶2配制),用細胞刮刀輕輕將黏附在孔板上的細胞刮下來,收集至1.5 mL 離心管中,做好標記,并于-20℃條件下靜置 30 min,4℃、15 000 r/min 離心20 min,收集上清液,于真空干燥儀中干燥。用終濃度為10 mmol/L 的醋酸銨溶液稀釋商品化的cGAMP,作為標準樣品;用同樣濃度的醋酸銨溶解干燥的樣品,4℃、15 000 r/min 離心 10 min,收集上清,通過液質聯用技術進行定量分析。
色譜儀為Thermo Ultimate 3000;色譜柱為EC 150/2.0 NUCLEODUR C18 Pyramid(3 μm);流動相A 相為0.2%甲酸-水溶液,B 相為乙腈;流速0.4 mL/min,柱溫35℃,進樣量5 μL。在該流動相條件下,每個樣品在8 min 內分析完成。
質譜離子源為電噴霧離子源(ESI),檢測方式為多反應監測(MRM),離子化方式為正離子掃描。離子源參數:氣簾氣20 psi,噴霧電壓5500 V,霧化溫度 550℃,霧化氣 65 psi,輔助氣 65 psi,去簇電壓90 V,攝入電壓7 V,定量離子對母離子/子離子為675/524,定性離子對母離子/子離子為675/506、675/136。
1.7 統計學分析
采用SPSS16.0 統計學軟件進行統計分析,2組間數據的比較采用Studentt檢驗,當P<0.05 時認為差異有統計學意義。
2 結果
2.1 cGAMP定量標準曲線方程的建立
首先,我們對商品化的標準品進行定量檢測,建立標準曲線方程。用終濃度為10 mmol/L的醋酸銨溶液稀釋商品化的cGAMP 后上機檢測。如圖1 所示,橫軸為cGAMP 保留時間,縱軸表示離子強度(counts per seconds,cps),標準品cGAMP 濃度分別為 1、5、10、25、50、100 ppb(part per billion),1 ppb=1 μg/L。圖中 cGAMP 標準品滯留時間為4 min 且無明顯雜峰干擾,表明該方法可以對1~100 ppb 的cGAMP 進行定量檢測。根據標準品濃度、譜峰面積等數據,計算得到標準曲線y=2977.9x-1050.9,相關系數為1(圖2)。
2.2 細胞中cGAMP的定量檢測
cGAMP 是細胞應對外源DNA 入侵時由cGAS合成的小分子。正常生理條件下,細胞內不會產生cGAMP。因此,檢測活細胞產生的cGAMP,首先需要通過轉染外源DNA(HT-DNA)激活cGAS;再通過甲醇-乙腈萃取法,提取細胞中的cGAMP分子;將樣品干燥后,用終濃度為10 mmol/L 的醋酸銨溶液溶解樣品,上機檢測。結果顯示,與對照組相比,HT-DNA 處理組出現cGAMP 譜峰(圖3),根據標準曲線定量計算,得到cGAMP 的含量為400 pg/3×105細胞,即0.0013 pg/細胞(圖4)。
2.3 生物學效應評估
為進一步評價該化學檢測方法的可靠性,我們對細胞中cGAMP 產生后的常規生物學效應指標進行了檢測。干擾素調節因子3(IRF3)的磷酸化和IFN-β 的表達是cGAMP 產生后的下游事件。通過脂質體轉染,將HT-DNA 轉入U937 細胞,分別采用Western 印跡和實時熒光定量PCR(qRT-PCR)檢測IRF3 的磷酸化和IFN-β1 mRNA的表達。結果顯示,與轉染試劑對照組相比,HTDNA 誘導了 IRF3 的大量磷酸化(p-IRF3);同時HT-DNA 刺激組 IFN-β1 的 mRNA 表達水平明顯升高(P<0.0001)(圖5),這表明在 HT-DNA 刺激條件下,細胞內合成了大量cGAMP 分子。
以上結果表明,上述化學檢測方法可以有效地對細胞內合成的cGAMP 進行快速、準確定量,并且通過檢測下游生物學效應,進一步驗證了該方法的可靠性。
3 討論
液相色譜質譜聯用技術在混合物分析上具有較高的靈敏度和選擇性及廣泛的適用性,并且應用此技術檢測細胞內cGAMP 的含量時,前期樣品的提取、純化和濃縮等過程較為簡便,便于掌握實驗操作。同時我們在建立該體系方法時,不斷優化各項條件參數[12],比如采取合適的樣品處理方法,優化實驗參數得到最佳色譜分析條件和質譜分析條件,盡可能消除基質效應對樣品定量測定的影響;選擇多反應檢測模式,提高信噪比,即使復雜的樣品仍可達到很高的靈敏度。由此,不僅得到了可靠性高的結果,而且檢測時間也較短,每個樣品的分析時間可以控制在8 min 以內,快速簡便。在建立檢測方法的同時,我們也對細胞中cGAMP 產生后的常規生物學效應指標進行了檢測,如IRF3 的磷酸化、β干擾素的產生等,利用生物學效應與化學檢測方法相互驗證,證明了該方法的可靠性。cGAMP 的表達量可以特異性指征cGAS 的活性,因此基于液質聯用技術對cGAMP 進行定量檢測方法的建立,為后續深入研究cGAS 活性調控機制提供了重要手段。
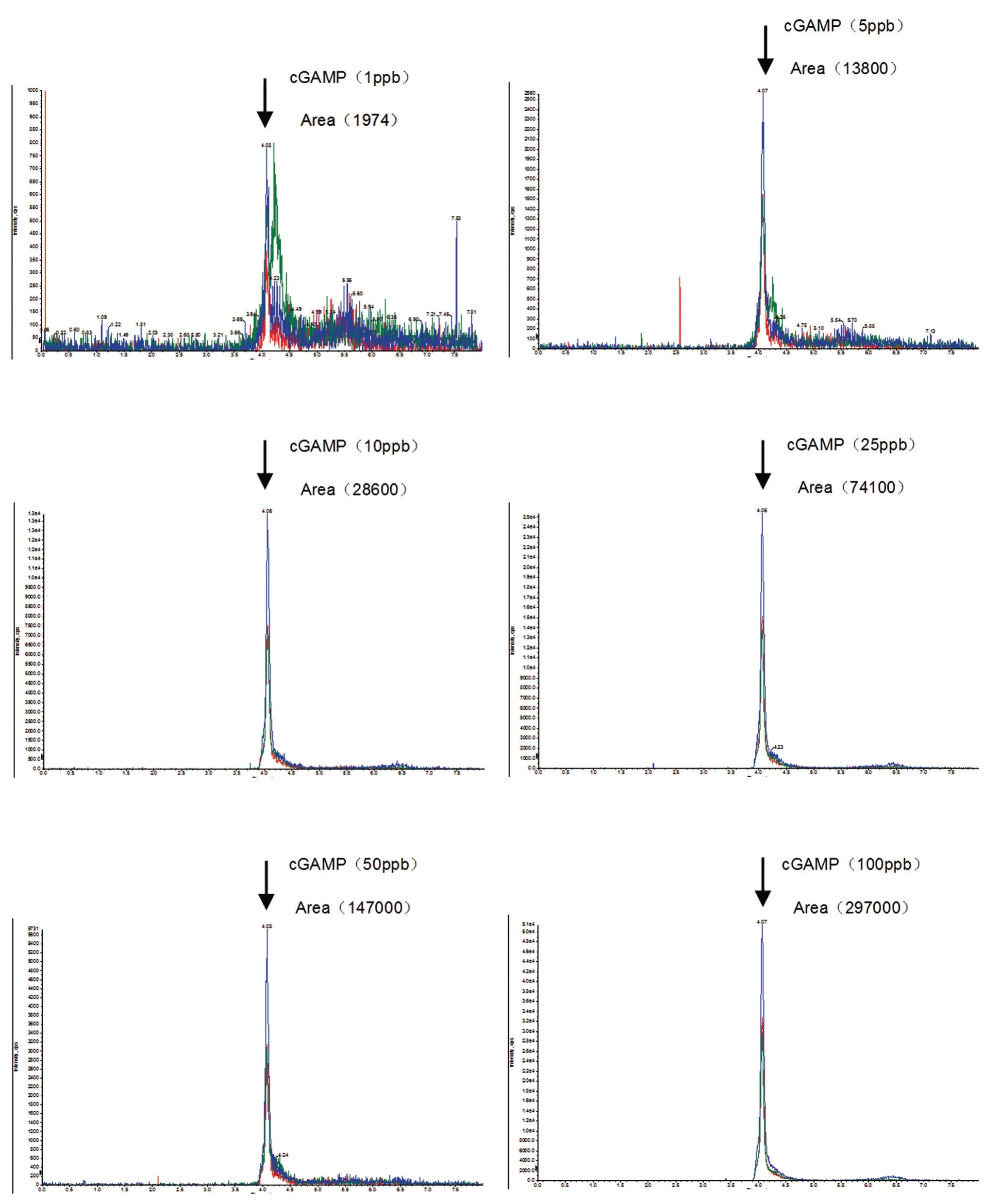
圖1 cGAMP 標準品質譜峰圖
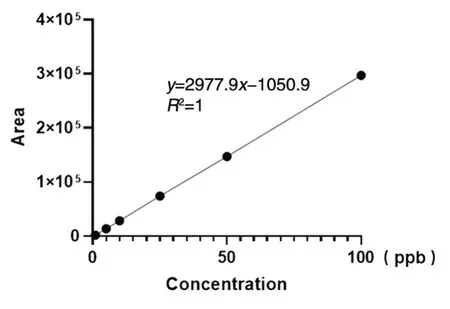
圖2 cGAMP 定量標準曲線
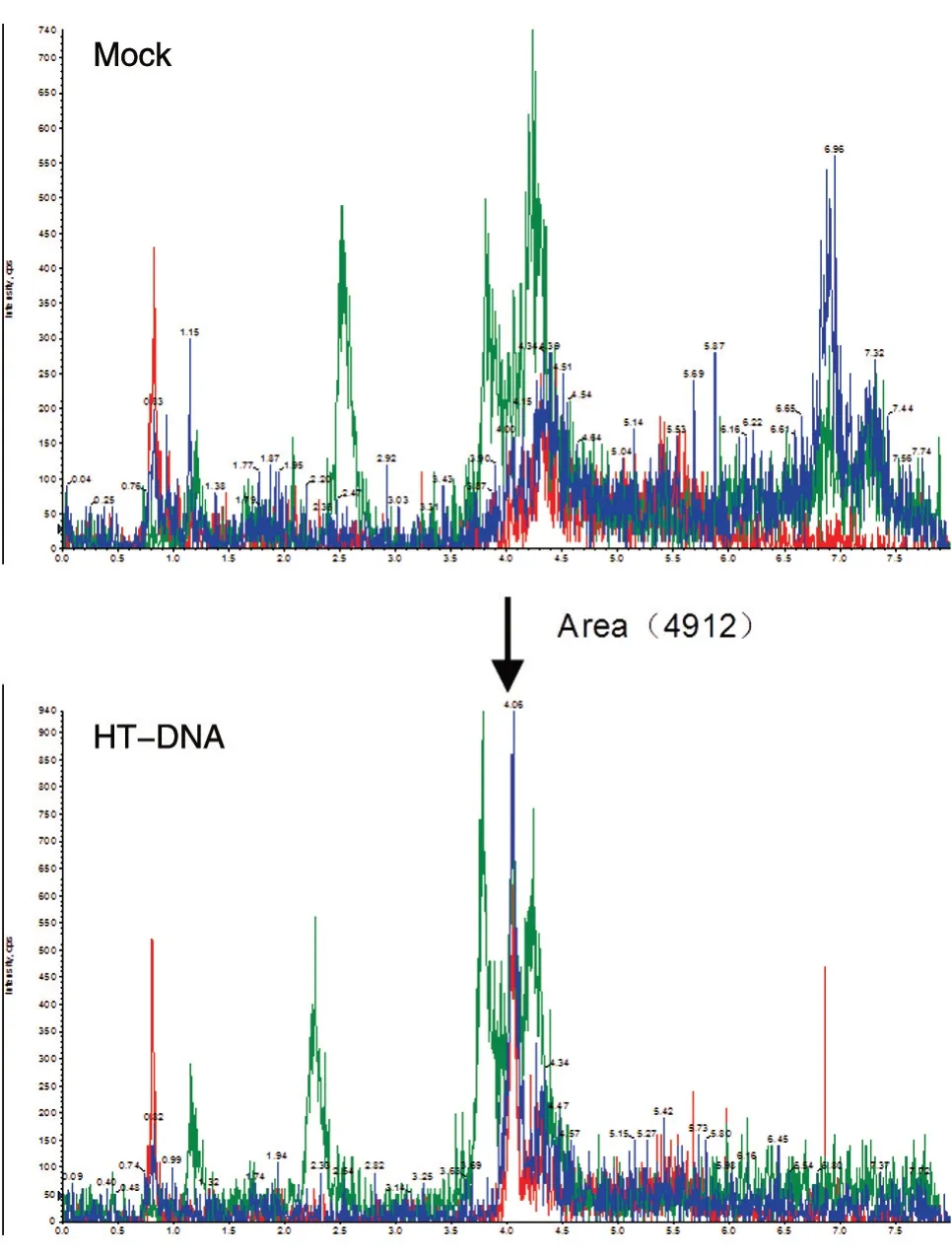
圖3 cGAMP 質譜鑒定峰圖
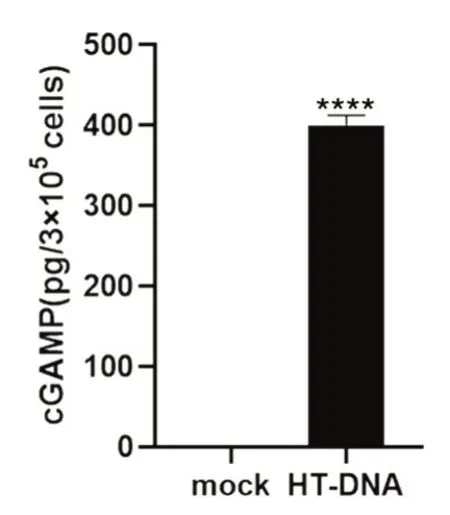
圖4 cGAMP 定量計算(****P<0.0001)

圖5 IRF3 磷酸化與IFN-β1 mRNA 的表達(****P<0.0001)
目前,針對cGAMP 的作用和功能的研究還非常有限,尚有許多問題亟待解決。比如cGAMP 除參與天然免疫信號通路外是否在其他通路發揮作用?細菌中的第二信使c-di-GMP 和c-di-AMP是否在哺乳動物細胞中具有相似的作用?該技術方法可實現更加快速、靈敏和可靠的cGAMP 檢測,為科學研究和實際應用提供更多依據。

