CT 衰減校正在99mTc-GSA SPECT 肝成像的應用分析
李 燦,邵明哲,項燦宏,杜 磊,劉 猛,程 諾,徐白萱
1 解放軍醫學院,北京 100853;2 解放軍總醫院第一醫學中心 核醫學科,北京 100853;3 北京清華長庚醫院 肝膽外科,北京 102218
原發性肝癌是常見的惡性腫瘤之一,發病中位年齡為40 ~ 50 歲,男性多于女性,近年來其發病率有增高趨勢[1]。目前,手術切除仍是治療原發性肝癌首選及最有效的方法。但由于大多數肝癌患者存在肝硬化,對肝功能造成不同程度的損傷,增加了術后肝衰竭的發生率。因此,對于肝功能受損不均一的患者,術前對未來殘余肝功能的估計尤其重要。國外多項研究報道,核醫學利用99m 锝標記的乙二烯三胺五醋酸-半乳糖人血清白蛋白(99m technetium-labelled diethylenetriamine pentaacetic acid-galactosyl human serum albumin,99mTc-GSA)進行SPECT 顯像,測定肝的儲備功能具有獨特的優勢[2-4]。早期99mTc-GSA SPECT 顯影主要為平面顯像,常用的參數包括肝攝取率(LHL15)、血液清除率(HH15)、受體數(RO)、藥物攝取速率常數(KL)等,用于預測肝纖維化、慢性肝炎肝硬化及急性肝衰竭患者的生存率,后期也應用于肝切除及肝移植患者肝功能評估[3-8]。這些指標反映的是全肝功能,而不是預留肝功能,術后肝衰竭與預留肝儲備功能的關系更大,因此區域功能的評估顯得更為重要。后期引入肝斷層顯像,評估肝功能常用參數包括功能性肝體積(functional liver volume,FV)、肝攝取率、肝攝取密度等[2,9-10],可以勾畫不同的感興趣區(region of interest,ROI)評估區域肝功能,對肝功能變化及肝損傷程度有明顯的指示意義。文獻報道圖像重建方法存在差異,本研究的主要目的是探討CT 衰減校正對99mTc-GSA SPECT 肝成像及后期數據分析的影響。
資料和方法
1 資料 選取2017 年3 月- 2018 年8 月解放軍總醫院第一醫學中心核醫學科完成99mTc-GSA SPECT/CT 動態顯像的伴有肝硬化的肝細胞肝癌患者24例,其中男性17 例,女性7 例,平均年齡37 ~ 67(50.94±9.22)歲。所有參與者或其家屬均簽署書面知情同意書。記錄患者常規肝功能血清生化指標,包括血白蛋白(albumin,ALB)、總膽紅素(total bilirubin,T-BIL)、血小板計數(platelet,PLT)、凝血酶原活動度(prothrombin activity,PTA)、凝血酶原時間(prothrombin time,PT)、凝血酶原時間國際標準化比值(international normalization ratio,INR)等。
2 吲哚菁綠(indocyanine green,ICG) 試驗 ICG排泄試驗是為了檢測肝儲備功能,常用指標為ICG血漿清除率(ICG-K)和ICG 15 min 滯留率(ICG-R 15)[11-13]。用5 ml 0.9%氯化鈉注射液注入ICG 試劑(25 mg/瓶,沈陽濟世制藥有限公司),配置成5 mg/ml 的ICG 溶液,清晨患者禁食8 h 后平臥,以無菌棉球清洗鼻翼后連接感光探頭。按照0.5 mg/kg 劑量給藥,經肘正中靜脈注入。脈沖式色素濃度圖像分析儀(日本光電工業株式會社生產)自動檢測出ICG-R15、ICG-K,并導入DDG分析軟件(儀器配套處理軟件)處理與保存。
399mTc-GSA SPECT 成像 向無菌GSA 藥瓶(3 mg GSA,北京師范大學師宏藥物研制中心)內注射5 mCi 99m 锝原液(中國原子能高科技有限公司)及1.5 ml 0.9%氯化鈉注射液,充分震蕩后后靜置10 min,得到99mTc-GSA,放化學純度>95%。使用德國西門子Symbia T6 雙探頭單光子發射計算機斷層儀(SPECT/CT),受試者禁食,取仰臥位,雙上臂抱頭,肝位于雙探頭視野中心。先進行CT掃描,范圍為心臟上緣至肝下緣。CT 掃描采集參數:管電壓130 kV,管電流120 mAs,采集層厚6.0 mm×2.0 mm,螺距1.0。重建參數:層厚5 mm,層間距5 mm,矩陣512×512。SPECT 采集使用低能高分辨準直器,雙探頭處于平行位置,靜脈彈丸注射99mTc-GSA,立即啟功動態斷層采集程序。采集條件:能峰140 keV,窗寬20%,矩陣128×128,Zoom 1。雙探頭距旋轉中心26 cm 固定,上下探頭同時圍繞肝旋轉180°連續采集,旋轉時間為1 min。第一階段25 min,每1 min 1 幀,采集25 幀;第二階段5 min,5 min 1 幀,旋轉5 圈采集1 幀。重建方法:使用兩種重建條件對所有圖像進行重建,一組使用CT 進行衰減校正,另一組未使用CT 衰減校正,其他重建條件相同,均進行Flash 3D 迭代重建,迭代次數8,子集4,使用Gaussian 濾波,濾波核12,進行散射校正。如圖1所示。
4 SPECT 圖像數據提取 首先提取出第26 幀圖像中全肝的最大像素計數值,以最大像素計數值的54%、80%為界值,分別畫3D 等高線ROI 并提取總計數(圖2)。隨后將ROI 復制到前25 幀動態斷層圖像上,得到兩種重建方法的時間-總計數曲線。以藥物注射的時間為起點,對提取的時間-總計數曲線進行99mTc 核素衰變校正,同時換算為時間-計數率曲線。藥物攝取速率常數K[8]:使用非線最小二乘法,以C(t)=Cmax(1-e-kt)函數擬合各ROI 區域的時間(t)-計數率(C(t))曲線,K=ln2/(T 1/2)=0.693/(T 1/2),k=-ln(1-A/Ao)/t,計算參數K,從而得到肝細胞的藥物攝取速率常數GSA-K 值,兩次重建方法計算的值分別記為GSA-KNAC(未使用CT 衰減校正)、GSA-KAC(使用CT 衰減校正)。

圖 1 63歲男性患者,查體發現肝占位1個月余。同一患者第26幀SPECT/CT圖像,上排為SPECT (NAC)及CT橫斷面融合圖像,下排為SPECT (AC)及CT橫斷面融合圖像Fig. 1 The 26th frame of SPECT/CT images of a 63-year-old male patient with one liver mass detected at one month before. The upper row is SPECT (NAC) and CT cross-sectional fusion image, and the the lower row is SPECT (AC) and CT cross-sectional fusion image
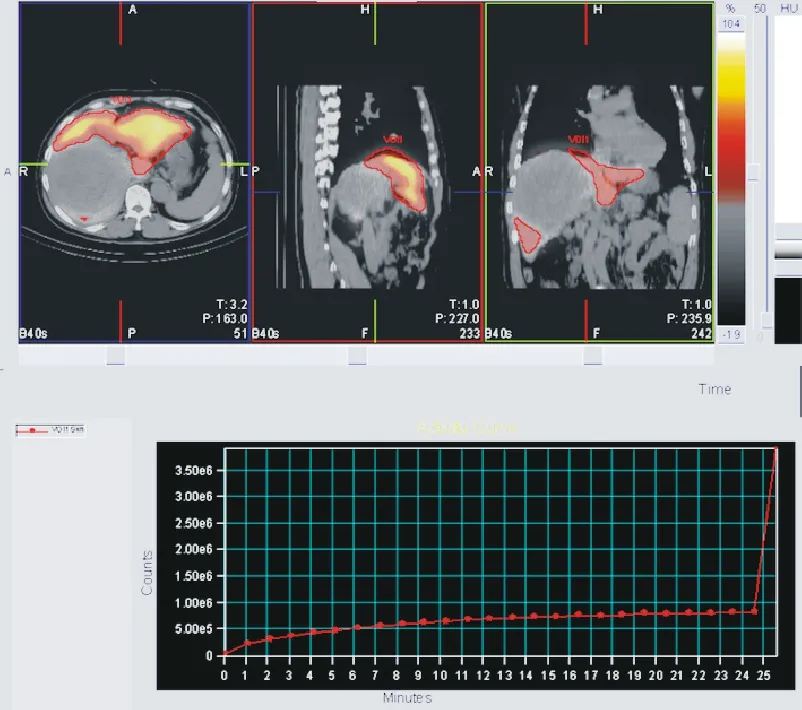
圖 2 以54%為界值畫3D等高線ROI并提取總計數Fig. 2 3D ROI is drawn with the threshold of 54% and the total count is extracted
FV:對肝功能受損的病人,研究認為以全肝最大像素計數值54% ~ 80%為界值的ROI 區域內肝細胞具有功能,即其相應的解剖體積等于其功能體積[8]。以此假設為基礎,以單位功能體積肝的藥物攝取量相等為條件計算各ROI 區域內的等效體積,計算每公斤體質量(W)的功能體積FV(單位cm3/kg),FV=V54%ROIC54%mean/C80%meanW,兩次重建方法計算的值分別記為GSA-FVNAC、GSA-FVAC。
5 統計分析 應用SPSS21.0 統計軟件進行分析。正態分布的資料以±s 表示。不同計算方式得出的GSA-K、GSA-FV 值比較采用配對t 檢驗,Pearson 相關分析比較不同重建方法計算得到的肝攝取速率常數GSA-K、功能性肝體積GSA-FV 與ICG、肝血清生化學指標之間的相關性。
結 果
1 肝功能評估情況 3 例患者ALB 降低,6 例患者T-BIL 升高,9 例患者PLT 降低,1 例患者PLT升高,3 例患者PTA 降低,21 例患者PT 升高,見表1。
2 兩種重建方法差異比較 根據前述方法分別計算衰減校正前后GSA-K 及GSA-FV 值,GSA-KNAC為0.21±0.06,GSA-KAC為0.20±0.06,兩者差異無 統計學意義(t=-0.32,P=0.75)。GSA-FVNAC為10.00±2.81,GSA-FVAC值為12.64±3.31,兩者差異有統計學意義(t=-5.61,P <0.001),見圖3。
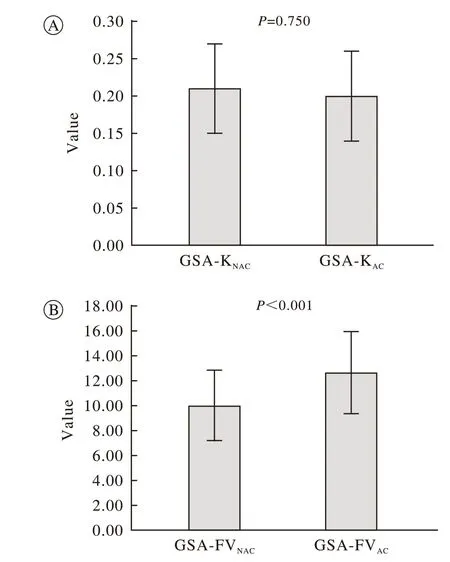
圖 3 有無衰減校正組間GSA-K (A)、GSA-FV (B)的比較Fig. 3 Comparison of GSA-K(A), GSA-FV(B) between with attenuation correction and without attenuation correction
3 校正后GSA-K 值、校正前后GSA-FV 值與肝功能及ICG 指標的相關性 GSA-KAC與INR、PLT、PTA、PT、ICG-R15、ICG-K 有 相 關 性,GSAKAC與ICG-K 相關性最高。GSA-FVNAC與臨床其他肝功能指標均無相關性。GSA-FVAC與T-BIL、ICG-R15 有相關性,見表2。
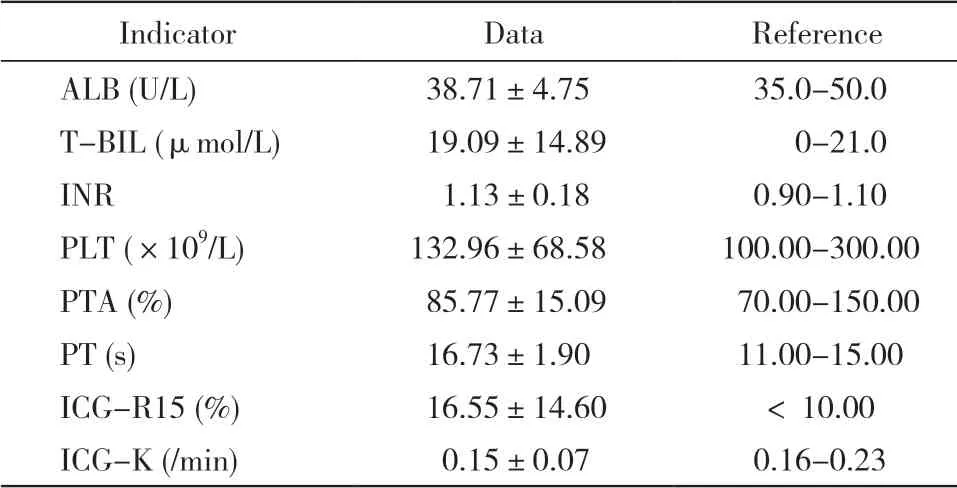
表1 患者血清生化指標及ICG 檢測結果Tab. 1 Results of serum biochemical indices and ICG test in patients

表2 GSA 相關值與其他肝功能指標相關性分析Tab. 2 Correlation analysis between GSA value and other liver function indices
討 論
SPECT 和CT 集成系統已廣泛應用于我國臨床十多年。這種SPECT/CT 集成系統可以獲得具有良好配準的SPECT/CT 融合圖像。SPECT/CT 融合成像的良好配準非常重要。首先,我們可以對重建的SPECT 圖像進行基于CT 的衰減校正。肝形態不規整,肝周圍區域很復雜。因此,基于CT 的衰減校正方法優于其他方法,從而保證了良好的定量指標[14]。其次,我們可以將解剖信息添加到SPECT圖像中,可以精準地畫出肝輪廓。盡管SPECT 圖像包含三維信息,但這不足以精確評估與手術相關的區域功能。最新的SPECT/CT 集成系統具有多層螺旋CT,利用該系統可以對動態SPECT 圖像和CT 圖像進行融合成像[15]。有關研究發現,融合圖像不僅解決了空間分辨率的問題,同時基于CT的衰減校正為SPECT 獲得更好的定量信息提供可能[16]。借此定量SPECT 于術前便可預測術后肝功能狀態,為安全的肝切除手術提供保障[14]。
99mTc-GSA 顯像有助于評估肝功能和肝儲備功能。利用SPECT/CT 系統可以獲得99mTc-GSA SPECT 及CT 融合成像,配準誤差小。根據99mTc-GSA 閃爍掃描技術計算的GSA-K、GSA-FV 等指標對評價肝、區域肝功能和儲備功能具有重要意義[8-9,17-18]。為了用99mTc-GSA SPECT/CT 準確評估肝功能,掃描圖像的質量對于維持指標的定量至關重要。然而,獲得圖像的采集及重建方法并不相同。文獻報道重建分為兩種,一種使用Chang's(固定衰減常數)進行放射性核素γ 光子的衰減校正[8],一種未使用衰減校正[17],部分文獻重建方法未提及衰減校正[9,18],作為定量指標,有必要評估重建方法中衰減校正對SPECT 成像的影響。本研究分別計算有無衰減校正進行SPECT 圖像重建得到的GSA-K 及GSA-FV 值,發現兩種重建方法的得到的GSA-K 值無統計學差異(P=0.48),比較其與肝血生化檢測及ICG 指標的相關性,GSA-K與臨床肝功能生化指標(INR、PLT、PTA、PT)、ICG-R15、ICG-K 有相關性,其中與ICG-K 相關性最高(r=0.81)。而兩種重建方法的得到的GSAFV 值有統計學差異(P <0.01),GSA-FVNAC與臨床生化指標、吲哚箐綠試驗均無相關性,重建方法使用CT 衰減校正后,影響定量指標GSA-FVAC,其與T-BIL、ICG-R15 呈現出相關性(r=-0.58、-0.53)。筆者認為,有無衰減校正主要影響肝的整體放射性計數,GSA-K 值反映的是藥物攝取速率,因此不受衰減校正的影響,而GSA-FV 值計算方法與肝區域的放射性計數明顯相關,所以GSA-FVNAC與GSA-FVAC存在明顯差異,文獻報道GSA-FV 也能反映肝儲備功能,但本研究中GSAFVNAC與肝血清學指標及吲哚箐綠試驗數值均不相關,而經過CT 衰減校正后GSA-FVAC能夠反映肝的功能。動態閃爍圖像是由伽馬照相機獲得的,當一個大腫瘤位于肝的前面或側面時,單獨SPECT 采集有時會低估整個肝的計數[16]。CT 數據既可以提供衰減校正以進行放射性核素重建,又可以提供解剖信息,清晰顯示肝腫瘤的位置以及大小。本研究的局限性主要包括:1)主要研究圖像重建方法對肝功能定量指標的影響,未能比較不同采集條件對圖像數據的影響,而且只研究了原發性肝癌患者。2)組合式SPECT/CT 系統應用CT 對99mTc-SPECT 成像進行衰減校正,使患者增加了額外的輻射。
綜上所述,通過99mTc-SPECT 及CT 融合成像評估肝功能,分析比較不同重建方法對數據的影響,有無CT 衰減校正GSA-K 值無統計學差異,未經CT 進行衰減校正得到的GSA-FV 值不夠準確,而經CT 進行衰減校正得到的GSA-FV 值是準確的,并且能夠反映肝功能。GSA-K、GSA-FV 可以評價肝功能,與臨床其他肝功能指標有很好的相關性,有助于對術前肝儲備功能進行評估,指導手術及治療方法的選擇。

