葫蘆素B 固體分散體的制備
程佳慧武 倩劉喜綱
(承德醫學院中藥研究所,河北省中藥研究與開發重點實驗室,河北 承德067000)
葫蘆素B 是葫蘆科植物中提取分離得到的一種四環三萜類化合物[1],用于治療肝炎、肝癌等[2],對卵巢癌[3]、乳腺癌[4]、胃癌[5]、肺癌[6]、直腸癌[7]等,表現出良好的藥理作用,有望成為有效的抗腫瘤藥物,但它在生物藥劑學分類系統中為第Ⅳ類藥物,即低溶解性-低滲透性藥物,在水中溶解度僅為22 μg/mL,絕對生物利用度僅為1.37%[8],極大程度限制了臨床應用。目前,葫蘆素B 劑型有磷脂復合物[9-10]、水-醇凝膠[11]、脂肪乳注射劑[12]、納米混懸凝膠劑[13]、固體脂質納米粒[14-15]、納米膠束[16]等,其中固體分散技術簡單可行,易實現工業化生產。
固體分散體是指藥物以分子、膠態、微晶或無定形狀態分散在適宜載體材料中形成的固體分散體系,對藥物溶出度、生物利用度均有顯著提高。本實驗采用溶劑法制備葫蘆素B 固體分散體后,通過結晶抑制實驗篩選載體,對其溶出度進行考察,再通過SEM、XRD 等進行物相表征,以期為相關新劑型研發提供參考。
1 材料
Agilent 1260 高效液相色譜儀(美國Agilent 公司);AG-254 電子分析天平、STARe SW 11.00 熱分析儀(瑞士梅特勒-托利多公司);RC806 溶出試驗儀(天津市天大天發科技有限公司);SU8020掃描電鏡(日本日立公司);Nicolet 6700 紅外光譜儀(美國Thermo Nicolet 公司);D8-Advance X 射線衍射儀(德國Bruker 公司);KQ-1000E 超聲波清洗器(昆山市超聲儀器有限公司)。
葫蘆素B 對照品(中國食品藥品檢定研究院,批號111945-201301);交聯聚乙烯吡咯烷酮(北京鳳禮精求醫藥股份有限公司,批號95314575L0);PEG-4000(天津市光復精細化工研究所,批號20160310);低取代羥丙基纖維素(湖州展望藥業,批號20160346);PVPk30(德國BASF 公司,批號G53326PT0)。乙腈、磷酸為色譜純(美國邁瑞達公司);其他試劑均為分析純;水為蒸餾水。
2 方法與結果
2.1 樣品制備
2.1.1 固體分散體 采用溶劑法。按一定比例精密稱取葫蘆素B、載體適量,溶于適量二氯甲烷中,超聲完全溶解后混勻,50 ℃下減壓,揮去二氯甲烷,待呈黏稠狀后取出置干燥器中干燥24 h,研成細粉,即得,密封保存。
2.1.2 物理混合物 按一定比例精密稱取葫蘆素B、載體適量,置于研缽中混合均勻,即得,密封保存。
2.2 處方篩選
2.2.1 色譜條件 C18色譜柱(250 mm×4.6 mm,5 μm);流動相乙腈-0.1% 磷酸(58∶42);體積流量1.0 mL/min;柱溫30 ℃;檢測波長228 nm;進樣量10 μL。
2.2.2 藥載比篩選 根據預實驗結果,選擇PVP K30 作為載體,按1∶3、1∶5、1∶7、1∶11 比例精密稱取葫蘆素B、載體適量,按“2.1.1”項下工藝制備固體分散體。按照2015 年版《中國藥典》 第四部通則中0931 項下“溶出度與釋放度測定法”下槳法測定溶出度,取樣品(相當于原料藥3 mg)適量置于900 mL 純水中,介質溫度(37±0.5)℃,轉速100 r/min,于5、10、15、20、30,45,60 min 各取樣2 mL,0.45 μm 微孔濾膜過濾,補加同體積等溫溶出介質,續濾液在“2.2.1”項下色譜條件進樣測定,結果見圖1。
由此可知,溶出60 min 時固體分散體累積溶出度明顯高于原料藥;隨著藥載比升高,累積溶出度也隨之增加,即1∶11 時溶出效果最優,與原料藥比較提高了277.2%,其次為1∶7。因此,選擇藥載比1∶11、1∶7 進行物相表征。

圖1 樣品溶出曲線Fig.1 Dissolution curves for samples
2.3 物相表征[17]
2.3.1 掃描電子顯微鏡(SEM)測定條件為電流10 mA,加速電壓5.0 kV,觀察原料藥、PVP K30、固體分散體(藥載比1∶7、1∶11)、物理混合物(藥載比1∶7、1∶11)外觀形貌和晶型結構,記錄圖像,結果見圖2。由此可知,原料藥(圖2A)以棱柱狀或錐狀結晶存在;PVP K30(圖2B)呈球狀或類球形,大小不完全相同;物理混合物(圖2D、2F)存在原料藥、PVP K30 球狀結構,表示只是藥物和載體的簡單混合;固體分散體(圖2C、2E)呈緊實的不規則團塊狀,與原料藥、PVP K30 顯微結構完全不同,而且原料藥晶體形狀消失。
2.3.2 傅里葉變換紅外光譜(FTIR)將原料藥、PVP K30、固體分散體(藥載比1∶7、1∶11)、物理混合物(藥載比1∶7、1∶11)與適量KBr 研磨、混勻后壓片,在4 000~500 cm-1波數范圍內進行掃描,結果見圖3。由此可知,原料藥存在2 個特征峰,分別是3 450 cm-1左右的羥基峰和1 718、1 693 cm-1處的酮基峰;PVP K30 由于共軛效應的存在,C=O 的伸縮振動峰向低頻方向移動,出現在1 655 cm-1左右;物理混合物在3 450 cm-1左右仍存在原料藥特征峰,同時PVP K30 C=O 的伸縮振動峰也清晰可見,表明它是兩者簡單疊加;固體分散體中原料藥羥基峰向低頻方向移動至3 420 cm-1,酮基峰由1 718、1 693 cm-1合并為單峰,向低頻方向移動而且峰變寬,與載體羰基峰基本重合,出現在1 650 cm-1處,未出現其他特征峰,表明原料藥與PVP K30 可能發生氫鍵相互作用。

圖2 樣品SEM 圖(×200)Fig.2 SEM images for samples(×200)
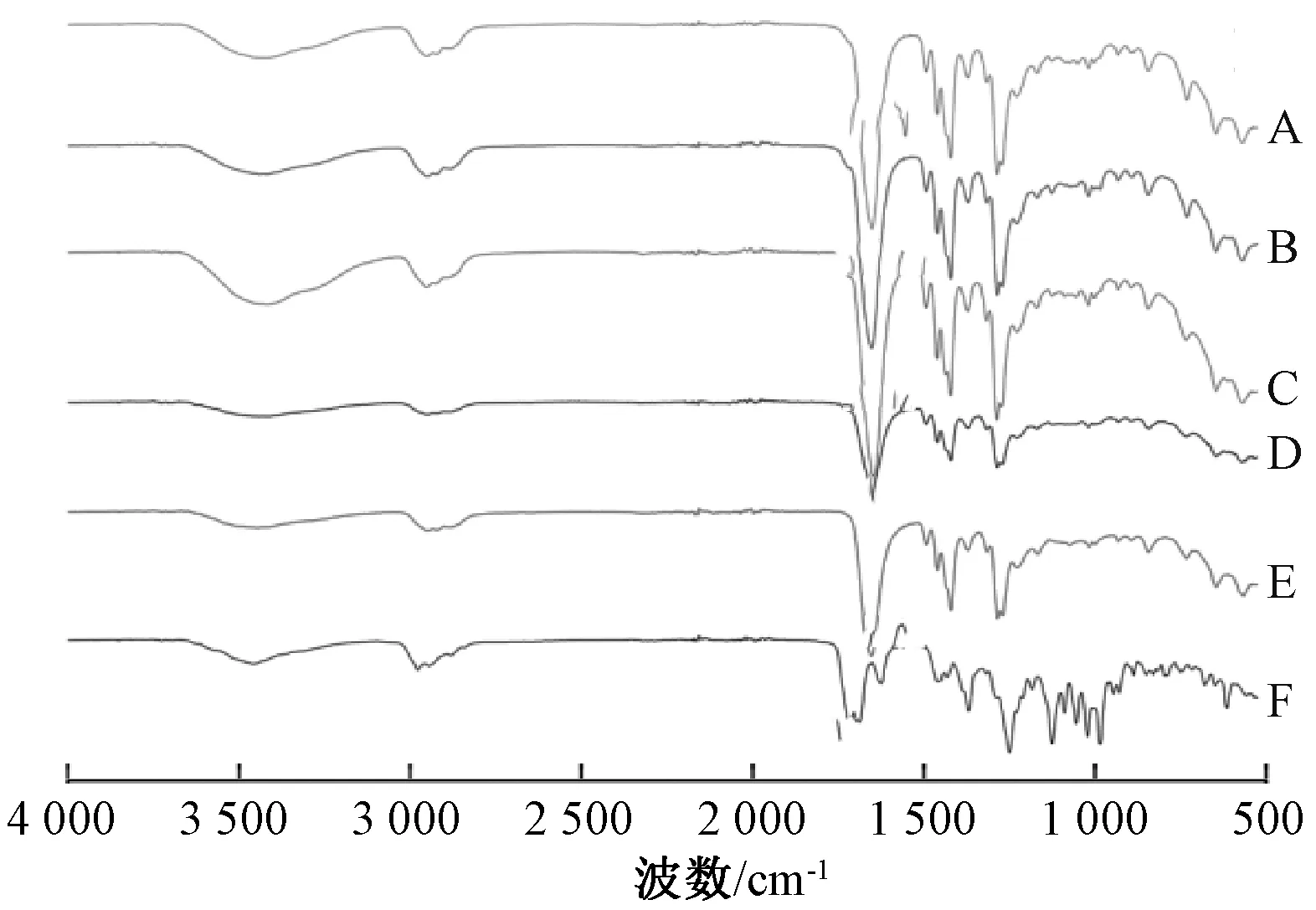
圖3 樣品FTIR 圖譜Fig.3 FTIR spectra for samples
2.3.3 差示掃描量熱(DSC)取原料藥、PVP K30、固體分散體(藥載比1∶7、1∶11)、物理混合物(藥載比1∶7、1∶11)適量,均勻放入鋁盤內,測定條件為升溫速度10 ℃/min,掃描溫度范圍30~400 ℃,樣品氣氮氣,結果見圖4。由此可知,原料藥特征熔點峰出現在181.57 ℃,與文獻報道一致;PVP K30 熔點峰出現在71.56 ℃;物理混合物中原料藥、PVP K30 特征熔點峰均存在,但前者強度變弱,表明其結晶度降低,但仍以晶體形式存在;固體分散體中未出現原料藥特征熔點峰,僅有PVP K30 的,表明原料藥晶型發生了改變。
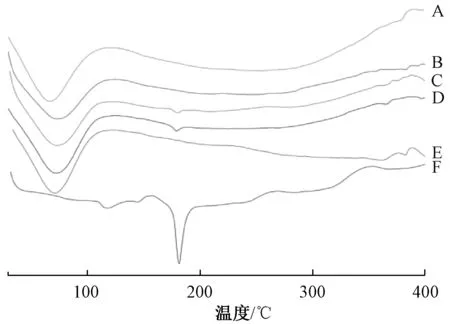
圖4 樣品DSC 曲線Fig.4 DSC curves for samples
2.3.4 X 射線衍射(XRD)取葫蘆素B、PVP K30、固體分散體(藥載比1∶7、1∶11)、物理混合物(藥載比1∶7、1∶11)適量,測定條件為波長(Cu 靶)1.540 6 nm,工作電流40 mA,工作電壓40 kV,掃描范圍3°~50°,結果見圖5。由此可知,原料藥在6.80°、7.22°、13.15°、13.60°、16.65°、17.62°、20.77°等處均存在晶體峰;PVP K30 峰較寬而平緩,無晶型結構存在,為無定形結構;物理混合物(藥載比1∶ 7)在7.22°、13.15°、16.69°、17.62°、20.77°仍可見強度變弱的原料藥特征峰,表明原料藥仍以晶體形式存在;物理混合物(藥載比1∶11)中原料藥特征峰不明顯,可能是其濃度較低所致;固體分散體中未發現原料藥晶體衍射峰,表明它可能以無定形狀態存在。
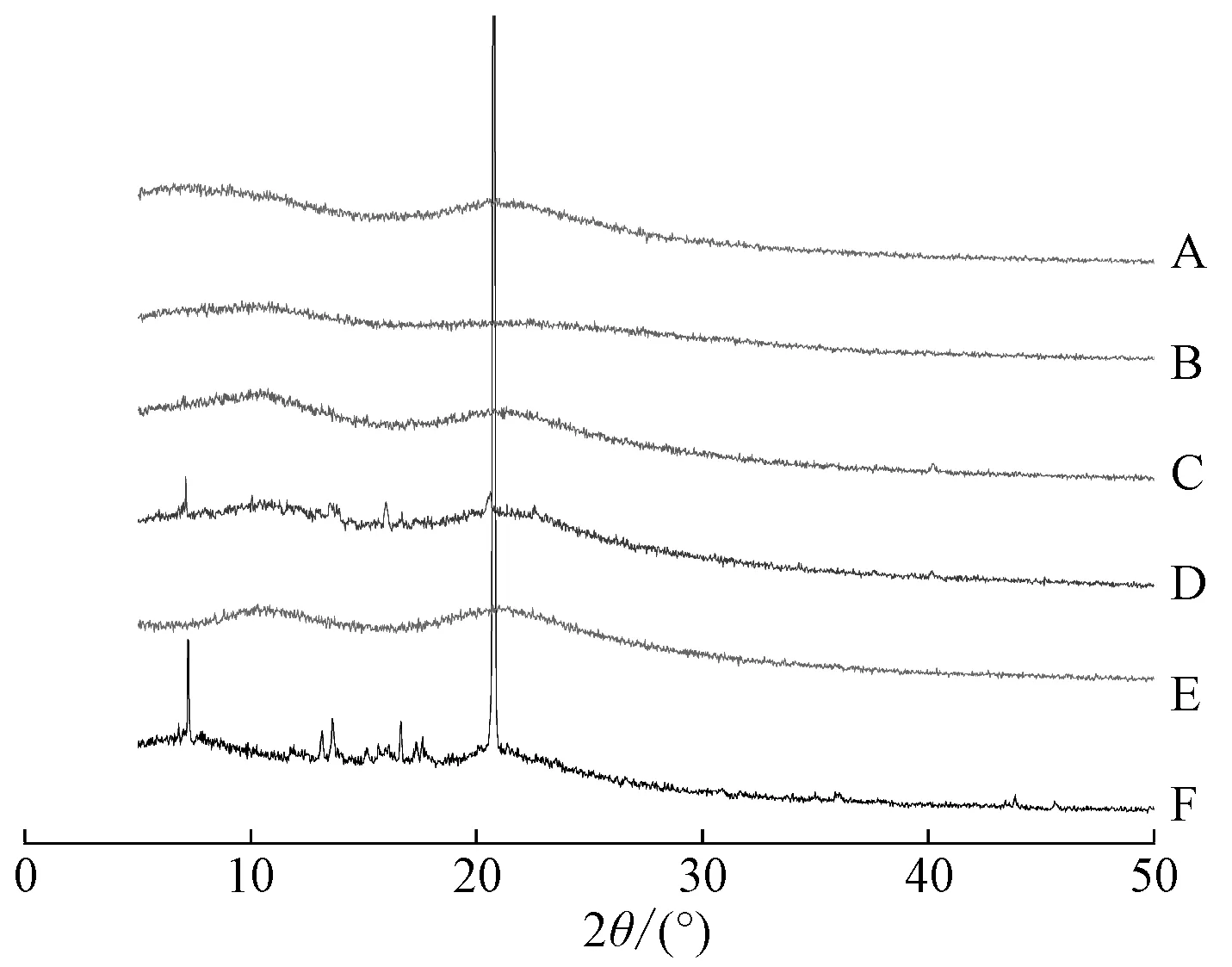
圖5 樣品XRD 圖譜Fig.5 XRD patterns for samples
3 討論
葫蘆素B 難溶于水,生物利用度較低,而將其制備成固體分散體時可在一定程度上改善這些問題。本實驗考察了PVPP、PEG-4000、低取代羥丙基纖維素、PVP K30 這4 種常用載體,通過比較四者抑晶效果,篩選出最佳載體為PVP K30。
制備固體分散體時選擇二氯甲烷作為溶劑,它對葫蘆素B 的溶解性較好,同時揮發性優于無水乙醇,故在制備過程中既能保證該成分和載體完全溶解,又可使溶劑用量較少。結果表明,葫蘆素B制成固體分散體后溶出度高于原料藥;在一定范圍內其溶出度隨載體比例的增大而升高,可能是因為它在載體PVP K30 中為無定形狀態,從而分散度得到提高;它可能以無定形狀態存在,改變了原有晶體結構,故在很大程度上提高了累積溶出度。
綜上所述,以PVP K30 為載體、1∶11 為藥載比時,葫蘆素B 固體分散體的體外溶出度顯著提高,對相關制劑開發具有一定應用價值。

