Pyrococcus yayanosii L-天冬酰胺酶在枯草芽孢桿菌中分泌途徑的鑒定及其分泌能力的提高
李 谞,徐書琴,張 顯,徐美娟,楊套偉,張惠玲,方海田,饒志明*
(1.江南大學 工業生物技術教育部重點實驗室,江蘇無錫214122;2.生物工程學院,江蘇無錫214122;3.寧夏大學 農學院,寧夏 銀川750021)
在利用微生物進行表達重組蛋白質的過程中,良好的分泌性能降低產品回收成本,是重組蛋白質能否進行工業生產的重要考量因素。為了滿足工業生產的需求,科研工作者們通過基因工程手段建立了許多提高分泌的策略[1-3]。其中,枯草芽孢桿菌由于缺少細胞外膜而具有良好的分泌能力[4],是分泌生物制品的理想宿主。同時,枯草芽孢桿菌還具有食品安全性[5]、基因信息清楚[6]、良好的生產技術和發酵基礎等特性,因此被廣泛應用于蛋白質、食品添加劑、抗生素的生物發酵制備當中。
在枯草芽孢桿菌中,根據分泌的蛋白質是否依賴信號肽,可以分為信號肽依賴的分泌途徑和不依賴于信號肽的分泌途徑。枯草芽孢桿菌中依賴信號肽分泌的途徑又分為以下4種[7]:Sec分泌途徑(General secretion pathway),原核微生物中主要的蛋白質分泌途徑,該類信號肽的最典型特征是C端氨基酸序列為Ala-X-Ala(X代表任何氨基酸),由Ⅰ型信號肽酶切割;Tat分泌途徑(Twin-arginine translocation pathway),其特征在于N端含有雙精氨酸(RR/KR)二級結構;ABC轉運途徑(ATP-binding cassette transporter),ABC轉運途徑僅用于細菌素等分子的輸出[8];假菌絲蛋白質輸出途徑(Pseudophilin pathway),假菌絲蛋白質輸出途徑參與枯草芽孢桿菌細胞感受態的形成[9]。在枯草芽孢桿菌胞外蛋白質組中的113種被鑒定的蛋白質中,約有15%的蛋白質缺少信號肽但依然被分泌到胞外培養基中[2]。這些不依賴于信號肽的蛋白質分泌途徑研究相對較少,其分泌機理尚無法完全解析,并且與經典分泌途徑有所不同,因此該分泌途徑被稱為非經典分泌途徑(non-classical protein secretion pathway)[10]。
L-天冬酰胺酶(L-Asparaginase,EC 3.5.1.1)能夠通過水解L-天冬酰胺脫氨基形成L-天冬氨酸和氨[11],其在醫療和食品行業中都具有重要的應用價值[12]。在醫療行業中,L-天冬酰胺酶能降解癌細胞代謝循環所必須的L-天冬酰胺,從而殺死癌細胞[13]。在食品行業中,L-天冬酰胺酶能通過分解潛在致癌物質丙烯酰胺的前體天冬酰胺來降低高溫、油炸食品中的丙烯酰胺含量[14-15]。
在課題組此前的研究中[16],我們已經在枯草芽孢桿菌中成功實現Pyrococcus yayanosiiL-天冬酰胺酶的高產發酵,與此同時,我們發現部分該酶能被枯草芽孢桿菌分泌到胞外,基于此,作者分析鑒定了Pyrococcus yayanosiiL-天冬酰胺酶在枯草芽孢桿菌中的分泌途徑,并通過添加信號肽及共表達分子伴侶的方式提高了其分泌水平。
1 材料與方法
1.1 實驗材料
E.coli和B.subtilis穿梭質粒pMA5、克隆宿主E.coliJM109、表達宿主B.subtilis168:由作者所在實驗室保存;限制性核酸內切酶、PrimeSTAR?HS DNA聚合酶和T4 DNA連接酶:購買自TaKaRa生物公司(大連,中國);小型質粒快速分離試劑盒、DNA提取試劑盒和Mini DNA快速純化試劑盒等:購自Sangon Biotech Co.,Ltd(上海,中國);質粒同源重組試劑盒(ClonExpress?MultiS One-Step Cloning Kit):購自Vazyme Biotech Co.(南京,中國);其余試劑為國產分析純。
1.2 實驗方法
1.2.1 重組質粒的構建以作者所在實驗室已構建含有Pyrococcus yayanosiiL-天冬酰胺酶基因(pyasnase)的重組質粒pMA5-pyasnase為模板[16],分別用引物F1&R1和F2&R2為模板分別克隆啟動子PHpaII和pyasnase,見表1。將獲得的啟動子PHpaII和pyasnasePCR產物分別用EcoRI&Eco RV和EcoRV&HindIII限制性核酸內切酶進行雙酶切,通過酶連的方式將啟動子PHpaII基因和pyasnas分別酶連于pMA5多克隆位點Eco RI&Eco RV和EcoRV&HindIII之間。以枯草芽孢桿菌168基因組為模板,分別用引物F3&R3-F13&R13分別擴增信號肽基因SPphoD、SPLipA、SPwapA、SPywbN、SPYmaC、SPpel、SPyvbx、SPlipB、SPnprE。利用同源重組試劑盒將攜帶有啟動子PHpaII和pyasnase同源臂的信號肽基因連接到PHpaII和pyasnase之間。嗜麥芽寡養單胞菌脂肪酶信號肽SPlips基因由上海生工Sangon Biotech Co.,Ltd(上海,中國)合成并連接到PHpaII和pyasnase之間。以枯草芽孢桿菌基因組為模板,分別用引物F12&R12和F13&R13擴增PrsA和DnaK,并用酶切酶連的方式連接到含有信號肽基因pMA5的BamHI&MluI間。將所得連接產物用熱激法轉入大腸桿菌E.coliJM109感受態細胞,挑選陽性轉化子,測序并檢測是否構建成功,抽提質粒,將質粒轉化入枯草芽孢桿菌Bacilus subtilis168感受態細胞中進行表達。

表1 引物序列表Table 1 Primers used in this study
1.2.2 L-天冬酰胺酶的表達和純化將重組枯草芽孢桿菌接種至含有終質量濃度為20μg/mL的卡那霉素的LB培養基中(NaCl 10 g/L,蛋白胨10 g/L,酵母浸出物5 g/L),于37℃、200 r/min培養12 h,作為種子液。取1 mL該種子液接種在100 mL的新鮮發酵培養基(蔗糖35 g/L,蛋白胨15 g/L,尿素0.8 g/L,玉米漿12 g/L,K2HPO42.612 g/L,KH2PO42.041 g/L,MgSO4·7H2O 1.845 g/L,NaCl 5 g/L,L-天冬酰胺1 g/L)中,并在相同條件下培養24 h,將擴培后的重組枯草芽孢桿菌細胞于4℃、10 000 r/min離心10 min,取上清液作為胞外粗酶液,用于胞外L-天冬酰胺酶酶活測定,并用Edman水解法降解,并用質譜進行蛋白質N端測序。取其細胞用裂解緩沖液(50 mmol/L Tris-HCl緩沖液,pH 8.0)重復洗滌細胞3次后,在細胞裂解緩沖液中加入6 mg/mL溶菌酶,4℃放置2 h,再于20 MHz、45%功率下,超聲處理細胞30 min。將所得細胞裂解物在12 000 r/min下離心25 min,收集上清液作為胞內粗酶液,用于胞內L-天冬酰胺酶酶活測定。
1.2.3 L-天冬酰胺酶酶活的測定L-天冬酰胺酶酶活測定采用Li等人所述的奈斯勒試劑顯色法進行,通過測定酶促反應所生成氨的量來計算酶促反應速率[16]。在95℃下對底物(1 mL的25 mmol/L L-天冬酰胺和50 mmol/L,pH 8.0 Tris-HCl混合物)進行預熱后,加入100μL酶溶液,反應進行10 min后加入100μL 15%的三氯乙酸(TCA)終止反應。反應后的混合物體系以20 000 r/min離心10 min,取200μL澄清上清液加入4.8 mL去離子水中,并加入200μL奈斯勒試劑反應,用分光光度計在450 nm處測量吸光度來檢測反應中釋放的氨的量。對照組在酶促反應前加入100μL的15%三氯乙酸提前終止反應,以除去由于高溫下L-天冬酰胺自水解帶來的誤差。酶活力單位定義:在酶的最適反應條件下,每分鐘內產生1μmol氨所需的酶量定義為1個酶活單位。
2 結果與討論
2.1 Pyrococcus yayanosii L-天冬酰胺酶分泌途徑的鑒定
利用食品安全菌株枯草芽孢桿菌分泌L-天冬酰胺酶具有良好的食品應用前景[16]。Pyrococcus yayanosiiL-天冬酰胺酶具有良好的熱穩定性,在85℃下的半衰期達到105 min,37℃儲藏1個月仍能保持90%以上的酶活,具有良好的應用潛能[17]。在此前的研究中,發現該酶在枯草芽孢桿菌中具有一定的分泌能力,搖瓶發酵24 h后,胞外和胞內酶活分別為23.31、65.72 U/mL,本研究對其分泌途徑進行了分析鑒定。
SignalP 4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)在線預測軟件能準確的預測信號肽切割位點,進而對信號肽進行預測[18]。我們通過SignalP4.1 Server對該酶信號肽進行了預測,見圖1。發現其整段氨基酸序列的切割位點值(C值)均較低,最高為0.213,未發現信號肽切割位點,說明該酶不具有典型的信號肽。同時,我們將胞外所得酶液體進行N端測序,發現分泌到胞外該酶N端序列(MRLLILGMG)與該酶蛋白N端初始氨基酸序列一致,說明該酶分泌過程中不存在信號肽的切割,再一次說明該酶的分泌不依賴于信號肽。
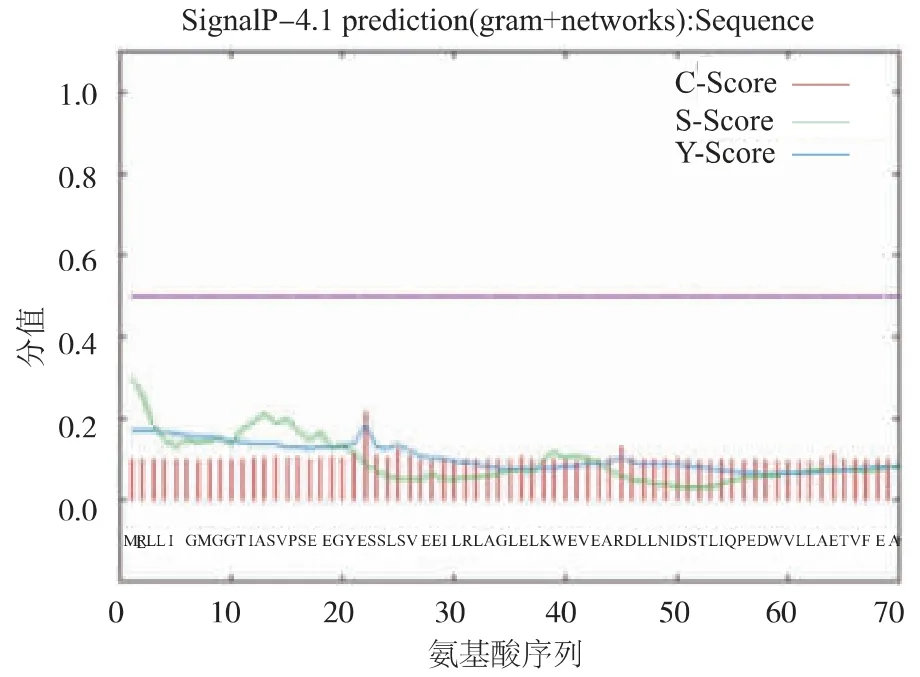
圖1 P.yayanosii L-天冬酰胺酶信號肽預測Fig.1 Signal peptideprediction of P.yayanosii Lasparaginases
在枯草芽孢桿菌胞外蛋白質組中的113種被鑒定的蛋白質中,約有15%蛋白質缺少了典型的信號肽,但依舊被分泌到胞外[19]。對于這些“分泌蛋白”,一些學者們認為可能是由于細胞裂解所導致的[20]。為了驗證該L-天冬酰胺酶的分泌是否由枯草芽孢桿菌裂解所致,我們監控了搖瓶發酵過程中胞外L-天冬酰胺酶的酶活情況,發現該酶在對數生長中期(發酵9 h)開始分泌,在穩定期胞外酶活也有所增加(圖2(a))。穩定期間枯草芽孢桿菌生物量不變,胞外酶活的增加說明細胞持續分泌該L-天冬酰胺酶,但也有可能是由于細胞裂解速率與生物量增加速率相一致導致的。為排除細胞裂解的影響,我們在細胞對數生長期的后半段(發酵12 h)添加終質量濃度為100μg/mL的氯霉素,抑制枯草芽孢桿菌的生長,此后9小時枯草芽孢桿菌的生物量未降低,說明細胞未出現裂解,而此段時間內,該L-天冬酰胺酶在胞外酶活依舊持續增加,說明該L-天冬酰胺酶在枯草芽孢桿菌中的分泌不是細胞裂解所引起的(圖2(b))。綜上所述,該L-天冬酰胺酶在枯草芽孢桿菌中的分泌是由于不依賴信號肽的非經典非經典分泌途徑(non-classical protein secretion pathway)進行分泌的。
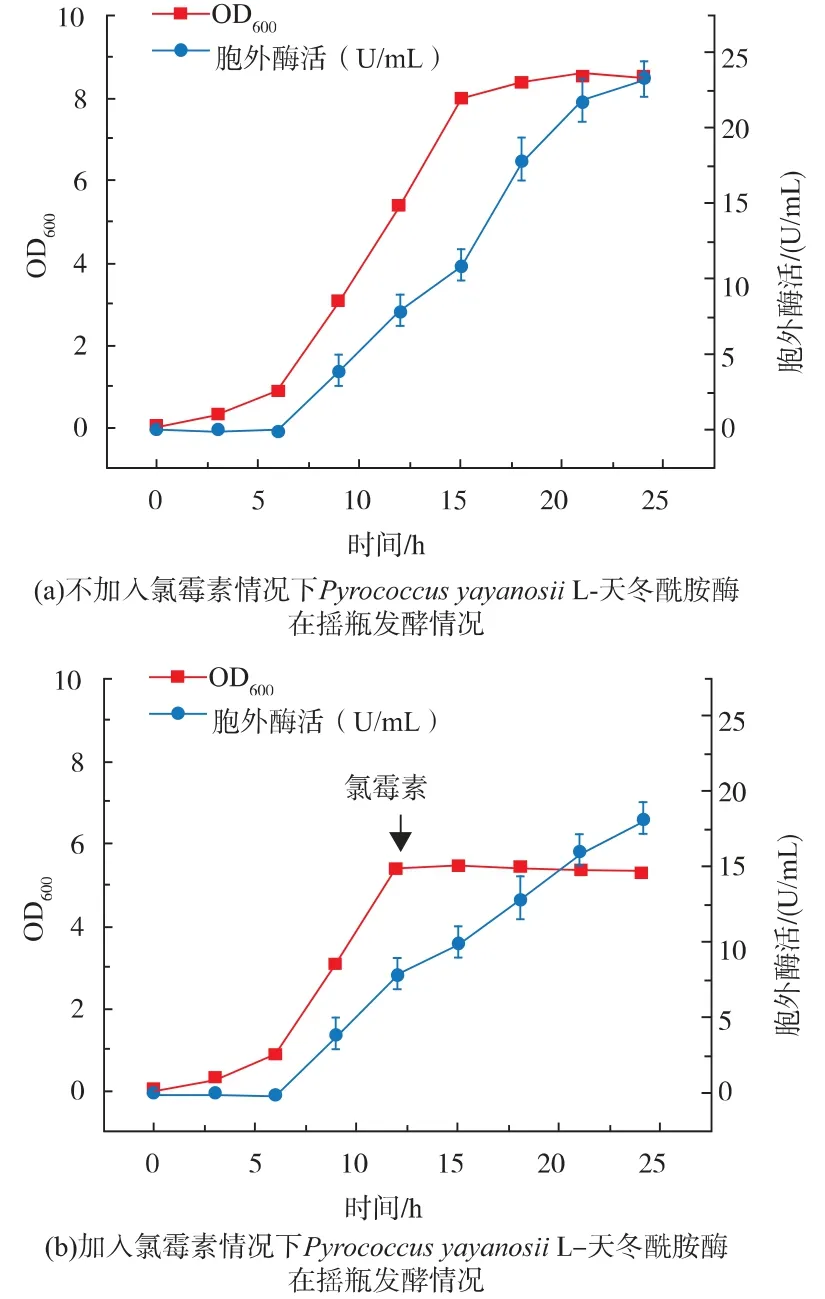
圖2 Pyrococcus yayanosii L-天冬酰胺酶搖瓶發酵情況Fig.2 Shake flask fermentation of Pyrococcus yayanosii L-asparaginase
2.2 信號肽對L-天冬酰胺酶分泌的影響
為了提高Pyrococcus yayanosiiL-天冬酰胺酶的分泌水平,我們研究了枯草芽孢桿菌來源的5種Tat途徑的信號肽(SPphoD、SPLipA、SPwapA、SPywbN、SPYmaC)和4種Sec途徑信號肽(SPpel、SPyvbx、SPlipB、SPnprE),以及1個嗜麥芽寡養單胞菌Sec途徑信號肽SPlips對該酶分泌的影響。
將啟動子PHpaII和L-天冬酰胺酶基因pyasnase分別連接到pMA5的EcoRI&Eco RV和EcoRV&HindIII酶切位點中,并利用同源重組將各信號肽基因連接到啟動子和pyasnase之間,構建新的重組質粒(圖3(a))。對胞外粗酶液進行酶活測定(圖3(b)),并進行SDS-PAGE分析(圖3(c)),發現Sec途徑的信號肽對L-天冬酰胺酶的分泌都具有一定的抑制作用,Tat途徑的信號肽對L-天冬酰胺酶的影響相對較小,其中SPphoD對該酶的分泌有一定促進作用,使該酶的分泌量從23.31 U/mL提高到30.03 U/mL,見表2。Sec途徑分泌途徑和Tat分泌途徑的一個重要差異在于Sec途徑分泌時先進行蛋白質分泌后再進行蛋白質折疊,而Tat途徑分泌時蛋白質先折疊形成正確構象后再通過信號肽分泌到胞外[21]。可能由于該L-天冬酰胺酶在枯草芽孢桿菌中迅速折疊,而Sec分泌途徑的信號肽無法正確介導已折疊好的蛋白質進行分泌,反而由于在該L-天冬酰胺酶的N端加入一段短肽抑制了其自身的分泌特性從而降低了該酶的分泌能力。同時從表2可看出,在提高胞外酶活的同時并未造成胞內酶活的降低,這可能該酶在枯草芽孢桿菌細胞內有一個“閾值”,當該酶的量達到此“閾值”時,該酶難以再在細胞內積累,因此將酶分泌到胞外對提高該酶在枯草芽孢桿菌中的表達也具有重要的研究意義。
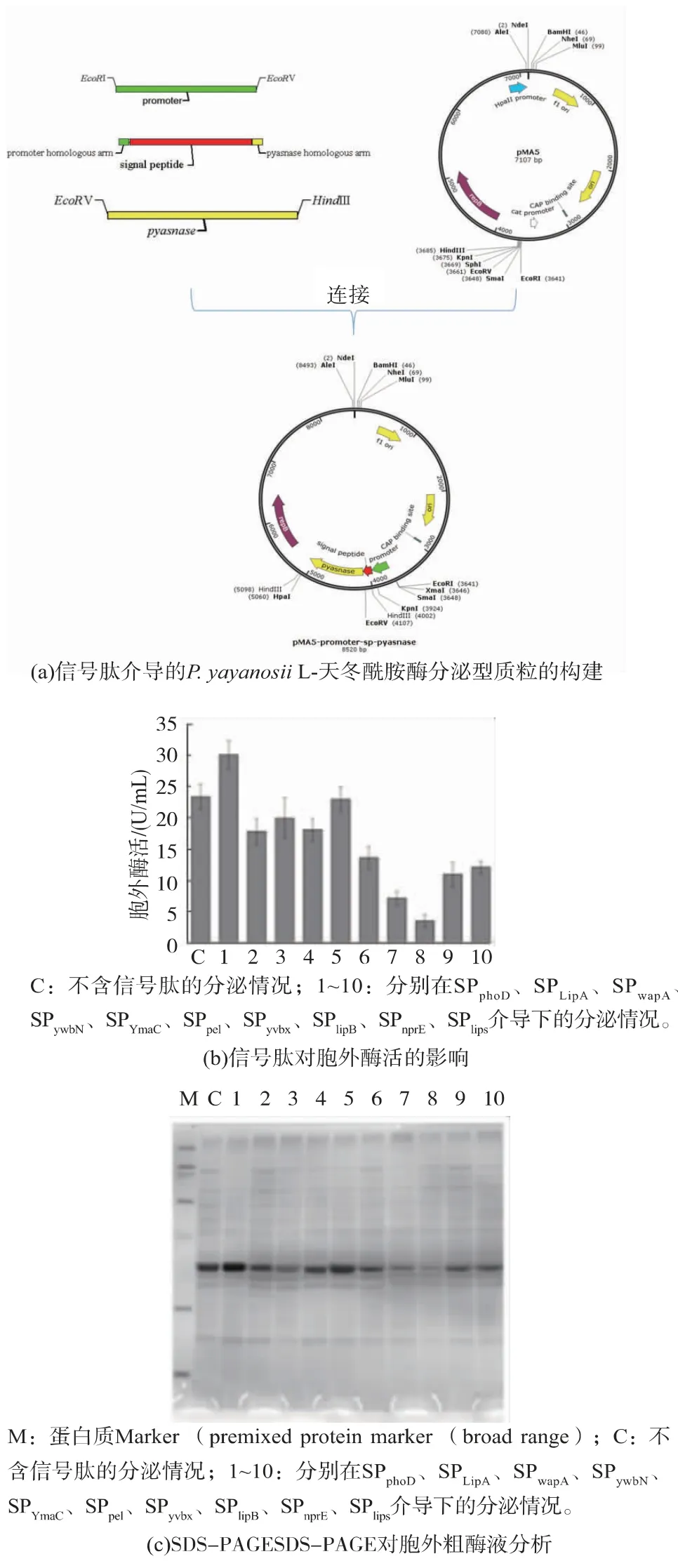
圖3 信號肽介導的P.yayanosii L-天冬酰胺酶分泌型質粒的構建及其對酶分泌的影響Fig.3 Construction of secretion plasmid with signal peptide and effect to the secretion of P.yayanosii L-asparaginase

表2 信號肽對L-天冬酰胺酶在枯草芽孢桿菌中分泌的影響Table 2 Effect of signal peptides on L-asparaginase secretion with B.subtilis
2.3 共表達分子伴侶提高L-天冬酰胺酶分泌水平
分子伴侶(molecular chaperones)在細胞中能識別并結合到不完整折疊或裝配的蛋白質,幫助這些蛋白質進行折疊、分泌。在枯草芽孢桿菌中,PrsA是一種能結合到胞質外側的脂蛋白分子伴侶,在蛋白質分泌的過程中,它能協助蛋白質穿過細胞膜,因此與細胞的分泌水平緊密相關,提高PrsA的水平能使淀粉酶的分泌量提高6倍[22]。DnaK是一種胞內分子伴侶,它具有協調蛋白質折疊、減少蛋白質聚集、保護蛋白質前體轉移的功能,該蛋白質的缺失會限制異源蛋白質分泌水平[23]。將PrsA和DnaK基因分別連接到含有pyasnase及SPphoD基因的pMA5質粒上的BamHI&MluI間(圖4(a)),并將該重組質粒轉入B.subtilis168中實現分子伴侶和該L-天冬酰胺酶的共表達,用以提高該酶的分泌水平。
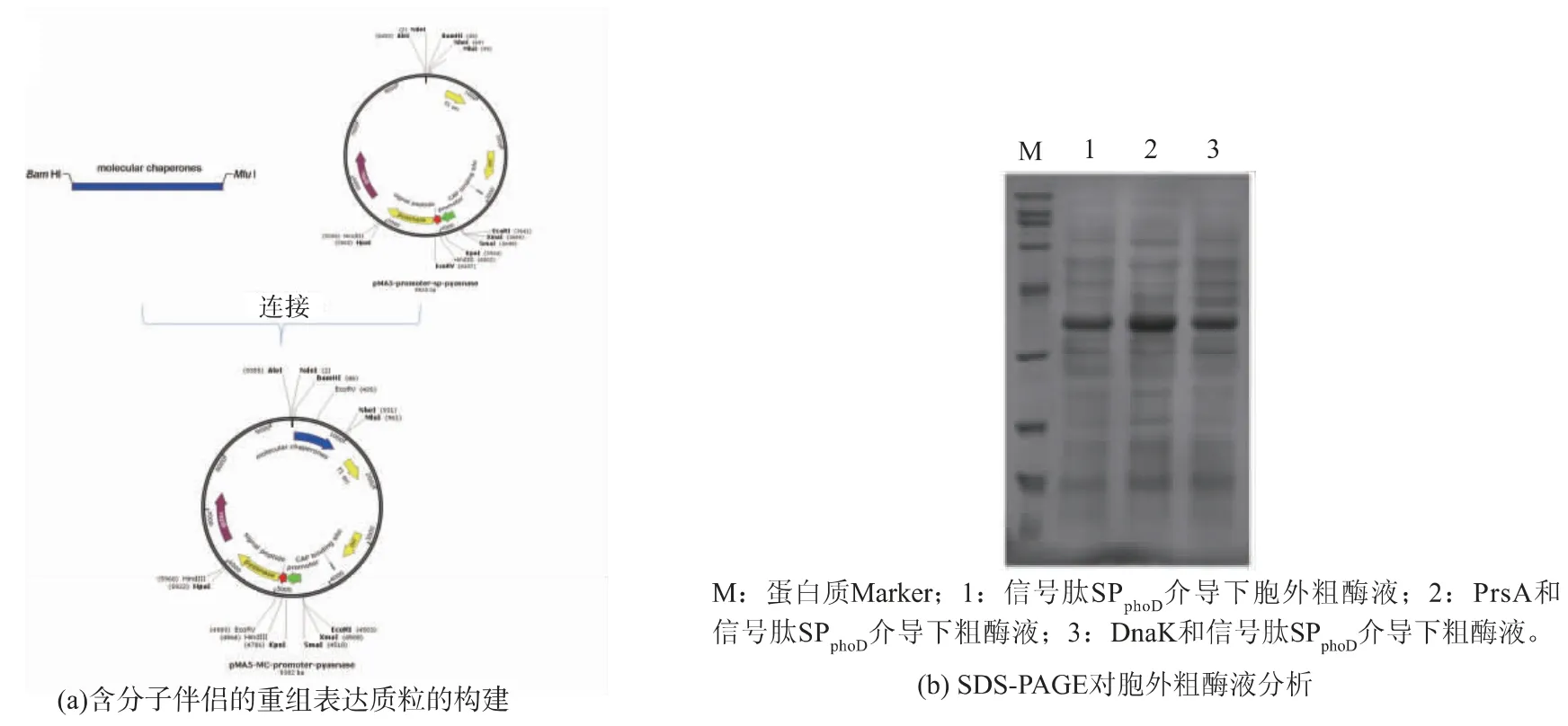
圖4 分子伴侶共表達表達質粒的構建及其對P.yayanosii L-天冬酰胺酶分泌的影響Fig.4 Co-expression plasmid construction of molecular chaperone and effect on the secretion of P.yayanosii L-asparaginase
取胞外粗酶液進行SDS-PAGE分析(圖4(b))并進行酶活測定,發現該酶的分泌量在與DnaK共表達后并未出現明顯變化(胞外酶活僅從30.03 U/mL變為30.15 U/mL,總酶活從96.15 U/mL變為96.25 U/mL),而與PrsA共表達后,成功的將胞外酶活從30.03 U/mL提高到40.12 U/mL,并且將蛋白質總的表達量從96.15 U/mL提高到105.4 U/mL。綜合考慮不同途徑信號肽及分子伴侶對該酶的影響,出現該結果可能是由于該酶的折疊較快,且不需要DnaK的協助或枯草芽孢桿菌中DnaK已足夠滿足該酶的折疊及轉運的需求,同時由于其折疊較快且折疊好的分子相對較大,將蛋白質轉出細胞膜成為限制該蛋白質分泌的重要因素,此時過表達PrsA,有利于該蛋白質的轉出細胞膜,從而提高了該酶的分泌水平。
總體來說,通過添加Tat途徑信號肽,并在此基礎上共表達分子伴侶PrsA,使L-天冬酰胺酶分泌量從23.31 U/mL提高到40.12 U/mL,分泌量提高了72.11%。
3 結語
在本研究中,針對前期工作發現P.yayanosiiL-天冬酰胺酶在枯草芽孢桿菌中表達時具有一定分泌性的現象進行了研究。通過信號肽預測、N端測序等手段鑒定出P.yayanosiiL-天冬酰胺酶的分泌依賴非經典蛋白質分泌途徑,并且發現Tat途徑的信號肽SPphoD能提高該酶分泌水平,同時共表達分子伴侶PrsA有利于該酶的分泌,通過以上策略,將該L-天冬酰胺酶的分泌量提高了72.11%,并且對該酶的分泌過程進行了分析,為進一步研究和探討該L-天冬酰胺酶的分泌過程及提高分泌能力提供了一定參考價值。

