化學平衡教學“靜態模型”思維構建及其應用
慈夫玲 夏振洋 陳瑞蛟
(1.山東省濟寧市海達行知學校 山東濟寧 272100;2.重慶市彭水縣教師進修學校 重慶彭水 409600;3.山東省濟寧醫學院 山東濟寧 272067)
一、問題的背景及提出
中學化學教學中存在很多常用模型,如假想建模、虛擬建模、動態建模等。有學者提出,建模過程所需能力為四階段八步驟,分別為:1.模型發展階段,含模型選擇和模型建立;2.模型精致階段,含模型效化和模型分析;3.模型轉移階段,含模型應用和模型調度;4.模型重建階段,含模型修正和模型轉換。
2018年高考化學新課標卷考試說明[1]中提出:
(6)化學反應速率和化學平衡
⑤理解外界條件(濃度、溫度、壓強、催化劑等)對反應速率和化學平衡的影響,認識并能用相關理論解釋其一般規律。
⑥了解化學反應速率和化學平衡的調控在生活、生產和科學研究領域中的重要作用。
如何讓學生快速、準確地理解這個難點呢?有不少老師先用化學平衡的實驗佐證“條件改變影響化學平衡的移動方向”這一結論,再比較化學平衡常數K與濃度商(Qc)的大小,然后進行理論剖析。這在教學過程中不失為一個較好的方法。但在條件發生變化的過程中,學生同時分析反應物和生成物的速率變化,容易出問題。因為在動態的體系中動態建模,自然容易出現錯誤。這些教學難點可否進行建模處理?筆者做了靜態建模嘗試。
二、利用靜態模型解決化學平衡問題
(一)課堂教學案例:《化學反應原理》[2]第二章第二節
教師:在化學平衡的影響條件中,課本實驗2-5通過現象的變化佐證了增減生成物C(H+)的變化會使平衡方向發生改變,現象也比較明顯。化學平衡為什么發生移動呢?
教師:逆反應速率加快,正反應速率也在加快啊,平衡為什么就向逆反應方向移動呢?
學生:這個……
設計意圖:有不少學生在學習平衡條件的影響因素時,不能從本質上理解平衡移動的原因。表現為化學平衡移動是由于濃度、溫度、壓強的變化使可逆反應從一種平衡狀態變為另一平衡狀態的過程。平衡移動的實質是因為條件的變化打破了正反應、逆反應速率相等的關系:υ(正)≠υ(逆)。在外界條件改變的瞬間,V反、V生會發生怎樣的變化?增大C(H+),會使逆反應速率加快,正反應速率不變,V反>V生,因此,平衡逆向移動。
(二)靜態模型平衡理論
根據任意條件的改變,分析改變條件的瞬間V反、V生發生的變化,即:在外界條件發生改變時,靜態分析由條件變化引起各標量變化,構建出如表1所示理論。對可逆反應:

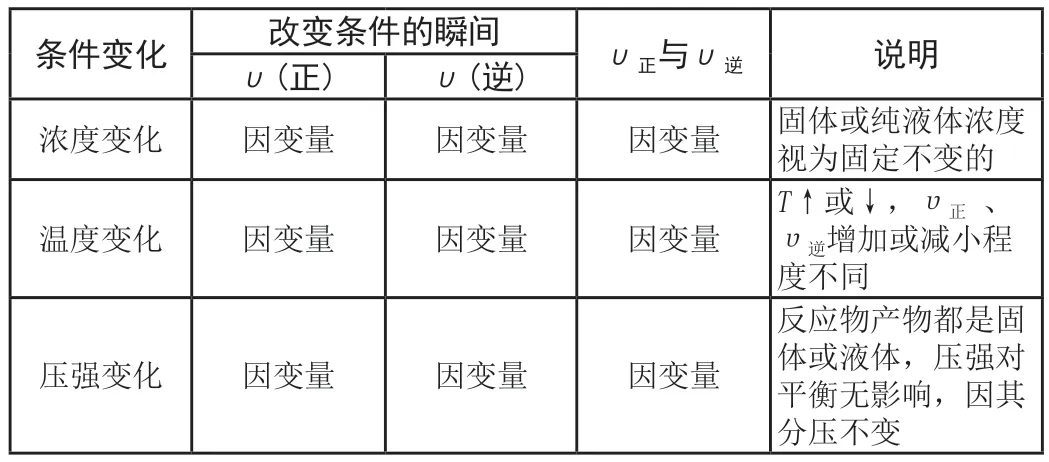
表1 靜態模型平衡理論框架
(三)靜態模型平衡理論的應用
1.由一個變量推導多個變量
例1 在密閉容器中,反應xA(g)+yB(g)zC(g),達到平衡后,測得A氣體的濃度為0.5mol/L。保持溫度不變,將密閉容器的容積增加一倍,當達到新的平衡時,測得A的濃度為0.3mol/L,則下列敘述中正確的是( )。
A.平衡向正反應方向運動 B.x+y>z
C.V(c)%增大 D.物質B的轉化率增大
解析:此題中重要的信息素是“保持溫度不變,將密閉容器的容積增加一倍”,在靜態模型中(見圖1),A氣體的濃度應為0.25mol/L,而實際上為0.3mol/L,則說明平衡逆向移動。則答案選B。
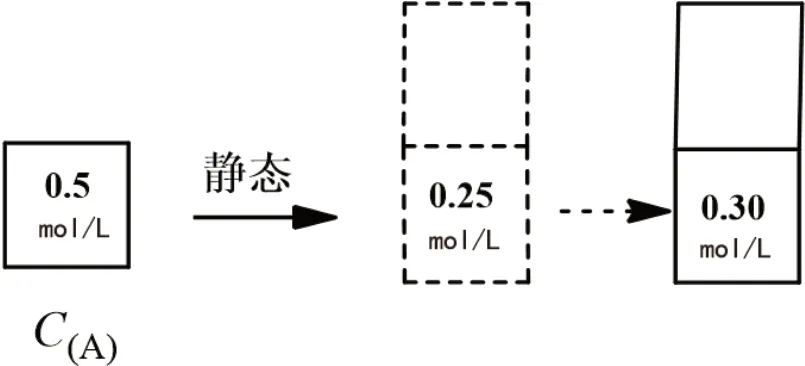
圖1
2.容器問題
例2 一定溫度下,在一容積固定的密閉容器中,建立了下列平衡:恒溫下,再向容器通入一定量NO2,重新建立平衡后,容器中N2O4的體積分數( )。
A.減少 B.增大 C.不變 D.無法判斷變化情況
解析:此題中首先要想到“再向容器通入一定量NO2”中的NO2不是單一的NO2,而是已經達到與前者一樣的平衡體系,現在是將兩個平衡體系壓縮在一個容器中,借助靜態模型分析。若壓縮的瞬間,平衡不移動,則容器中N2O4的體積分數不變,而實際上是體積減小,V生>V反。因此,平衡正向移動,容器中N2O4的體積分數增大(見圖2)。若保持溫度不變,將密閉容器改為恒壓條件下體積可變容器(見圖3),則N2O4的體積分數不變。圖2和圖3均為等效平衡理論中常見的兩種情況。
三、應用靜態模型思維的注意事項
靜態模型適用于氣相反應,也適用于液相中某成分的濃度判斷,依據是客觀條件的變化導致V反≠V生,從而引起平衡的移動,最后形成新的化學平衡移動。
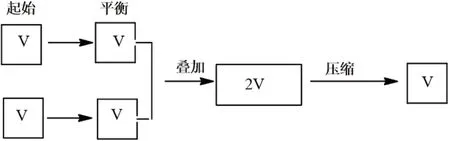
圖2
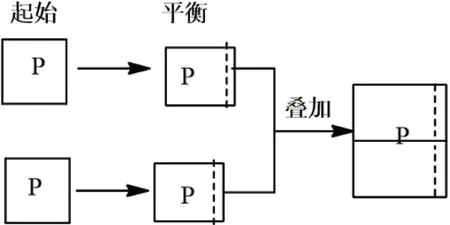
圖3
例3 判斷下列溶液中離子濃度問題的正誤。
A.0.2mol/L與0.1mol/L醋酸中C(H+)之比為2:1
B.甲、乙兩杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,甲中的C(OH-)為乙中C(OH-)的10倍
C.對室溫下pH相同、體積相同的醋酸和鹽酸兩種溶液分別加水稀釋10倍后,兩溶液的pH均增大
D.如果取0.2mol/L HX溶液與0.1mol/L NaOH溶液等體積混合,測得混合溶液的pH>7,則說明HX的電離程度 NaX的水解程度(填>、<或=)
解析:
A選項,0.2mol/L醋酸與0.1mol/L醋酸,從濃度上看,前者的濃度是后者是兩倍,將前者濃度稀釋一倍后就變成0.1mol/L醋酸,靜態處理分析:前者稀釋的過程中若平衡不移動,則C(H+)之比為2:1,而實際是平衡發生移動,導致C(H+)之比大于2:1。
B、C選項正確。
D選項,0.2mol/L HX溶液與0.1mol/L NaOH溶液等體積混合后溶液成分變成等物質量的NaX與HX混合溶液,對于等物質量的混合溶液靜態處理分析:若酸電離程度大,則溶液顯酸性;若鹽的水解程度大,則溶液顯堿性。實際情況是pH>7,說明HX的電離程度小于NaX的水解程度,故填<。
四、結束語
靜態模型的構建是針對化學平衡理論的應用做出的一種有效的靜態模型化處理,是將復雜的化學問題、實際問題的一些次要細節及非本質的內容舍去,通過建模簡化和理想化處理,即借符號、線條、圖形等將實際問題概念化、符號化,最后用數學工具求解。化學平衡問題也可以將條件改變產生的不同變量靜態化建模處理,凸顯出幾個標量,并通過模型求解,最后判定平衡移動的綜合效果。

