石墨烯生物毒性的計算機模擬研究進展
周夢迪,沈嘉煒,梁立軍,李嘉辰,金樂紅,王琦
(1 杭州師范大學醫學院,浙江杭州311121; 2 杭州電子科技大學自動化學院,浙江杭州310018; 3 浙江大學化學系,浙江杭州310027)
引 言
近年來,隨著納米技術的發展,納米粒子被廣泛用于許多研究領域,例如在生物醫學領域,納米粒子可用于醫學成像[1]、生物傳感[2-4]、藥物的靶向運輸[5-6]以及癌癥的同步診斷和治療[7-9]等。同時,納米粒子也已經用于電子元件、涂料、運動器材、化妝品、食品添加劑等許多商業產品[10]。納米粒子在一維尺度上長度小于100 nm,尺寸很小,容易通過皮膚吸收并被體液攜帶,進而到達活細胞,穿透細胞膜或在人體累積,從而誘導細胞損傷甚至凋亡。在進入人體和細胞的過程中,納米材料可能會與蛋白質、脂質或核酸等生物大分子相互作用[11-13],從而導致生物大分子的失活,誘導或產生生物毒性。由于石墨烯在工業上的應用越來越多[14-15],是目前發現的最薄、強度最大、導電導熱性能最好的一種納米材料,因而被稱作“黑金”,近年來更被譽為是“新材料之王”。這種典型的二維材料的生物安全性及其在生物醫療方面的應用也越來越受到關注[16-18]。
石墨烯(graphene,GRA)是一種由平整的單層碳原子密集堆積成二維蜂窩晶格的碳納米材料,可被視為富勒烯、碳納米管和石墨的基本組成部分[19-21]。氧化石墨烯(graphene oxide,GO)是石墨烯的氧化物,經過氧化處理后,氧化石墨烯仍保持石墨的層狀結構,但在每一層的石墨烯單片上引入了許多氧基官能團。這些氧基官能團的引入使得單一的石墨烯結構變得非常復雜。這類物質粒徑很小,容易進入生物體,與組織、細胞、細胞器和蛋白質等相互作用,導致組織或細胞的功能紊亂[22]。石墨烯由于其獨特的結構、電子特性等已被應用于潛在的生物治療中[23]。雖然石墨烯已被證明是疾病診斷和治療的良好候選材料,但人們對石墨烯與生物系統相互作用所產生的生物效應和相應的機制的認識仍然有限。近年來有關石墨烯與生物大分子之間的研究越來越引起關注,例如,計算機模擬研究和實驗研究都表明石墨烯可以吸附蛋白質使蛋白質結構發生改變,穿透細胞膜從而吸附細胞膜上的磷脂,吸附DNA破壞DNA的堿基對等[24-26]。
分子動力學模擬(molecular dynamic simulation,MD)自1966 年起發展至今已有五十余年,隨著計算方法學的不斷提升和計算機計算能力的飛速發展,近年來分子動力學模擬技術已不斷地滲透到生物、化學、制藥等相關領域并在其中得到廣泛應用,目前已成為除理論分析和實驗研究以外的第三種分析手段[27-29]。分子動力學模擬作為一種強大的工具不僅能得到原子的運動軌跡,還能像實驗一樣進行各種觀察,特別是在實際實驗中無法獲得的與原子有關的微觀細節,在分子動力學模擬中都能方便地進行觀察。相比于實驗,利用分子動力學模擬研究化學或生物問題具有以下一些優點:(1)成本較低;(2)降低實驗事故發生率,安全性高;(3)有助于更好地理解和獲取一些實驗上難以得到的分子級別的結構和動力學數據,有效地補充實驗數據。因此本文綜述了近年來計算機模擬技術,尤其是分子動力學模擬方法在研究石墨烯、氧化石墨烯、石墨烯量子點等納米材料與細胞膜、蛋白質、DNA 等生物大分子相互作用及其潛在的生物毒性的進展。
1 石墨烯和細胞膜的相互作用
納米材料能夠進入細胞并與細胞發生作用,主要是通過對跨膜過程和細胞分裂、增殖、凋亡等基本生命過程的影響和相關信號傳導通路的調控,從而在細胞水平上產生一定的生物效應。最近關于石墨納米材料如零維富勒烯[30-31]和一維碳納米管[32-33]與細胞膜相互作用的研究表明,這些材料可以通過直接滲透[34-35](通常是小尺寸納米顆粒的情況)或通過內吞作用進入細胞[33,36]。據報道,石墨烯具有細胞毒性作用,細胞內活性氧(ROS)的過量產生與其毒性有關[37-38]。一些實驗研究也表明石墨烯具有毒性效應。比如Kloepfer 等[39]發現當石墨烯量子點的粒徑小于5 nm 時,它可以直接進入大腸桿菌和枯草芽孢桿菌細胞內,并產生毒性效應;Hu 等[40]研究氧化石墨烯的加入對大腸桿菌的影響,發現氧化石墨烯可以切斷大腸桿菌的細胞膜,并導致直接的物理膜損傷,從而造成細胞死亡;Liu 等[41]通過體外實驗發現氧化石墨烯可以和脂質囊泡相互作用從而損傷細胞膜結構。還有一些團隊發現石墨烯和氧化石墨烯對紅細胞有溶血作用[42-44],這些溶血作用被證明和石墨烯對細胞膜的破壞作用有關[25,45]。
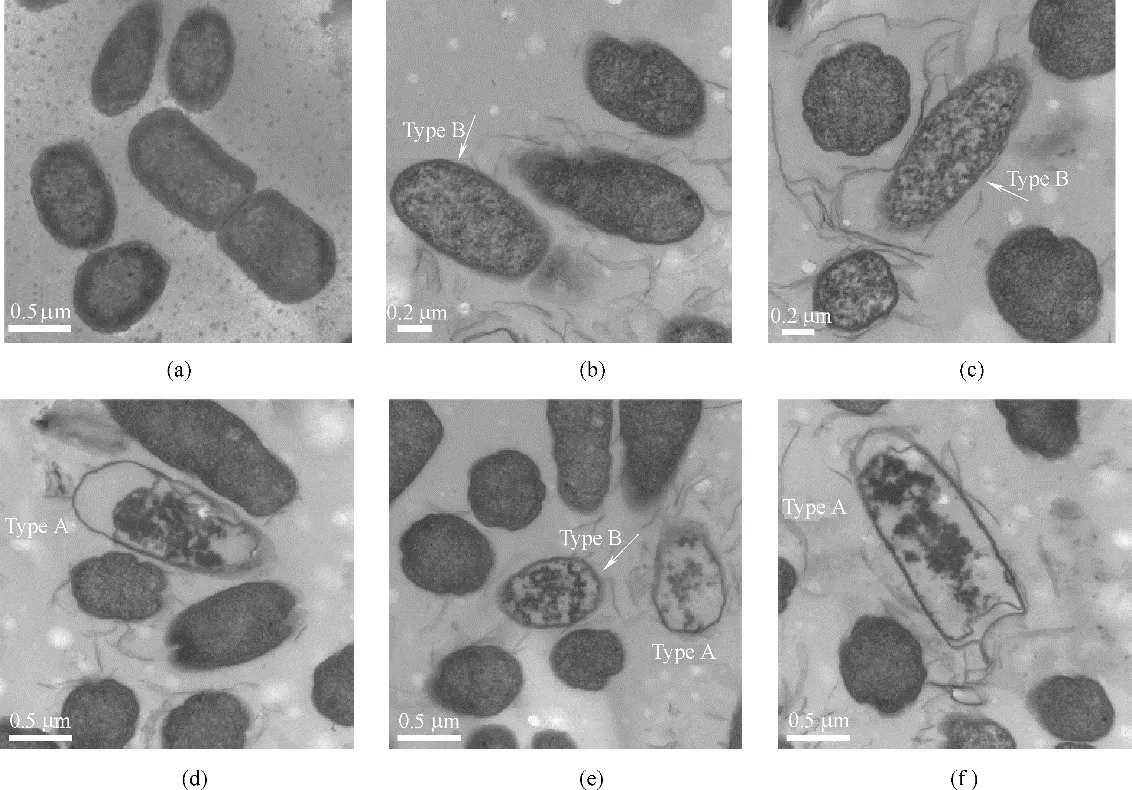
圖1 氧化石墨烯作用下的大腸桿菌細胞膜形態學的變化[25]Fig.1 Morphology of Escherichia coil exposed to graphene oxide nanosheets[25]
1.1 石墨烯和大腸桿菌細胞膜相互作用
最近有研究發現石墨烯對大腸桿菌有強烈的抑菌作用,這種細胞毒性被認為是由石墨烯和細菌細胞膜之間的直接相互作用形成的物理損傷所引起的[46-49]。Tu 等[25]通過實驗方法發現氧化石墨烯能夠破壞大腸桿菌細胞膜的結構,如圖1 所示。大腸桿菌細胞形態學變化歷經三個階段。第一階段,大腸桿菌細胞膜保持初始結構[圖1(a)]。第二階段,大腸桿菌細胞膜部分受損,其中部分細胞膜表面具有較低的磷脂密度即稀疏脂質[如圖1(b)、(c)中Type B所示]。第三階段,發現大腸桿菌細胞失去了細胞完整性,其膜被嚴重破壞,有些甚至喪失了所有細胞質,即“空巢“[如圖1(d)~(f)中的Type A 所示]。這些實驗結果表明氧化石墨烯能夠破壞細胞膜的結構從而對細胞產生一定的潛在毒性。Tu 等又采用分子動力學模擬技術發現石墨烯能吸附大腸桿菌細胞膜上的磷脂,從而破壞細胞膜的結構。他們發現石墨烯中所有的碳原子都是sp2雜化,由于這一特殊的二級結構,導致石墨烯和細胞膜磷脂之間存在非常強的疏水相互作用。在本次模擬中使用全原子脂質模型模擬大腸桿菌的細胞外膜和細胞內膜,如圖2 所示,在石墨烯納米片自發地進入細胞外膜和細胞內膜這一過程中觀察到三種可區分的模式:第一,擺動模式(swing mode),石墨烯納米片由其最初無偏的取向經過一次擺動,然后在受其約束的原子周圍來回擺動,此過程持續一小段時間;第二,插入模式(insertion mode),石墨烯納米片的尾端最終由于受到來自膜脂質的強范德華力(vdW)的吸引而被膜攝取和拉動;第三,攝取模式(extraction mode),石墨烯納米片開始攝取細胞膜表面的磷脂分子,破壞細胞膜結構。為進一步研究石墨烯對大腸桿菌的細胞毒性機制,Tu等[25]將石墨烯放置在細胞膜上方,并觀察石墨烯和細胞膜相互作用的過程(圖3),結果表明石墨烯不但可以插入細胞膜從而進行物理切割,還可以通過疏水作用對細菌膜表面的脂質分子進行破壞性的抽取,進而殺死細菌。他們指出,正是由于石墨烯獨特的二維結構使其可以與細菌細胞膜上的磷脂分子發生超強的相互作用,從而導致大量磷脂分子脫離細胞膜并吸附到石墨烯的表面。
1.2 石墨烯和哺乳動物細胞相互作用
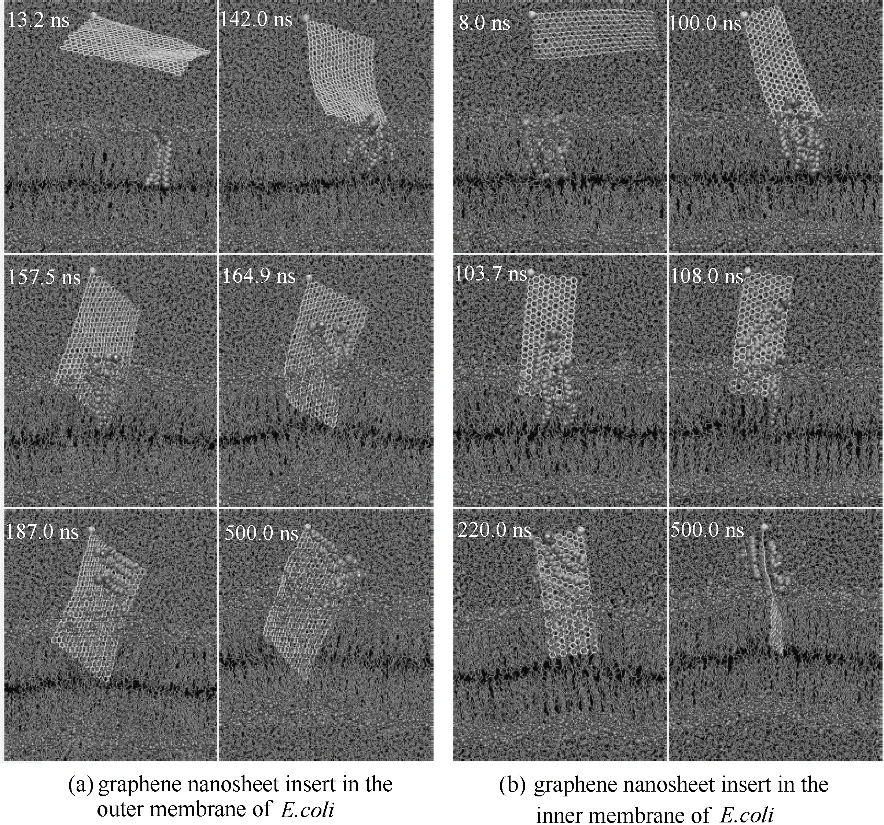
圖2 石墨烯納米片插入細胞膜的過程[25]Fig.2 Graphene nanosheets insertion and lipid extraction[25]
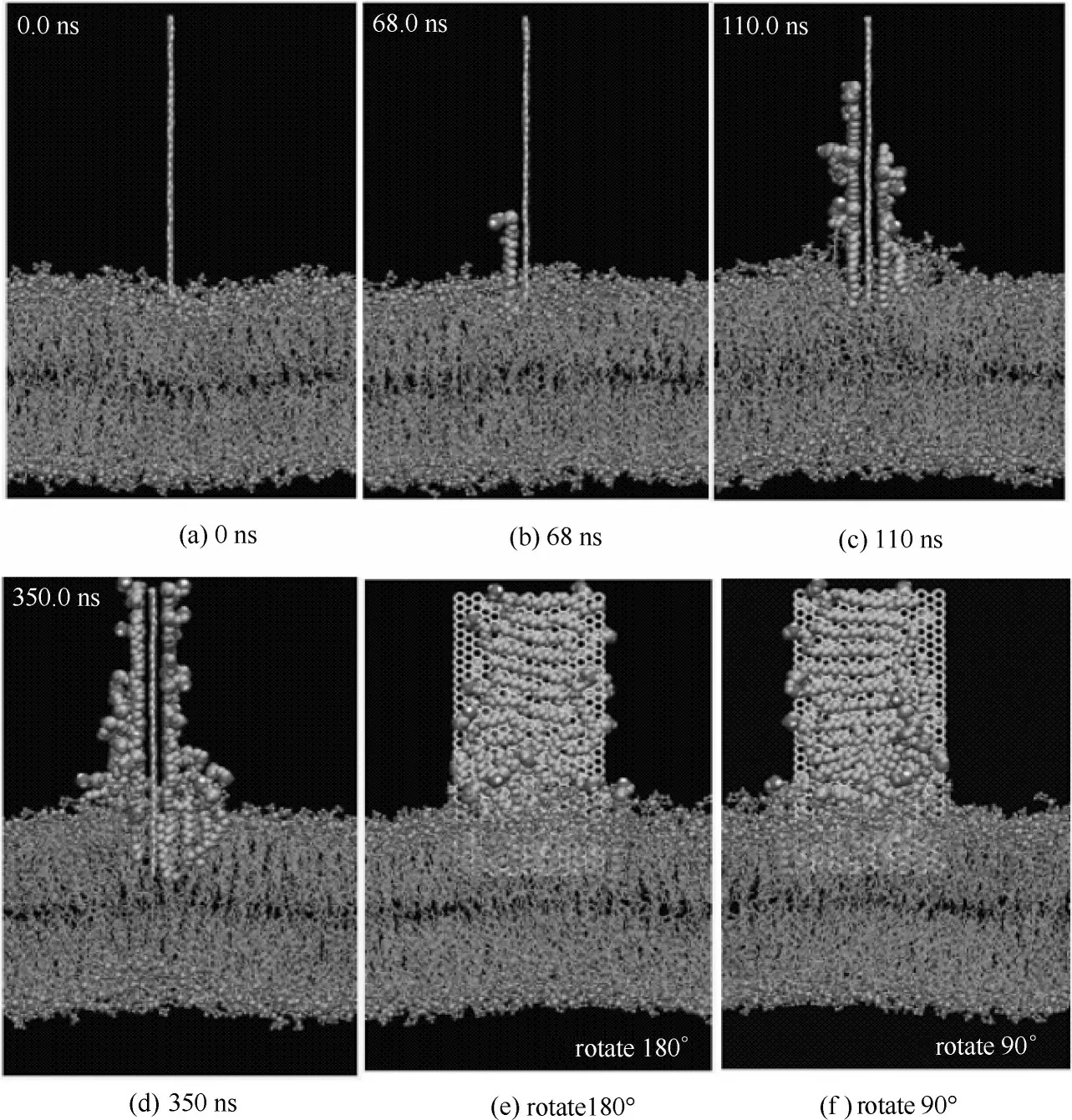
圖3 石墨烯吸附磷脂分子的模擬過程[25]Fig.3 Lipids extraction by graphene in docking simulations[25]
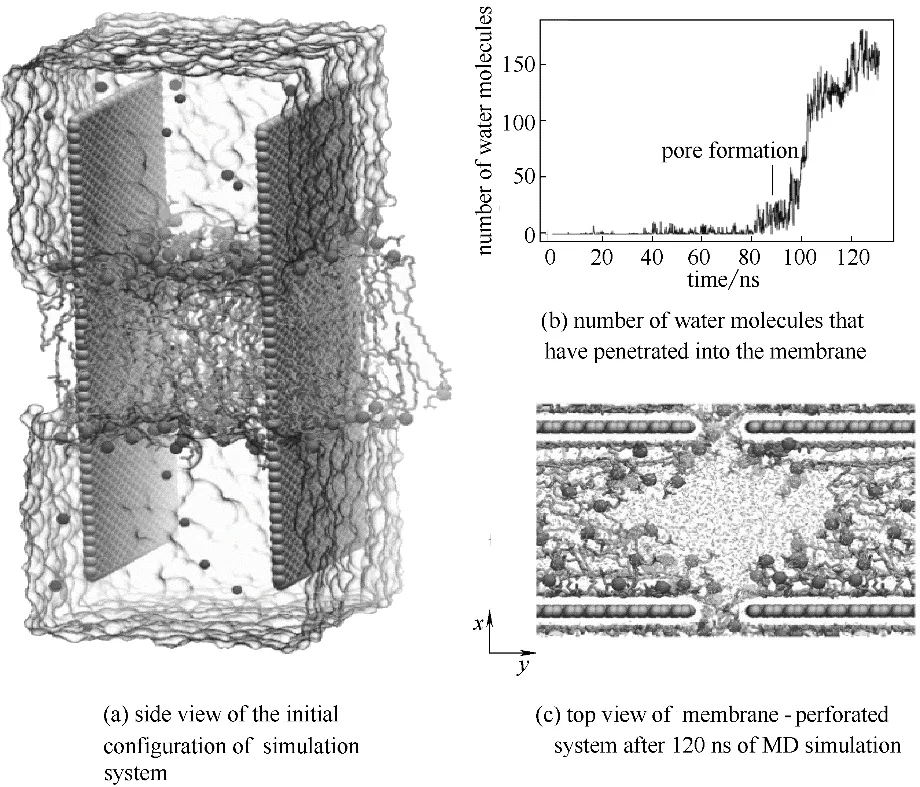
圖4 石墨烯和磷脂分子相互作用的過程[50]Fig.4 Interaction between grapheme and membranes[50]
石墨烯不僅能攝取細胞膜表面的磷脂分子,改變細胞膜的結構,還可以形成膜孔。Duan 等[50]通過分子動力學模擬方法發現石墨烯可以吸附細胞膜表面的磷脂,并形成水分子可以通過的膜孔,并通過實驗加以證明。圖4(a)表現的是兩個平行的石墨烯片垂直插入細胞膜表面的磷脂雙分子層的過程。圖4(b)、(c)表明石墨烯片插入細胞膜后,吸收其表面的磷脂分子,并形成水分子孔道。隨著模擬時間的延長,孔道中的水分子數量越來越多,吸附在石墨烯表面的磷脂分子也越來越多。因為石墨烯和疏水性的磷脂分子尾部之間存在強大的疏水作用,從而使得磷脂分子從細胞膜中脫離被吸附到石墨烯表面上,并導致細胞膜內部片段之間的負曲率增加。在90 ns 時,細胞膜失去其完整性,并在石墨烯的中心位置形成孔。
為了進一步說明膜孔形成的機制,Duan等又計算了石墨烯和細胞膜之間的范德華力(vdW),如圖5(a)所示。模擬過程分為三個階段,第一階段,磷脂分子快速地吸附在石墨烯表面,導致石墨烯和細胞膜之間的vdW作用驟減,隨著細胞膜進入亞穩態,該過程開始顯著減慢;第二階段,細胞膜內膜的張力和石墨烯介導的分開細胞膜的拉力大致平衡,從而使細胞膜的曲率保持在相對穩定的水平;第三階段,熱力學波動導致細胞膜張力最終屈服于石墨烯分散的拉力,導致石墨烯進一步提取脂質分子、膜孔形成以及vdW作用的又一次急劇下降。他們又通過計算磷原子的密度進一步說明膜孔形成的機制,如圖5(b)所示。第一階段,磷原子的密度沿整個軸線相對均勻分布,就如同未受干擾的細胞膜所預期的分布。然而,到50 ns時,可以看到密度分布形成了一個深谷,在深谷區域發現了磷原子密度最大程度地耗盡(第二階段)。通過吸引納米片相鄰的脂質分子將該間隙區域中的脂質拉向石墨烯,進一步刺激提取過程。在第三階段的開始,間隙區域中的脂質分子之間形成的網格消散并且在膜中形成孔。
石墨烯侵入細胞膜除了能吸附細胞膜表面的磷脂分子外,還可以通過尖角穿孔的方式進入細胞膜。Li等[43]使用全原子分子動力學模擬發現石墨烯的尖角最初被放置在穿過磷脂雙分子層的角穿孔構型中,然后觀察到石墨烯自發地向下移動,進一步穿透到磷脂雙分子層中,如圖6(a)所示。他們還計算了石墨烯尖角插入細胞膜過程中的能壘變化,如圖6(b)顯示石墨烯尖角穿透磷脂雙分子層頂部親水頭部區域的能壘約為5kBT。在此后不久,由于磷脂分子的疏水性尾部和石墨烯之間的疏水作用致使總的能量開始減少。進一步的研究表明,與石墨烯角穿入磷脂雙分子層相關的自由能變化可以用四個參數的簡單數學模型來描述:hT(磷脂分子尾部的厚度),hH(磷脂分子頭部的厚度),γH(磷脂分子頭部基團和石墨烯表面之間的能量),γT(磷脂分子尾部和石墨烯表面之間的能量),如圖6(c)所示。該模型預測,隨著石墨烯穿透磷脂雙分子層距離h的變化,能量在0 <h≤hH的范圍內增加,并且在hH+ 2hT<h≤2hH+ 2hT和2hH+ 2hT<h的情況下減少。能壘計算公式為E=2(1-γH/γT)h2HγHtanα,其中α是石墨烯的半內角。當石墨烯的內角為45°時,預計穿孔的能壘約為7kBT,這和之前全原子模擬計算的石墨烯和細胞膜之間的能壘為5kBT非常接近。這些分析的數據都表明石墨烯可以通過尖角插入細胞膜,從而破壞細胞膜的結構。
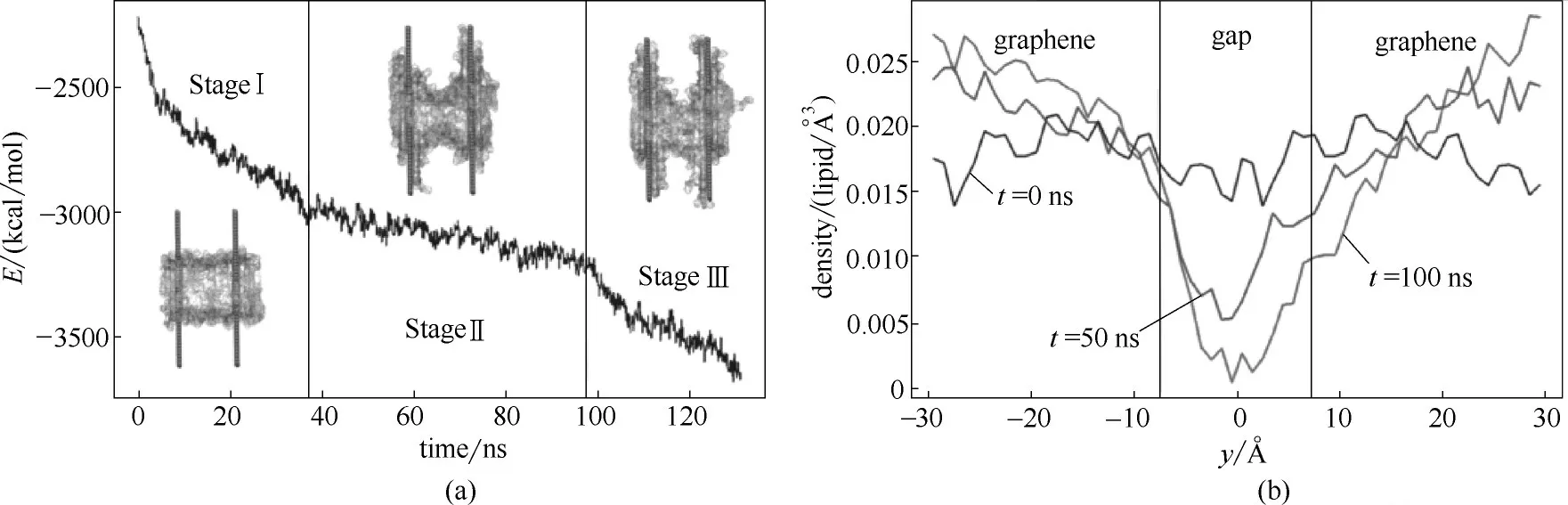
圖5 石墨烯和細胞膜之間的范德華力(vdW)和磷原子的密度分布[50]Fig.5 (a)vdW energy profile for interactions between lipids and graphenes;(b)lipid density projected onto the y-axis at different stages of pore formation[50]
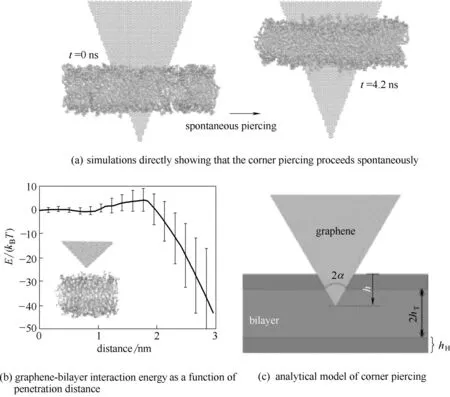
圖6 石墨烯尖角通過細胞膜的全原子分子動力學模擬研究[43]Fig.6 All-atom molecular dynamical simulations of corner piercing of a monolayer graphene across a lipid bilayer[43]
1.3 石墨烯量子點和細胞膜的相互作用
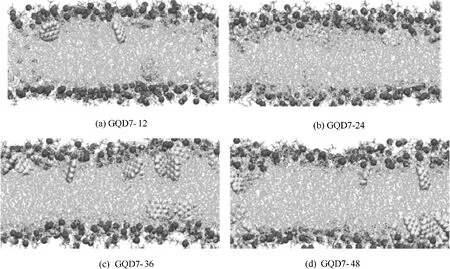
圖7 100 ns分子動力學模擬后不同濃度的GQD7穿越細胞膜的瞬時結構[55]Fig.7 Final structures and distribution of GQDs in lipid membrane at different concentrations after 100 ns molecular dynamics simulation[55]
石墨烯量子點(graphene quantum dots,GQDs)是來源于石墨烯的一種零維納米材料,因其具有優異的物理、電化學性質而被應用于各個領域[51-52]。研究發現GQDs 的細胞毒性不同于石墨烯和氧化石墨烯。Zhang 等[53]發現GQDs 的細胞毒性低于微米尺寸的氧化石墨烯。然而也有實驗表明,GQDs 可以造成人體細胞的死亡,并且高濃度的GQDs 具有一定的毒性[54]。本課題組[55]通過分子動力學模擬研究發現高濃度的GQDs 能夠引起細胞膜磷脂雙分子層結構的改變。圖7 顯示了同一尺寸、不同濃度的GQD7 進入細胞膜后的分布情況,在四種不同濃度的體系中,GQD7 都能夠在細胞膜內部分散開來,并且絕大多數GQD7單分散在細胞膜兩側。為了進一步觀察GQD7 穿膜的過程,將數量為36 個分子的GQD7 體系模擬時間延長至200 ns(圖8)。圖8(a)顯示大部分的GQDs 在進入細胞膜之前就呈現聚集狀態,這和C60進入細胞膜的過程是相似的[56]。此后,在20 ns 和60 ns [圖8(b), (c)] 階段,GQDs 還是有一部分聚集在一起,這一點可以在圖9 的團簇分析中得到證實。然而,在110 ns時團簇中的大部分GQDs開始平行于細胞膜表面。圖10分析了GQDs表面和細胞膜xy平面的角度變化,從圖中可以看出GQDs表面和細胞膜xy平面的平均夾角分布在45°~60°之間。與此同時,隨著模擬時間的延長,數量為36 個分子的GQD7的最大團簇數量從33個降到10個,這表明在滲透進入細胞膜后,GQD7 的聚集體趨向于在細胞膜的兩側解離并分散到能量最小的位置。由此可估測所有的GQD7分子在足夠長的模擬時間內可以單分散在細胞膜內部。這些結果表明高濃度的GQD7 傾向于通過聚集體進入細胞膜中,并在進入細胞膜后單分散開,進而影響磷脂分子的結構甚至可能影響細胞信號的傳導。
2 石墨烯與蛋白質的相互作用
蛋白質是生命活動的主要體現者,人類蛋白質組中的蛋白種類估計有100多萬種。石墨烯納米材料與細胞內生物分子(如DNA、蛋白質)之間的相互作用會干擾生物功能,導致細胞毒性作用[35]。有研究發現,石墨烯對多肽、蛋白片段、蛋白的結構都有一定的破壞力。比如Matesanz 等[57]發現氧化石墨烯納米片可以通過定位肌動蛋白絲來誘導細胞周期改變。Wang 等[58]設計了不同表面的石墨烯,如純石墨烯、疏水性石墨烯、氧化石墨烯、表面N 摻雜的石墨烯、表面受限制的石墨烯等,利用分子動力學模擬來研究FPA(Fibrinopeptide-A,纖維蛋白肽A)蛋白與這些石墨烯的相互作用。結果表明它們都能或多或少地改變FPA 的形態,但用氧和氮原子修飾的石墨烯表面可以更有效地與FPA 或其他一些生物分子相互作用,從而改變它們的形態和電學性質,包括疏水性。
2.1 有缺陷的石墨烯和蛋白質相互作用

圖8 濃度為36個分子的GQD7穿越細胞膜的過程[55]Fig.8 Aggregated structures and distribution of GQD7-36 during simulation[55]
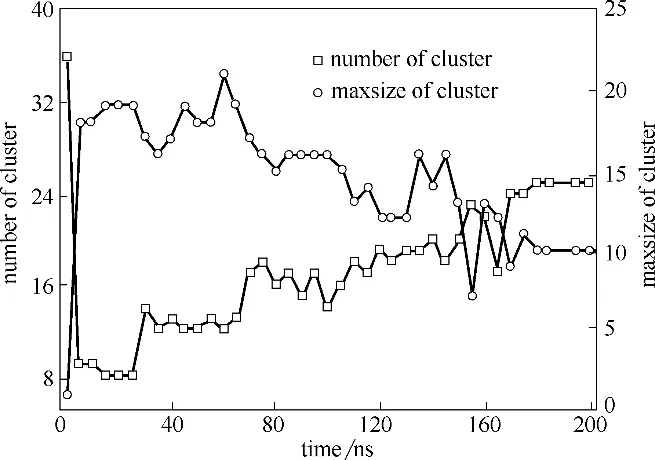
圖9 數量為36個分子的GQD7系統中的團簇分析[55]Fig.9 Number of cluster and maxsize of cluster in GQD7-36 system as a function of simulation time[55]
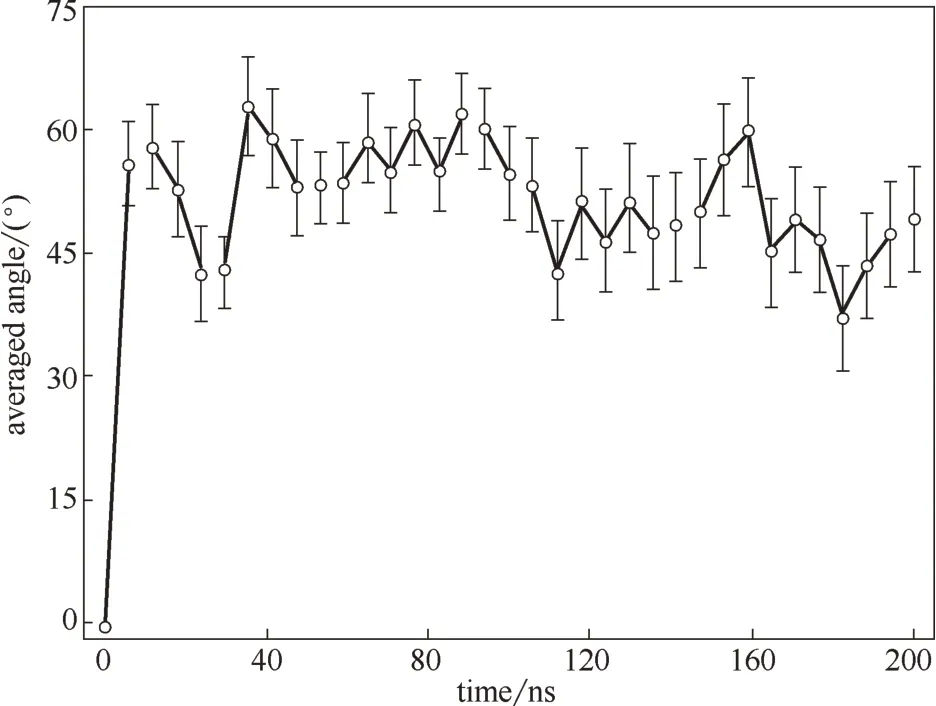
圖10 濃度為36個分子的GQD7和細胞膜之間的角度變化[55]Fig.10 Angle distribution of GQD7 in lipid membrane during simulation[55]
由于石墨烯在生產過程中容易受到操作手段及環境等影響,不可避免地會生成一些不完整的、有缺陷的石墨烯。雖然有缺陷的石墨烯可以用于DNA 測序、氣體分離、海水淡化等方面[59-62],但是有研究發現,這種有缺陷的石墨烯也會和生物大分子發生相互作用并對其結構造成一定的影響。比如Li等[63]采用分子動力學方法將完整的石墨烯和有缺陷的石墨烯做了比較,發現相較于完整的石墨烯,有缺陷的石墨烯對蛋白質的結構影響更大。圖11(a)、(b)顯示了YAP65WW 蛋白的均方根位移(RMSD)隨時間的變化,可以發現蛋白質和有缺陷的石墨烯結合后其結構變化更為明顯,而完整的石墨烯在吸附蛋白質后,蛋白質的RMSD 幾乎沒有變化。為了進一步說明YAP65WW蛋白吸附在兩種石墨烯表面的過程,Li 等又分析了蛋白質和兩種石墨烯之間接觸的重原子數量隨時間的分布,如圖11(c)、(d)所示。圖11(c)顯示蛋白質和有缺陷的石墨烯之間的原子數量變化分為三個階段:第一階段在開始的幾個納秒之間,原子數量從20增加到50;第二階段,原子數量從50 增加到80;最后原子數量增加到110,并且圖中也顯示在最后階段,YAP65WW 蛋白完全地展開在有缺陷的石墨烯表面上,蛋白質結構破壞較大。而圖11(d)表明蛋白質和完整的石墨烯之間接觸的原子數量變化只有兩個階段,第一階段原子數量從20 增加到40,第二階段從60 增加到80。并且在圖中也能看見蛋白質在完整的石墨烯表面有一部分呈現折疊狀態,并沒有完全地展開。這些模擬結果表明,蛋白質更易在有缺陷的石墨烯表面吸附并展開,其結構破壞更大。
2.2 純石墨烯和蛋白質的相互作用
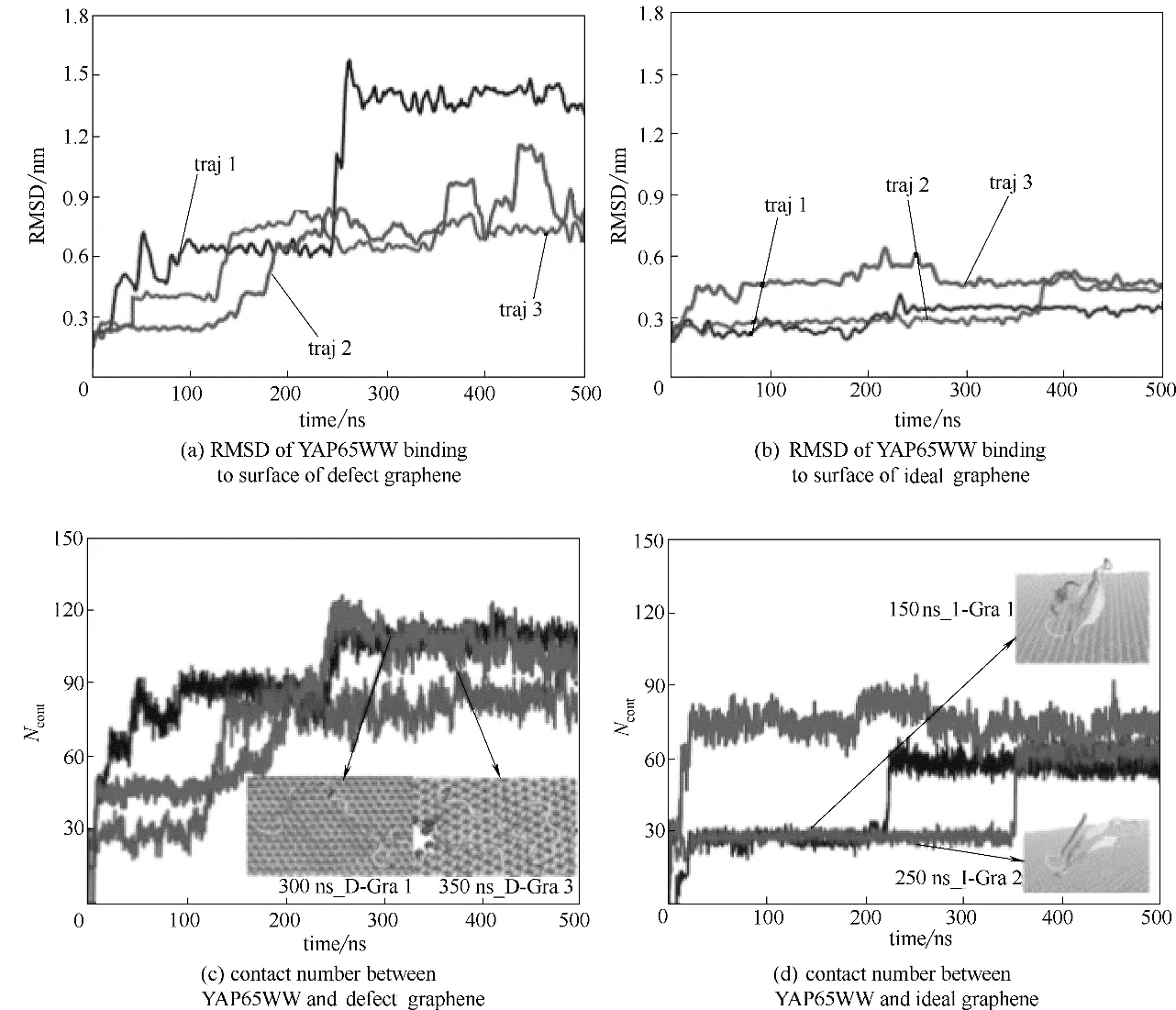
圖11 分子動力學模擬中石墨烯和YAP65WW蛋白質之間相互作用時蛋白質RMSD的變化及兩者間接觸的原子數量的變化[63]Fig.11 Time evolution of root-mean-squared deviation(RMSD)of YAP65WW and contact number of heavy atoms between YAP65WW and graphene[63]
研究發現石墨烯能插入一些蛋白質復合物,破壞其整體結構,從而使其蛋白質的功能喪失。例如Luan等[64]使用全原子分子動力學模擬方法將石墨烯與蛋白質混合,通過探討蛋白質之間的相互作用揭示石墨烯的潛在毒性。如圖12(a) 分析了在4 次獨立的模擬過程中蛋白質二聚體之間的接觸面積隨時間的變化,研究發現在沒有插入石墨烯的初始階段,蛋白質二聚體之間的接觸面積在300~350 ?2(1 ?=0.1 nm)之間,插入石墨烯之后,蛋白質二聚體之間的接觸面積逐漸減少至零,說明疏水性的石墨烯可以插入蛋白質二聚體的疏水界面中,從而破壞蛋白質-蛋白質相互作用。圖12(b)~(e)描述的是石墨烯片侵入二聚體之間的過程。這一過程是通過石墨烯片和蛋白質之間的范德華力(vdW)作用的,由于石墨烯表面是疏水性的,石墨烯和水分子之間的相互作用小于其和蛋白質之間的相互作用,因此蛋白質表面的疏水殘基會吸附到石墨烯表面[26]。石墨烯片通過旋轉的方式侵入二聚體之間,并且在2 ns時石墨烯開始接觸其中一個蛋白質單體,而石墨烯片的一個邊緣保留在二聚體界面附近。在30 ns時,石墨烯和蛋白質單體之間接觸的面積增多。在30~40 ns階段,由于石墨烯表面和二聚體界面上的非極性殘基之間的疏水作用,蛋白質單體開始圍繞其中心軸開始旋轉。與此同時,另一個蛋白質單體界面上的非極性殘基開始與石墨烯片的另一邊接觸。56 ns 時,石墨烯片已經完全侵入二聚體之間,并將二聚體分開。圖12(f)~(i)顯示了石墨烯侵入蛋白質二聚體之間的另一種方式。模擬開始時石墨烯片位于二聚體的對側,石墨烯表面可以與兩個單體上的疏水殘基接觸。結果發現石墨烯片快速地插入二聚體的疏水表面,并且在3 ns 內將二聚體分開。總之,這兩種模擬都能表明石墨烯片可以通過與蛋白質之間的疏水作用快速地進入蛋白質二聚體內并將其分開,破壞其結構,從而造成蛋白質功能紊亂。
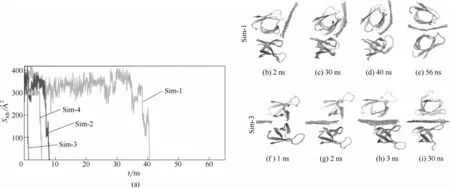
圖12 (a)蛋白質二聚體之間的接觸面積隨石墨烯插入時間的變化;(b)~(i)石墨烯插入蛋白質二聚體之間的過程[64]Fig.12 (a)Time-dependent contact areas of dimer during insertion of a graphene sheet;(b)—(i)Snapshots of insertion process of graphene sheet into dimer[64]
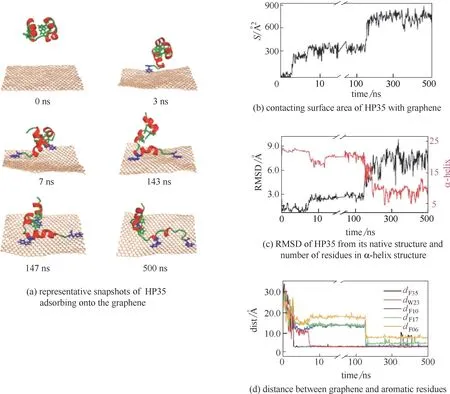
圖13 蛋白質吸附在石墨烯表面的過程及相關分析[26]Fig.13 Representative trajectory and analysis of HP35 adsorbing onto graphene[26]
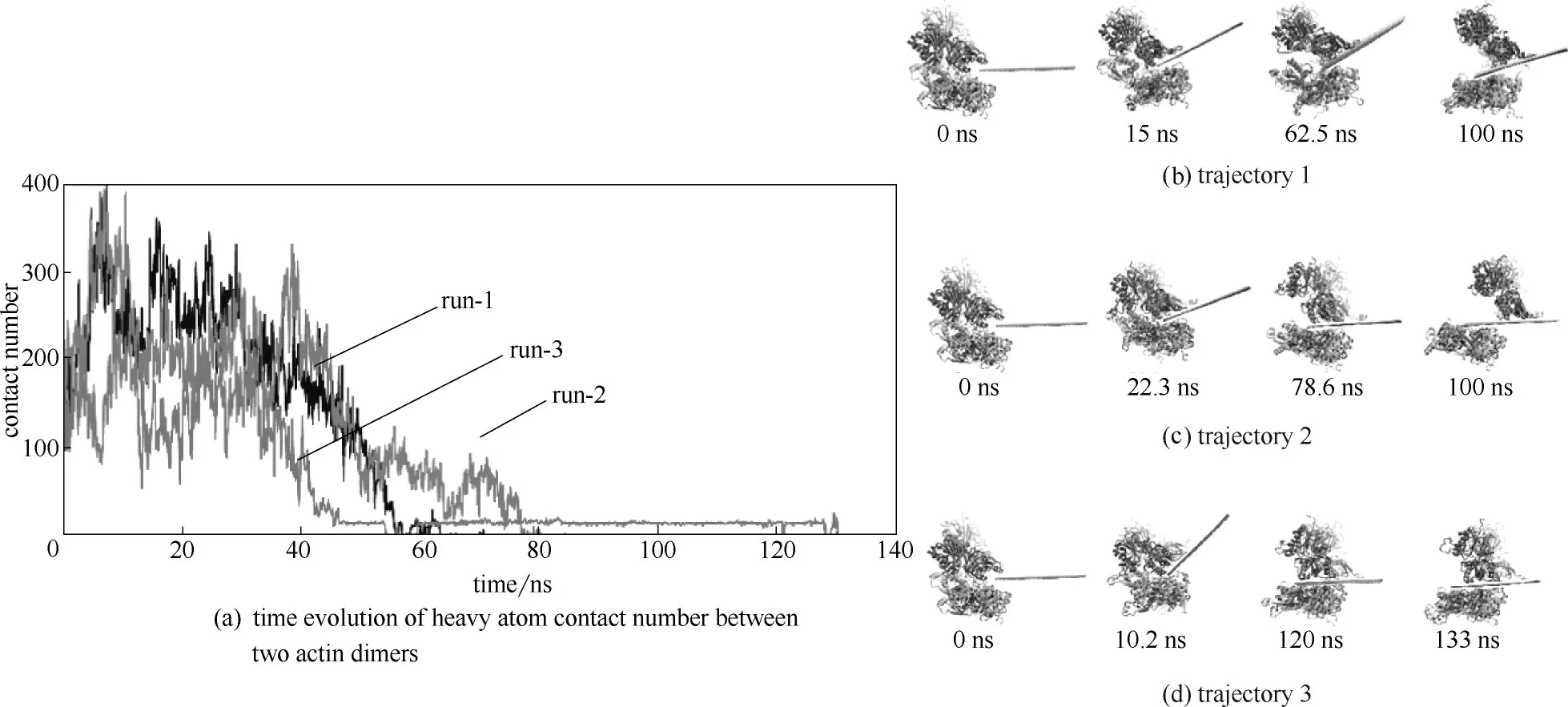
圖14 氧化墨烯和蛋白質的相互作用[65]Fig.14 Insertion process of GO nanosheet into interstrand gap of actin tetramer[65]
石墨烯除了可以插入蛋白質之間,還可以通過與蛋白質表面的殘基相互作用從而吸附蛋白質,改變蛋白質的結構。Zuo 等[26]利用分子動力學模擬還發現石墨烯可以通過π-π 相互作用與絨毛蛋白(HP)的芳香族殘基相結合,從而破壞蛋白質的二級結構。如圖13(a)所示,在模擬時間500 ns 內HP 蛋白逐漸吸附到石墨烯表面。在3 ns 時,F35 殘基吸附在石墨烯表面,此時HP 蛋白與石墨烯表面的接觸面積增加到250 ?2[圖13(b)];在t=7 ns 時,W23 殘基開始吸附在石墨烯表面,且HP 蛋白與石墨烯表面的接觸面積從250 ?2增加到300 ?2,同時HP 蛋白的第三條α 螺旋也開始吸附到石墨烯表面;在t=145 ns 時,F10 殘基吸附到石墨烯表面,蛋白質與石墨烯之間的接觸面積從300 ?2增加到750 ?2,并且HP 蛋白的第二條α 螺旋開始吸附到石墨烯表面。圖13(c)進一步說明了HP蛋白吸附在石墨烯表面上的過程:在沒有石墨烯插入的情況下,HP 蛋白的RMSD 是1.8 ?,此時HP蛋白處于穩定的環境并且α螺旋上有23 或24 個殘基;然而當石墨烯插入HP 蛋白后,其RMSD 從1.8 ? 增加到7.5 ?,且α 螺旋上的殘基數下降到10 個。HP 蛋白的三條α 螺旋中,第三條α 螺旋大部分被破壞,部分轉變成310螺旋和β轉角,第一條α 螺旋也有一部分轉變成β 折疊,第二條α螺旋幾乎沒有變化。這三條螺旋表現不同可能因為其螺旋上組成的氨基酸殘基不同。為了進一步研究殘基對HP 蛋白質吸附的影響,Zuo 等分析了殘基距離石墨烯表面的距離,如圖13(d)所示。觀察發現,F35、W23、F10 殘基通過和石墨烯之間的強烈的π-π 相互作用,先后分別吸附在石墨烯表面。因此,這些研究發現蛋白質的氨基酸殘基可以控制蛋白質吸附在石墨烯表面的過程,在吸附過程中其二級結構遭到了破壞。
2.3 氧化石墨烯和蛋白質的相互作用
氧化石墨烯和石墨烯都會破壞蛋白片段的二級結構,但石墨烯的破壞力較強,且在石墨烯表面螺旋結構會轉變為β折疊。為進一步研究氧化石墨烯插入蛋白質之間的過程,Tian 等[65]利用分子動力學模擬研究發現氧化石墨烯納米片能夠吸附肌動蛋白單體,從而改變其二級結構。圖14(a)顯示了肌動蛋白四聚體和氧化石墨烯之間的三次獨立的動力學模擬過程,研究發現插入氧化石墨烯后,隨著模擬時間的延長,肌動蛋白四聚體之間的重原子接觸數量急劇減少。圖14(b)~(d) 顯示了氧化石墨烯片插入兩個蛋白質二聚體之間的過程,發現在前兩次模擬過程中,當時間為100 ns時,肌動蛋白四聚體被氧化石墨烯片分開,這兩個蛋白質二聚體在氧化石墨烯表面表現出異步的移動方式。在第三次模擬過程中,在120 ns時,氧化石墨烯也會插入兩個蛋白質二聚體之間,破壞其結構。這些結果表明氧化石墨烯納米片通過范德華相互作用能插入肌動蛋白四聚體之間的鏈間間隙,破壞四聚體結構,從而在很大程度上破壞肌動蛋白的整體結構。
2.4 石墨烯量子點和蛋白質的相互作用
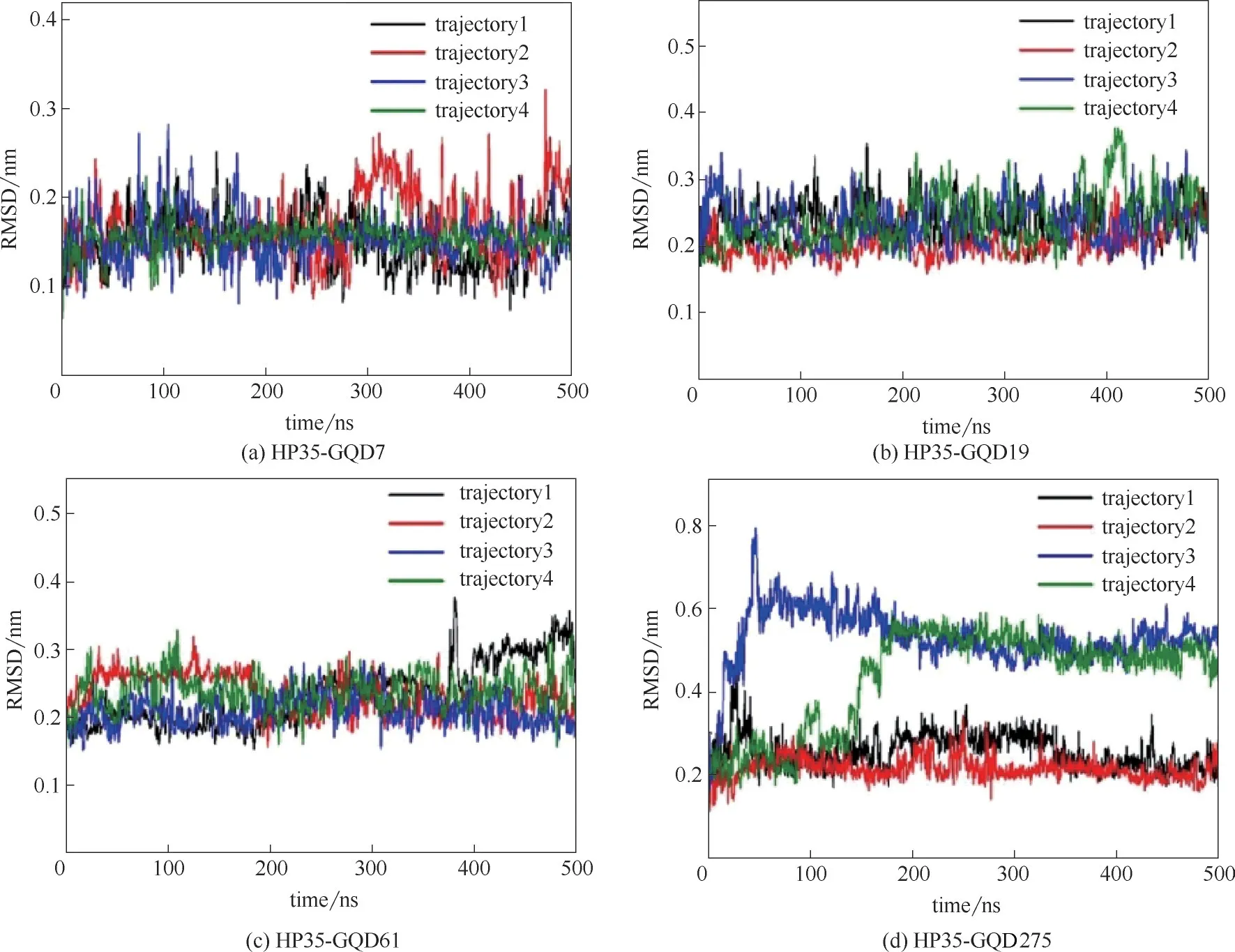
圖15 HP35吸附在不同大小的GQDs表面上的RMSD隨模擬時間的變化[67]Fig.15 Time evolution of RMSD of HP35 protein on GQDs with different size[67]
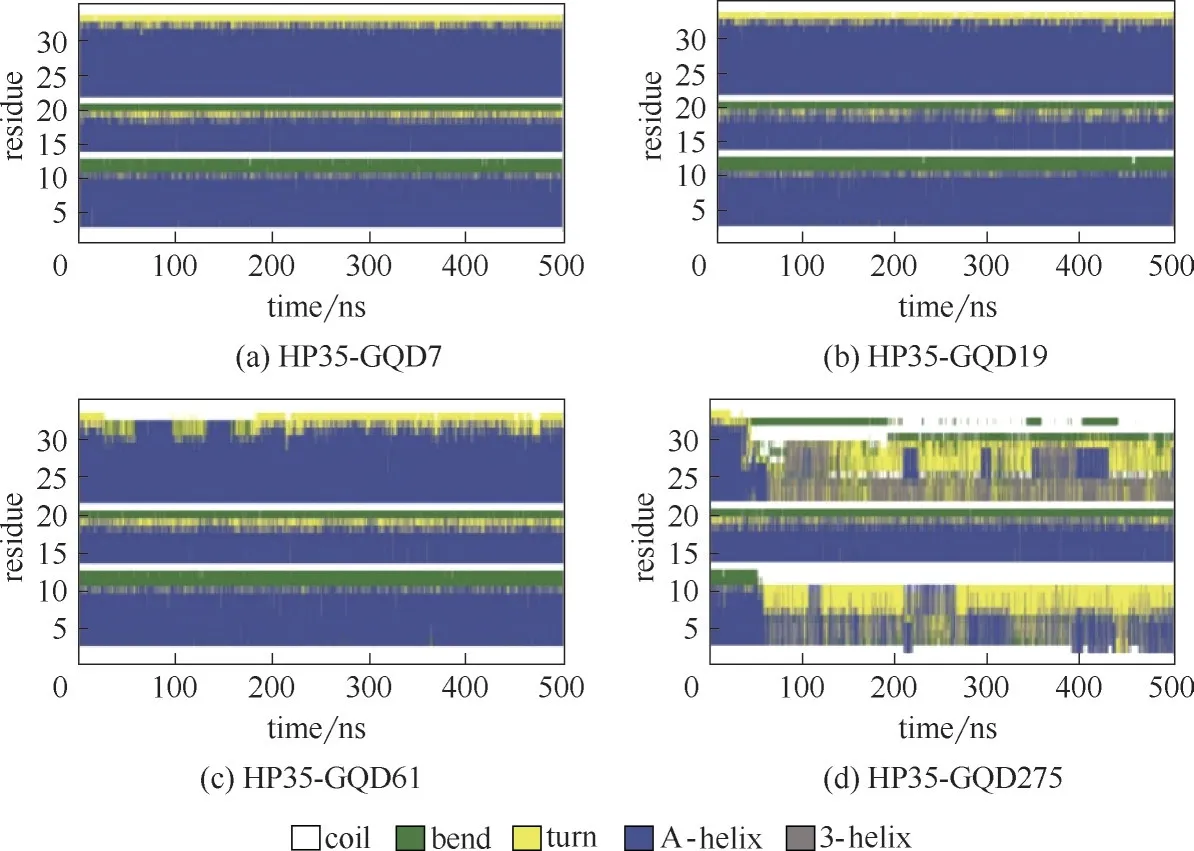
圖16 HP35蛋白吸附在不同大小的GQDs表面上的二級結構變化[67](其中二級結構根據DSSP算法得到[68])Fig.16 Time evolution of the secondary structure of HP35 upon binding to the surface of GOQDs with different size[67](here,the secondary structures are determined by DSSP program[68])
石墨烯量子點的潛在生物毒性不容忽視,研究發現石墨烯量子點能夠和蛋白質等生物大分子相互作用。比如Fang 等[66]采用實驗和分子動力學模擬相結合的方法,發現GQDs 可以通過識別結合位點吸附泛素蛋白。本課題組[67]運用分子動力學模擬方法研究了不同尺寸的石墨烯量子點(GQDs)對蛋白質HP35 吸附的結構影響。研究發現GQDs 的尺寸越大,殘基的吸附能力越強,吸附在GQDs 上的殘基數量也越多,而且對蛋白質的二級結構破壞也越大,進而對蛋白質產生一定的毒性。如圖15 所示,通過計算RMSD 來分析蛋白質的結構變化,在四個不同尺寸的GQDs體系中RMSD值分別穩定在0.16、0.24、0.24、0.36 nm,其 中 圖15(d) 顯 示HP35-GQD275這一體系的第三條軌跡在47 ns內RMSD值從0.2 nm 增加到0.78 nm,第四條軌跡在183 ns 之內RMSD 值從0.2 nm 增加到0.56 nm,與其他三個體系相比,變化最為明顯。為了驗證RMSD這一結果,又做了蛋白質的二級結構分析,如圖16所示。在圖16(d)中,發現HP35-GQD275的結構變化最為明顯,其中第三條α 螺旋部分轉變為310螺旋、轉角及卷曲,第一條α 螺旋部分轉變為轉角,但是其他三個體系[圖16(a)、(b)、(c)]的蛋白質的二級結構改變就相對較小。通過計算RMSD 和對蛋白質進行二級結構分析,發現GQDs的大小對蛋白質吸附在GQDs表面上起著重要的作用,并且隨著GQDs 尺寸的增加,蛋白質的結構變化更明顯。圖17 詳細介紹了蛋白質在最大尺寸GQDs 上的吸附過程,在第47 ns 時,位于第三條α 螺旋的最末端芳香族殘基W23 開始吸附在GQD275 表面[圖17(a)],與 此同時,W23 殘基與GQD275 表面之間的最短距離是0.36 nm[圖17(b)]。在第57 ns 時,芳香族殘基F10 也吸附在GQD275 表面[圖17(a)],此時F10 殘基與GQD275 表面之間的最短距離也是0.36 nm。這些最短距離和文獻中描述芳香族殘基與石墨材料之間的最短距離約為0.4 nm大致相近[26]。
3 石墨烯與DNA的相互作用
DNA 是染色體的主要組成成分,同時也是主要遺傳物質。DNA 分子的雙螺旋結構是相對穩定的。這是因為在DNA 分子雙螺旋結構的內側,通過氫鍵形成的堿基對使兩條脫氧核苷酸長鏈穩固地并聯起來。另外,堿基對之間縱向的相互作用力也進一步加固了DNA 分子的穩定性。生物分子(如DNA、蛋白質、細胞膜)與納米級材料的結合為高級復合納米材料的設計提供了機會。由于碳基納米材料獨特的物理化學結構、力學性能等,現已被廣泛用于生物傳感、生物醫療等各個領域[69-71]。比如氧化石墨烯因其具有良好的吸附性,可與DNA 結合用于生物傳感器[72-73]。含有納米孔的石墨烯表面可作為DNA 測序的潛在材料,其中石墨烯表面的工程化形態將調節DNA 的遷移和易位[74-77]。比如,Jagota 等[78]模擬了單鏈DNA 在石墨烯和碳納米管上的二級結構變化,他們發現可以通過鏈間氫鍵建立一類DNA結構(β折疊和β桶),并且單鏈DNA在石墨表面上呈平面形式。
3.1 純石墨烯和DNA相互作用
Zhao[79]使用分子動力學模擬研究了DNA 片段與水溶液中石墨烯表面的相互作用,發現雙鏈DNA在石墨烯表面吸附過程中結構會被破壞。圖18 顯示了DNA 片段可以快速調整它們的幾何取向,并在石墨烯表面上形成兩種不同的自組裝結構。第一種自組裝結構表現為DNA 片段1,3 和4 能夠旋轉并穩定在“站立”狀態。DNA 雙螺旋的軸在30 ns 內逐漸從平行幾何形狀轉變為垂直幾何形狀,這導致旋轉的DNA 片段在表面上形成森林狀結構。在觀察到的第二種類型的自組裝結構中,DNA 片段2 位于石墨烯表面上并保持其原始取向。在50 ns 模擬時間內都保持穩定的結構沒有發生移動。促使形成這兩種模式背后的驅動力是疏水性DNA 堿基對與石墨烯碳環之間的π-π 堆積作用。特別是當DNA在第二類自組裝中與石墨烯表面穩定結合時,DNA的末端堿基對由于嚴重變形而斷裂,從而對DNA 產生潛在的細胞毒性。
3.2 氧化石墨烯和DNA的相互作用
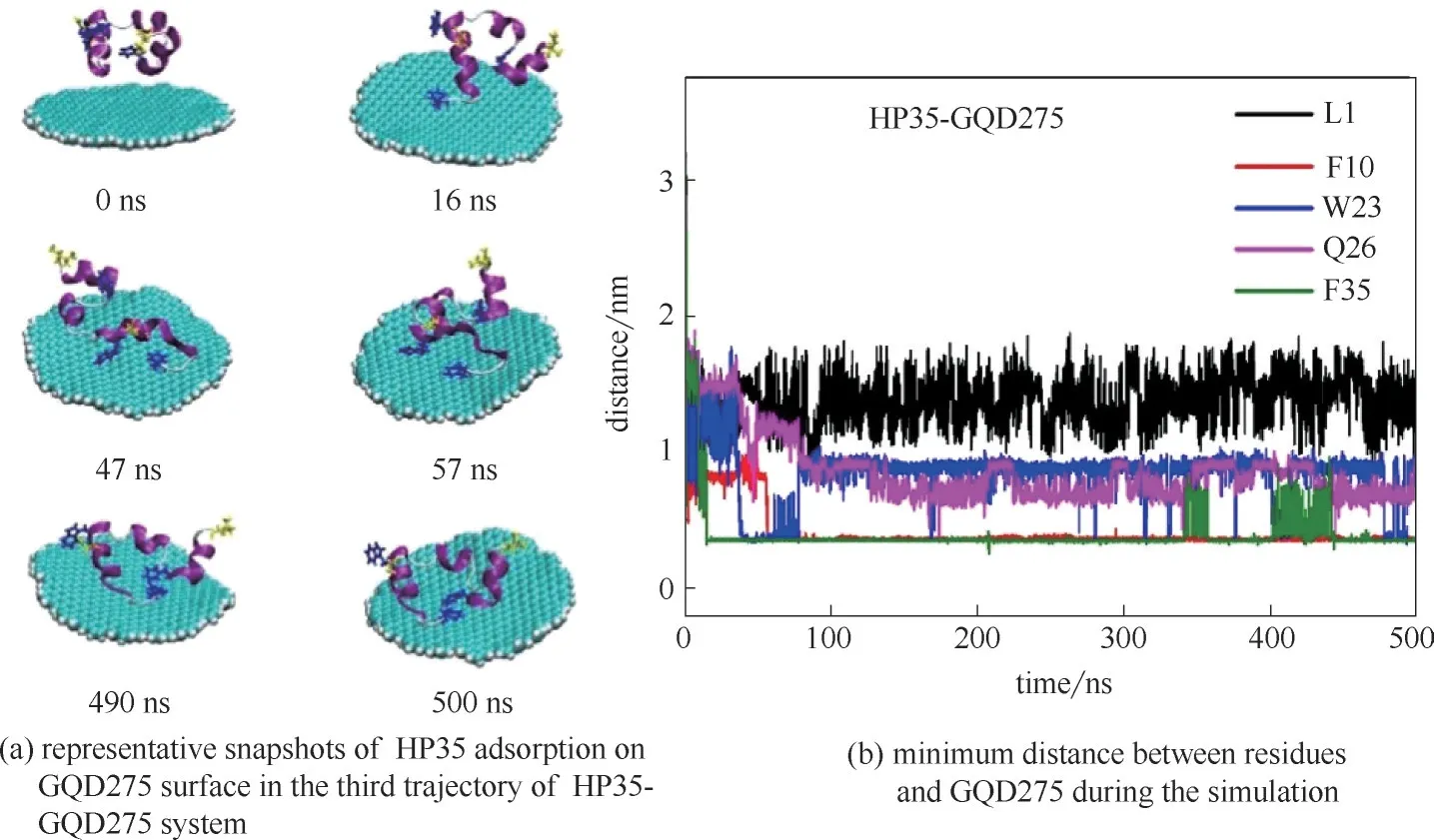
圖17 HP35吸附到石墨烯量子點表面的過程[67]Fig.17 Adsorption progress of HP35 on graphene quantum dots[67]
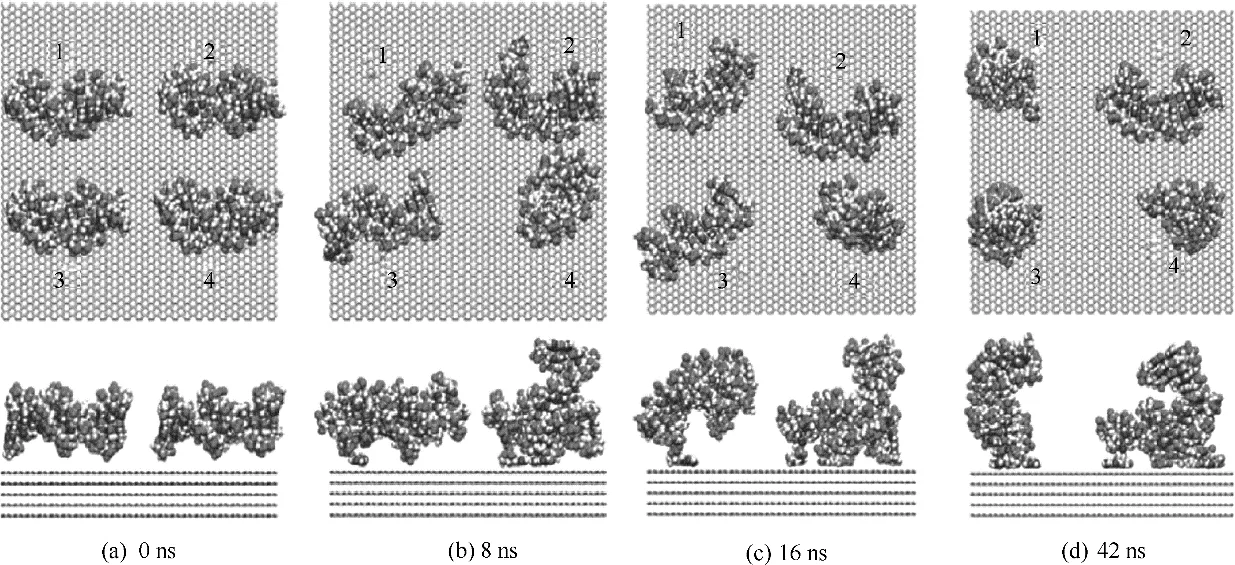
圖18 DNA吸附在石墨烯表面的過程[79]Fig.18 Self-assembly of DNA segments on graphene layers[79]
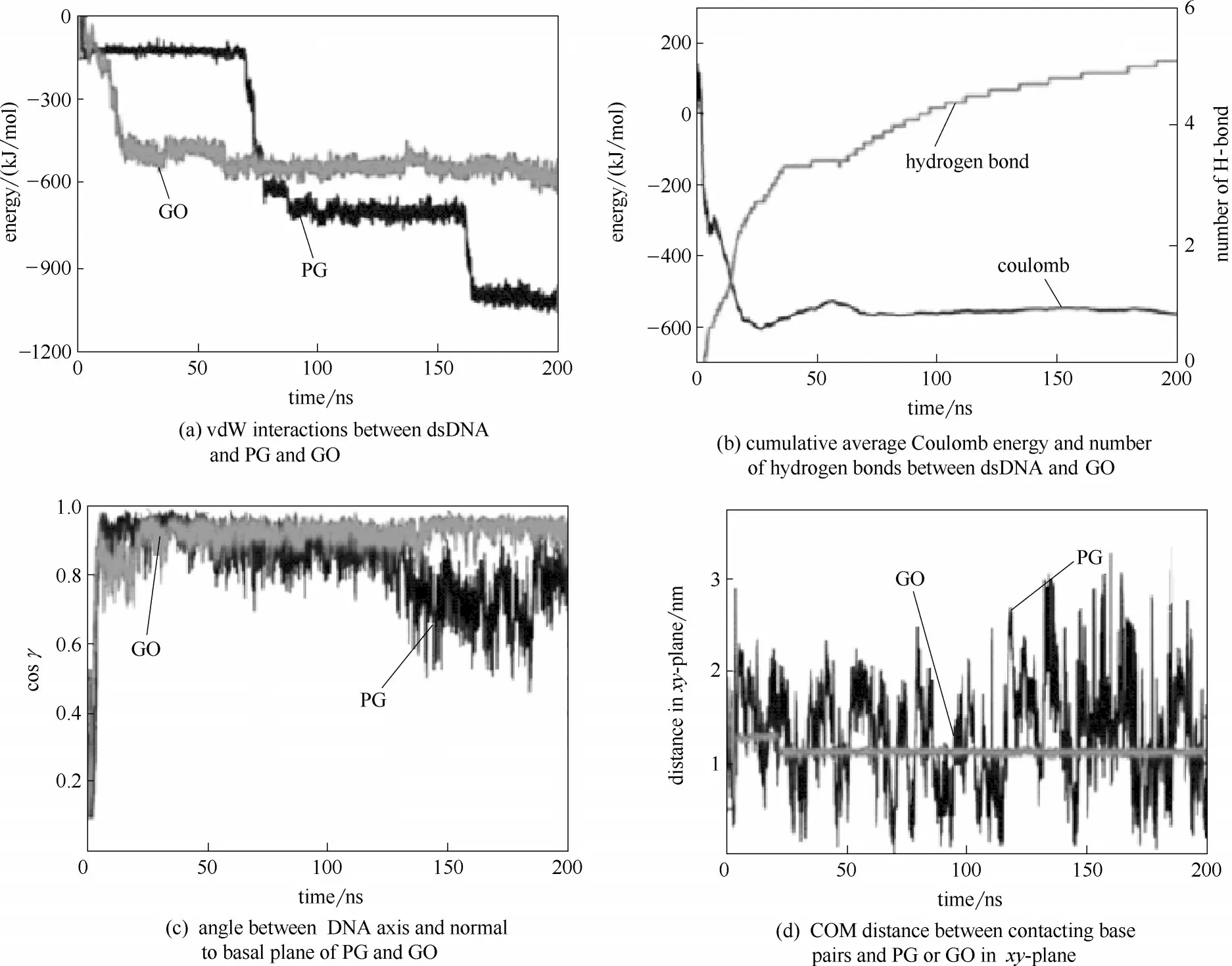
圖19 雙鏈DNA吸附在石墨烯和氧化石墨烯表面的相關分析[80]Fig.19 Interaction between DNA and graphene and graphene oxide[80]
有研究表明石墨烯、C60、碳納米管等碳基納米材料與DNA 的相互作用,會破壞DNA 的堿基對,從而破壞DNA 的結構,進而可能影響DNA 的功能。Chen 等[80]研究了短鏈DNA 在石墨烯和氧化石墨烯上的吸附方式,發現單鏈DNA 傾向于平躺在石墨烯和氧化石墨烯表面,而雙鏈DNA 則是垂直于石墨烯和氧化石墨烯表面,從而減少了其與碳表面之間的接觸面積,使得石墨烯和氧化石墨烯的吸附能力也減弱。如圖19(c) 所示,γ=0 (cosγ= 1) 表明雙鏈DNA 以垂直方式吸附在石墨烯和氧化石墨烯表面。圖19(d) 表明雙鏈DNA 可以在石墨烯表面自由移動,而在25 ns 時,雙鏈DNA 在氧化石墨烯表面的結合位點開始不再改變,并緊緊吸附在氧化石墨烯表面上。圖19(a)、(b)表明雙鏈DNA 和石墨烯、氧化石墨烯的相互作用主要靠范德華力和氫鍵。本次模擬結果表明,氧化石墨烯更傾向于吸附單鏈DNA 而不是雙鏈DNA。通過比較雙鏈DNA 在石墨烯和氧化石墨烯上的結合位點,還發現氧化石墨烯具有更好的吸附能力。因此,氧化石墨烯通過吸附DNA 與DNA發生相互作用從而破壞DNA的堿基對,進而破壞DNA的結構,給DNA帶來潛在的生物毒性。
3.3 氮化石墨烯和DNA的相互作用
Gu 等[24]通過分子動力學模擬和瓊脂糖凝膠電泳分析,研究了雙鏈DNA 與新近合成的氮化石墨烯(C2N)相互作用的結構和動力學性質變化,發現雙鏈DNA 以垂直的方式吸附在C2N 表面上。圖20 顯示雙鏈DNA 吸附在石墨烯過程中其界面處的端基對會發生變性,即堿基間氫鍵斷裂,釋放的堿基與石墨烯原子直接結合,在此期間DNA 和石墨烯表面接觸的原子數目也相應地增加。相比較而言,DNA 吸附在C2N 表面上的強度比較溫和,DNA 結構破壞程度也較石墨烯低。上述研究表明,雙鏈DNA 和單鏈DNA在石墨烯表面有不同的吸附方式,雙鏈DNA垂直于石墨烯表面而單鏈DNA 平行于石墨烯表面,因此石墨烯更傾向于吸附雙鏈DNA。在吸附過程中,雙鏈DNA 堿基對之間的氫鍵(特別是AT 間的氫鍵)斷裂,釋放的堿基與石墨烯原子直接結合,破壞DNA 堿基對的結構。因此石墨烯對DNA 具有一定的潛在毒性。
4 結論與展望
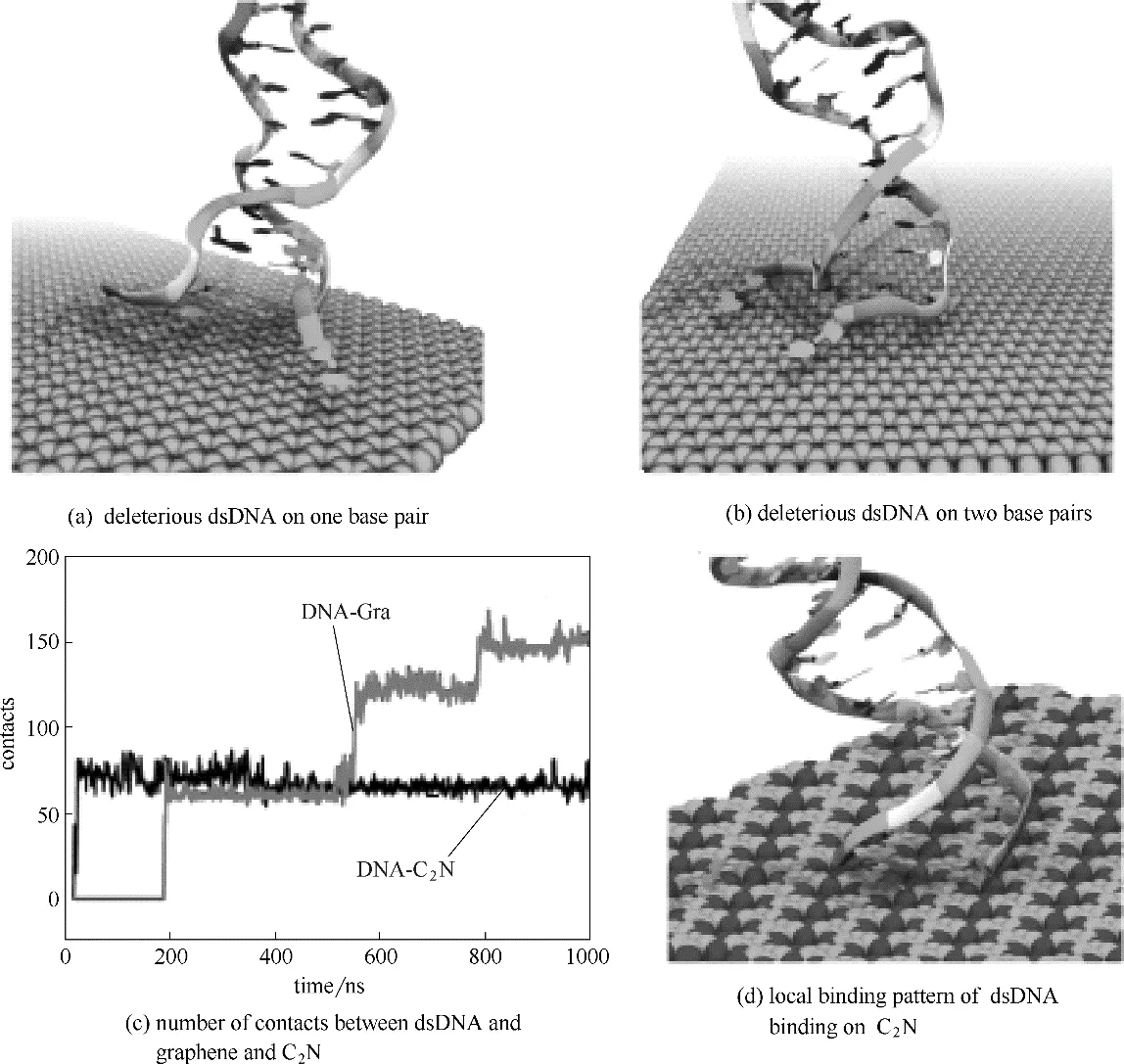
圖20 雙鏈DNA吸附在石墨烯表面及C2N表面上的過程[24]Fig.20 Interaction between dsDNA and graphene and C2N[24]
雖然石墨烯等納米材料具有獨特的物理、化學性質,并在生物醫藥研究領域廣泛應用,但是其生物安全性應引起人們的重視。本文總結了當前已報道的石墨烯及其衍生物在生物毒性方面的計算機模擬研究,研究表明石墨烯及其衍生物具有潛在的生物毒性:石墨烯可以吸取細胞膜表面的磷脂分子,破壞細胞膜的完整性;石墨烯通過π-π 相互作用能夠破壞蛋白質二級結構和DNA 堿基對等。石墨烯及其衍生物自身的物理化學性質對其生物效應有著決定性影響,這些性質包括尺寸、形狀、表面電荷、化學組成、表面修飾等。有關這些因素對生物膜毒性影響的研究還比較少,因此,進一步研究石墨烯及其衍生物的物理化學性質對生物膜毒性的影響十分必要。除此之外,生物環境中的鹽濃度、溫度、pH 等對石墨烯及其衍生物的生物毒性的影響也不是特別清楚,石墨烯及其衍生物對具體哪些蛋白質、生物膜的毒性影響仍然不清楚,即蛋白質、生物膜的種類對石墨烯及其衍生物的生物毒性的影響機制尚不明確。目前國內外對石墨烯與生物體相互作用的機制研究尚處于初級階段,石墨烯作用于生物體后引發的生理、生化反應及機制尚未有深入的研究,因此,相關領域的研究人員應進一步加強石墨烯及其衍生物的生物安全性研究,強化石墨烯及其衍生物對生物體作用的機制研究。

