應用于離子液體體系汽液平衡測定的液相配制、氣相分析方法
譚亞龍,舒高翔,崔林芳,章連眾
(浙江工業(yè)大學化工學院,浙江杭州310006)
引 言
對于汽液平衡測定而言,離子液體體系類似于傳統(tǒng)的含鹽體系,易過熱、爆沸。為了獲得平衡氣相組成樣品,汽液平衡釜通常需要有較大的氣相回流。這些是實現(xiàn)配制液相組成的困難所在。關于汽液平衡測定文獻中已有全面的討論[1-5]。Pereiro等[6]綜述了離子液體應用于共沸體系分離,涉及多種方法測定眾多離子液體體系的汽液平衡數(shù)據(jù)。具體有頂空法、靜態(tài)法以及應用較多的循環(huán)法。
汽液平衡測定的物理量包括溫度(T)、壓力(p),以及氣、液相組成(x、y)。通常,頂空法[7-13]測定Txy數(shù)據(jù),靜態(tài)法[14-16]測定Tpx數(shù)據(jù)。循環(huán)法可以同時測定Tpxy數(shù)據(jù)[17-25],其中擬靜態(tài)法一般測定Tpx數(shù)據(jù)[26-29]。一般而言,頂空法、靜態(tài)法和擬靜態(tài)法比較容易實現(xiàn)液相配制。本課題組采用基于氣液雙循環(huán)的液相配制、氣相分析方法[30-32],基本思路來源于韓世鈞先生研究團隊發(fā)展的汽液平衡測定的擬靜態(tài)法[3]和置換法[4],以及能夠主動提供氣化中心的沸騰器結構[5]。該方法的特點是液相配制并且同時測定Tpxy數(shù)據(jù),因此能夠避免較為煩瑣的含離子液體液相的分析,能夠不依賴活度系數(shù)模型獲得揮發(fā)性組分的活度系數(shù)。
基于課題組前期工作[30-35],本文討論實現(xiàn)液相配制、氣相采樣分析汽液平衡釜的基本特征,并提出改進的氣相回流器和沸騰器結構。對于含任意揮發(fā)性組分和非揮發(fā)性組分體系,提出了液相組成計算方法和誤差估計。面向萃取精餾應用,討論了連續(xù)配制方法。
1 汽液平衡釜
如圖1 所示,汽液平衡釜的沸騰器具有夾套結構,能夠主動提供氣化中心;泵式磁力攪拌提供強制液相循環(huán);填料柱提供氣液接觸界面和停留時間以消除過熱。三方面綜合的結果保證了沸騰器穩(wěn)定運行。通常,平衡溫度在30 min 內波動不大于0.01 K。尤其重要的是,液相回流能夠獨立于氣相回流。液相回流量由磁力攪拌轉速調節(jié),通常大于500 cm3/min;而氣相回流量則由沸騰器加熱量調節(jié),通常穩(wěn)定在2 cm3/min。氣相物料離開平衡室后立即冷凝,并聚集于溢流式氣相樣品池。
其中,改進的氣相回流器采用變徑結構并增加一個球泡,有利于氣相逐滴穩(wěn)定回流;氣液相在沸騰器底部回流,有利于釜內快速達到平衡。
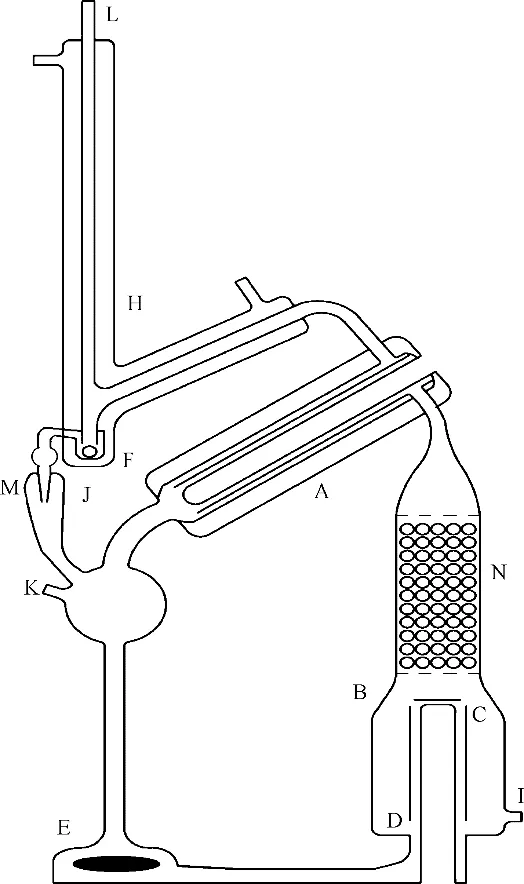
圖1 具有液相配制、氣相采樣分析特征的汽液平衡釜Fig.1 Vapor-liquid equilibrium still featuring synthetic liquid phase composition and vapor phase sampling and analysis
2 液相組成計算方法
如圖2 所示,通常將汽液平衡釜中物料歸類為總體、液相和氣相三種。三者的總和即配制物料。首先考慮平衡釜內靜態(tài)物料衡算。從平衡釜結構來看,液相物料量占比很小,組成非常接近總體物料。因此,在靜態(tài)物料衡算中將液相物料并入總體物料。據(jù)此,總體物料中任意組分i的質量m是其在配制物料中的質量減去其在氣相物料中的質量,即

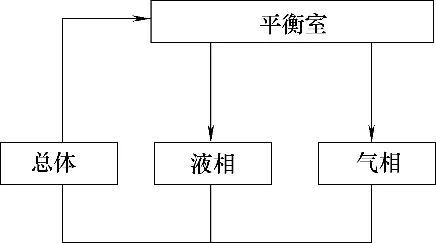
圖2 雙循環(huán)汽液平衡釜物料的總體、液相和氣相分布Fig.2 Distribution of materials of bulk,liquid and vapor phase in a double-circulation vapor-liquid equilibrium still
其中,下標b、s、v 分別表示總體、配制和氣相。對于離子液體,其在氣相物料中的質量為零。對于揮發(fā)性組分,其在氣相物料中的質量由氣相滯留體積、氣相密度和氣相組成計算。氣相組成由分析獲得,氣相密度根據(jù)氣相組成估算。滯留體積包括氣相樣品池中樣品滯留體積(2.5 cm3)和管壁樣品滯留體積(估計為0.2 cm3)。根據(jù)各組分在總體物料中質量可以計算各組分的質量分數(shù)。
進一步,依據(jù)動態(tài)物料衡算計算各組分液相質量分數(shù)
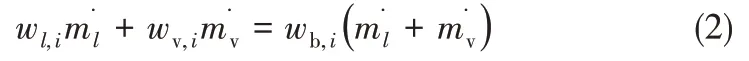
其中,w為質量分數(shù),m?為質量流量,下標l表示液相。定義
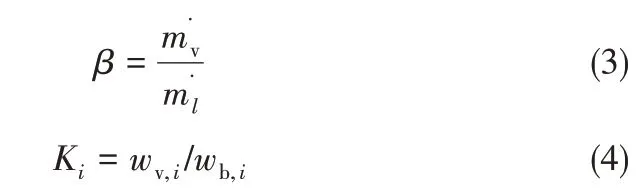
則
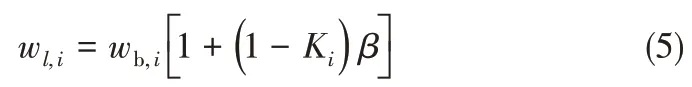
根據(jù)氣相和液相回流量并考慮到氣液兩相密度差異,通常將β估計為0.003。式(3)~式(5)適用于任意體系的揮發(fā)性或非揮發(fā)性組分。對于離子液體,Ki=0。
最后,由各組分質量分數(shù)可以方便地計算摩爾分數(shù),并進一步計算各組分活度系數(shù)。
由式(5)計算各組分液相組成,其相對誤差為
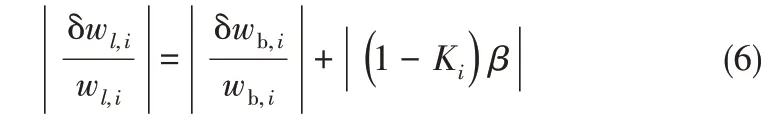
顯然,誤差由兩項組成。第一項是總體物料中各組分質量分數(shù)的相對誤差,主要來源于加料過程中特別是含量較低組分的揮發(fā),以及管壁樣品滯留體積的估計誤差。考慮到平衡釜容量為270 cm3,而且含量較低揮發(fā)性組分會最后加入以避免揮發(fā)損失,這部分誤差通常并不顯著。第二項來源于β值的估計誤差,并且與Ki有關。如果β值的誤差是0.001,Ki=3,則該項相對誤差貢獻為0.002,對應于組分質量分數(shù)的相對誤差是0.2%,或者組分活度系數(shù)的相對誤差也是0.2%。
3 連續(xù)配制方法與應用
通過置換沸騰器內物料,將一部分含有離子液體的物料置換為體積相當、不含離子液體且揮發(fā)性組分比例相同的物料,可以連續(xù)測定揮發(fā)性組分比例保持不變、離子液體含量不同的一系列數(shù)據(jù)。圖3 給出了水(1) + 乙醇(2) + [bmim]BF4(3)[33]和水(1) +乙腈(2)+[bmim]BF4(3)不同[bmim]BF4質量分數(shù)w3下的泡點溫度T[圖3(a)]和氣相組成y2[圖3(b)]。實驗測定在p=100 kPa 下進行,沸騰器物料定量置換使得水(1)+乙醇/乙腈(2)擬二元體系中水的摩爾分數(shù)x?1保持在0.050基本不變。
上述體系的液相組成由x?1和w3描述。現(xiàn)在分析液相組成的計算誤差。依據(jù)式(6),分為2 個部分。
(1)考慮β取值對應的誤差。對于含乙醇體系,K1值隨著離子液體濃度下降從9減小到3;對于含乙腈體系,K1值則從4 減小到1。如果β值的誤差是0.001,對應的x?1相對誤差小于1%。對離子液體,Ki=0,w3的相對誤差是0.1%。
(2)考慮總體物料組成的計算誤差。計算表明,如果氣相滯留體積誤差為0.2 cm3,則wb,3和x?b,1的相對誤差均小于0.1%。應該指出,連續(xù)置換過程中總體物料組成的計算誤差是累積的,而β取值對應的誤差不會累積。對應于270 cm3的總物料,如果置換其中的27 cm3,則wb,3和x?b,1的相對誤差將由0.001累積至0.001×(1+27/270)=0.0011。如果置換量為81 cm3,則新的誤差是0.0013。據(jù)此,上述體系最后實驗點的wb,3和x?b,1的相對誤差小于0.4%。
上述有規(guī)律的實驗安排有利于討論[bmim]BF4對水+乙醇和水+乙腈汽液平衡行為的影響。圖3(c)給出了乙醇或乙腈對水的相對揮發(fā)度α21隨w3變化的趨勢。離子液體的加入能夠明顯提高相對揮發(fā)度,但兩個體系破除共沸所需離子液體質量分數(shù)有著明顯差異。為了探究更深層次的原因,圖3(d)、(e)分別給出了水的活度系數(shù)γ1,以及乙醇或乙腈的活度系數(shù)γ2與w3的關系。基于氣相是理想氣體這一假設,相對揮發(fā)度與活度系數(shù)的關系是

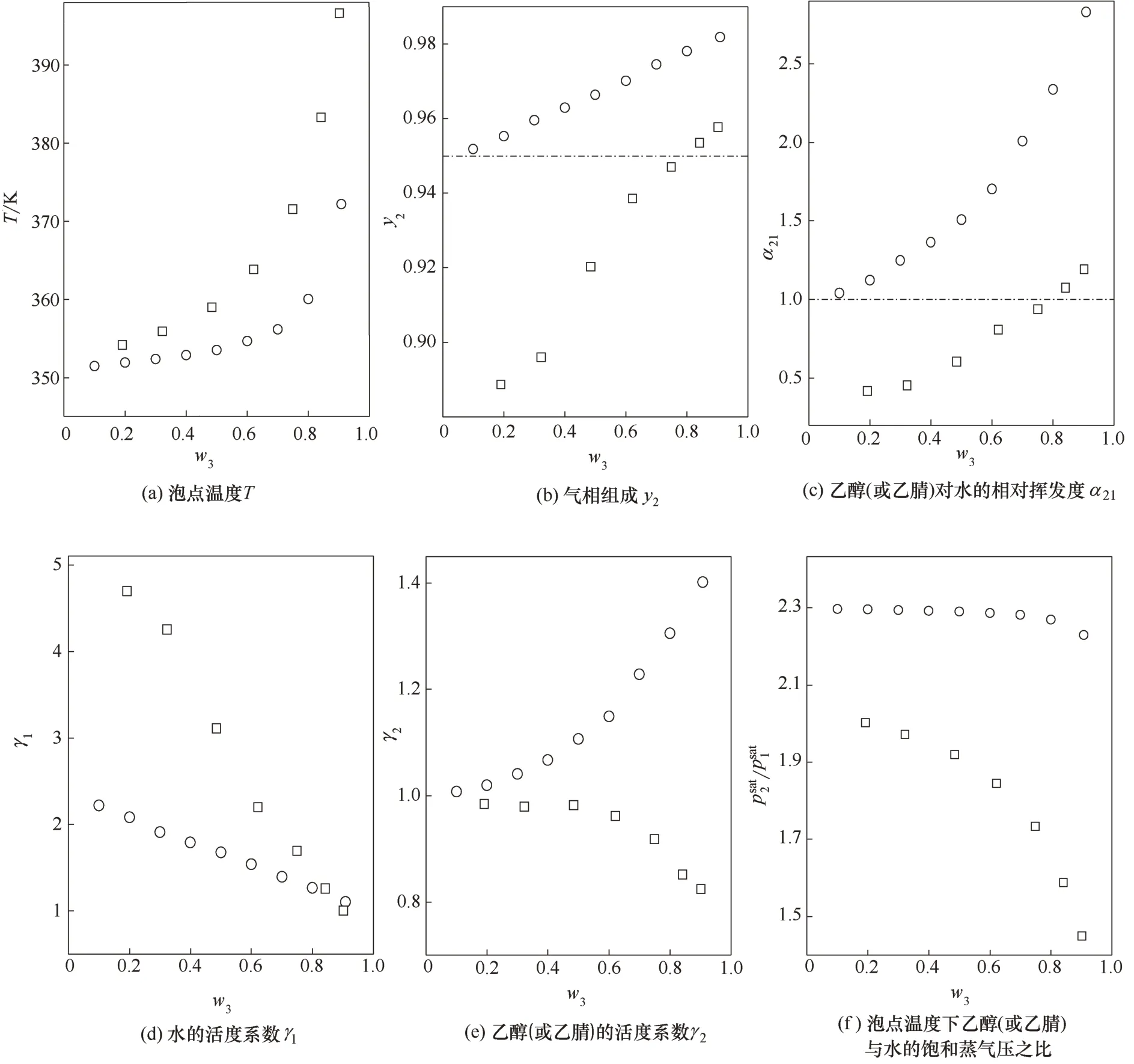
圖3 水(1)+乙醇(2)+[bmim]BF4(3)和水(1)+乙腈(2)+[bmim]BF4(3)汽液平衡行為的比較(p=100 kPa;x?1=0.050)Fig.3 Comparison of vapor-liquid equilibrium behavior of water(1)+ethanol(2)+[bmim]BF4(3)and water(1)+acetonitrile(2)+[bmim]BF4(3)(p=100 kPa;x?1=0.050)
4 結 論
液相配制、氣相分析方法應用于測定離子液體體系汽液平衡,能夠避免較為繁瑣的含離子液體液相的分析,能夠不依賴活度系數(shù)模型獲得揮發(fā)性組分的活度系數(shù)。通過連續(xù)置換配制,可以實測獲得揮發(fā)性組分的活度系數(shù),揭示活度系數(shù)隨組成的變化規(guī)律,并應用于萃取精餾溶劑性能的評價及篩選。改進的氣相回流器和沸騰器結構,有利于氣相逐滴穩(wěn)定回流,有利于釜內快速達到平衡。本文提出的液相組成計算方法和誤差估計適用于任意體系的任意組分。
符 號 說 明
Ki——組分i的氣相和總體質量分數(shù)比值
mb,i,ms,i,mv,i——組分i的總體、配制和氣相質量,g
pisat——組分i的飽和蒸氣壓
wb,i,wl,i,wv,i——組分i的總體、液相和氣相質量分數(shù)
wi——組分i的質量分數(shù)
x'i——不考慮離子液體存在時擬二元體系組分i的摩爾分數(shù)
yi——組分i的氣相摩爾分數(shù)
αij——組分i對組分j的相對揮發(fā)度
β——氣相和液相質量流量比值
γi——組分i的活度系數(shù)
下角標
b,s,v——總體、配制和氣相
i,j——組分i,j

