四元體系CaCl2-CaSO4-CaB6O10-H2O 308.15 K相平衡研究
袁菲,宋江濤,胡佳音,郭亞飛,王士強,鄧天龍
(天津科技大學化工與材料學院,天津300457)
引 言
柴達木盆地的南翼山地區儲藏著大量的富鉀、鈣、硼的油田鹵水和地下鹵水[1-4],其鹵水組成屬于復雜六元體系(K+, Na+, Ca2+, Mg2+//Cl-, borate-H2O)。眾所周知,鹵水中鹽類物質的開發利用往往通過太陽能進行蒸發、結晶、加熱和冷卻等工藝過程,而水鹽體系相圖具有重要的指導作用[5-9]。為了充分地開發和利用這一寶貴的鹵水資源,對涉及該復雜六元體系相應的子體系已有報道。Lei 等[10]研究了三元體系(CaCl2+CaB6O10+H2O)在308.15、323.15 K 時的穩定相平衡;Deng 等[11]對三元體系(KCl+ CaCl2+H2O)在288.15和308.15 K下的介穩相平衡進行了研究;孟令宗等[12]和羅炳威等[13]分別對三元體系(Mg2+//Cl-,Borate-H2O)在308.15 K 和323.15 K 的穩定相平衡進行了研究;Wang 等[14]報道了交互四元體系(Na+,Ca2+//Cl-, Borate-H2O)在288.15 K 下的穩定相平衡;桑世華等[15-16]報道了三元體系(Na+, K+//B4O2-7-H2O)和四元體系(Mg+, K+//Cl-, B4O2-7-H2O)在288.15 K 下的固液相平衡研究;曾英等[17]對四元體系(Na+, K+//Cl-, B4O2-7-H2O)在273.15 K 的介穩相平衡進行了研究。
氯化鈉和氯化鉀在蒸發結束時幾乎會完全從鹵水中結晶出來,硼和鈣在母液中高度濃縮,因此,含鈣、硼體系相平衡的研究對開發利用該地區鹵水資源尤為重要。同時,硼酸鈣是一種低成本的化合物,可用于陶瓷添加劑原料、潤滑油添加劑、發光材料等方面,而目前對其的研究仍然不足[18-22]。根據2005~2014 年的統計數據,每年6~8 月油田鹵水區的溫度在303.35~313.05 K 之間[23-24],平均溫度為308.15 K。因此,本文對四元體系CaCl2-CaSO4-CaB6O10-H2O 在308.15 K 時的相平衡進行了研究。對該體系穩定相平衡的研究不僅可以對鹵水體系溶解度數據庫進行補充,而且可以為油田鹵水中鈣、硼資源的綜合開發和高效利用提供重要的基礎數據。
1 實驗材料和方法
1.1 儀器與藥品試劑
主要儀器:HXG-500-12A型恒溫水浴磁力攪拌槽(北京惠城佳儀,控溫精度±0.01℃),Abbemat 550高精度折光率儀(安東帕,精度±0.0002),DMA4500型高精度密度計(安東帕,精度±0.05 mg/cm3),PH 7310 精密pH 計(WTW,精度± 0.02);CC-K6 恒溫水浴(Huber,控溫精度± 0.01℃);X 射線粉晶衍射儀(MSALXD-3,北京普析);艾科浦超純水機(AWL-0502-U,重慶)。
主要藥品試劑:CaCl2和CaSO4(國藥集團化學試劑有限公司),純度均為A.R.級,經重結晶后備用;由于尚無商用高硼鈣石(CaB6O10·5H2O),本實驗根據文獻方法采用CaO 和H3BO3實驗室合成[25-26],經重結晶后進行化學組成分析和X 射線粉晶衍射鑒定,結果見表1 和圖1,純度≥99.5%;使用去離子蒸餾水(DDW)來配制實驗所需溶液和離子分析測定,其電導率小于1×10-4S·m-1,pH=6.60。
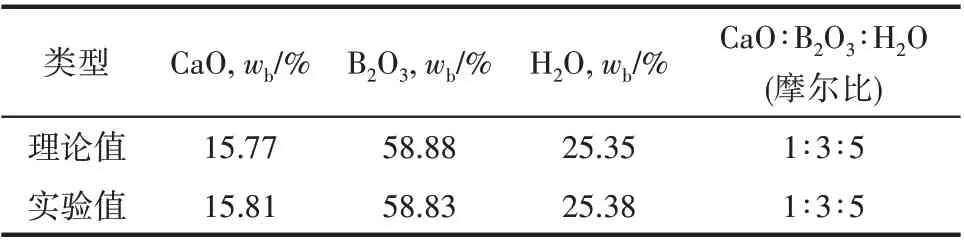
表1 CaB6O10·5H2O化學分析數據Table 1 Chemical analysis data of CaB6O10·5H2O
1.2 實驗方法
本研究采用了等溫溶解平衡法[27-28]。即先在200 ml 硬質塑料瓶中配制三元體系共飽點,再依次加入第三種鹽,攪拌至平衡[29]。例如:從三元體系CaCl2-CaSO4-H2O 的共飽點A,在不同的硬質塑料瓶中,依次加入CaB6O10·5H2O 配制成一系列復體點,將配制好的溶液放置于溫度為(308.15±0.01)K 的恒溫水浴槽中,以120 r·min-1攪拌。持續攪拌約90 d,并定期取液相進行化學分析,直至溶液中化學組成不變,即達到溶解平衡。將溶液靜置沉淀,固液分離后分析液相組分,并在(308.15±0.01) K 恒溫條件下測定平衡液相的物化性質(密度、折射率、pH),平衡固相采用X射線粉晶衍射法進行鑒定。
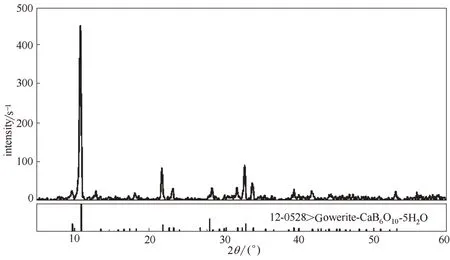
圖1 CaB6O10·5H2O的XRD譜圖Fig.1 XRD pattern of gowerite(CaB6O10·5H2O)
1.3 分析方法
液相中Cl-的測定采用汞量法[30],即在二苯偶氮碳酰肼和溴酚藍混合指示劑的作用下,用Hg(NO3)2溶液滴定至待測溶液由黃色突變為紫藍色,誤差≤±0.3%;SO2-4的測定采用硫酸鋇質量法[30],用過量的BaCl2溶液使SO2-4完全沉淀,將沉淀洗滌,烘干恒重,誤差≤±0.05%;B6O2-10的測定采用改進的甘露醇質量法[30],在甲基紅和酚酞雙指示劑的作用下,用NaOH 溶液滴定待測液由亮黃色突變為橙黃色,誤差≤±0.05%;Ca2+的測定采用EDTA 滴定法[30-31],在少量5%指示劑固體混合物(5 g 鈣指示劑和95 g 氯化鈉混合)的作用下,用EDTA 溶液滴定至溶液由酒紅色突變為天青色,即為反應終點,其誤差≤±0.3%。每組分析測定均進行三次平行實驗,其平均值為最終實驗結果。
2 實驗結果與討論
2.1 穩定相平衡研究
該四元體系溶解度數據(wB/%,質量分數)及干基組成(ZB/[g·(100 g·S)-1])見表2。根據表2中干基組成繪制了相應的干基圖及水圖,分別見圖2、圖3。
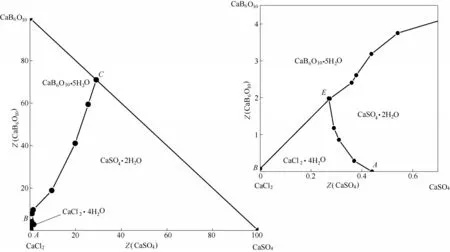
圖2 四元體系CaCl2-CaSO4-CaB6O10-H2O在308.15 K下的干基圖及局部放大圖Fig.2 Dry-salt phase diagram and part enlargement of phase diagram for quaternary system (CaCl2-CaSO4-CaB6O10-H2O)at 308.15 K
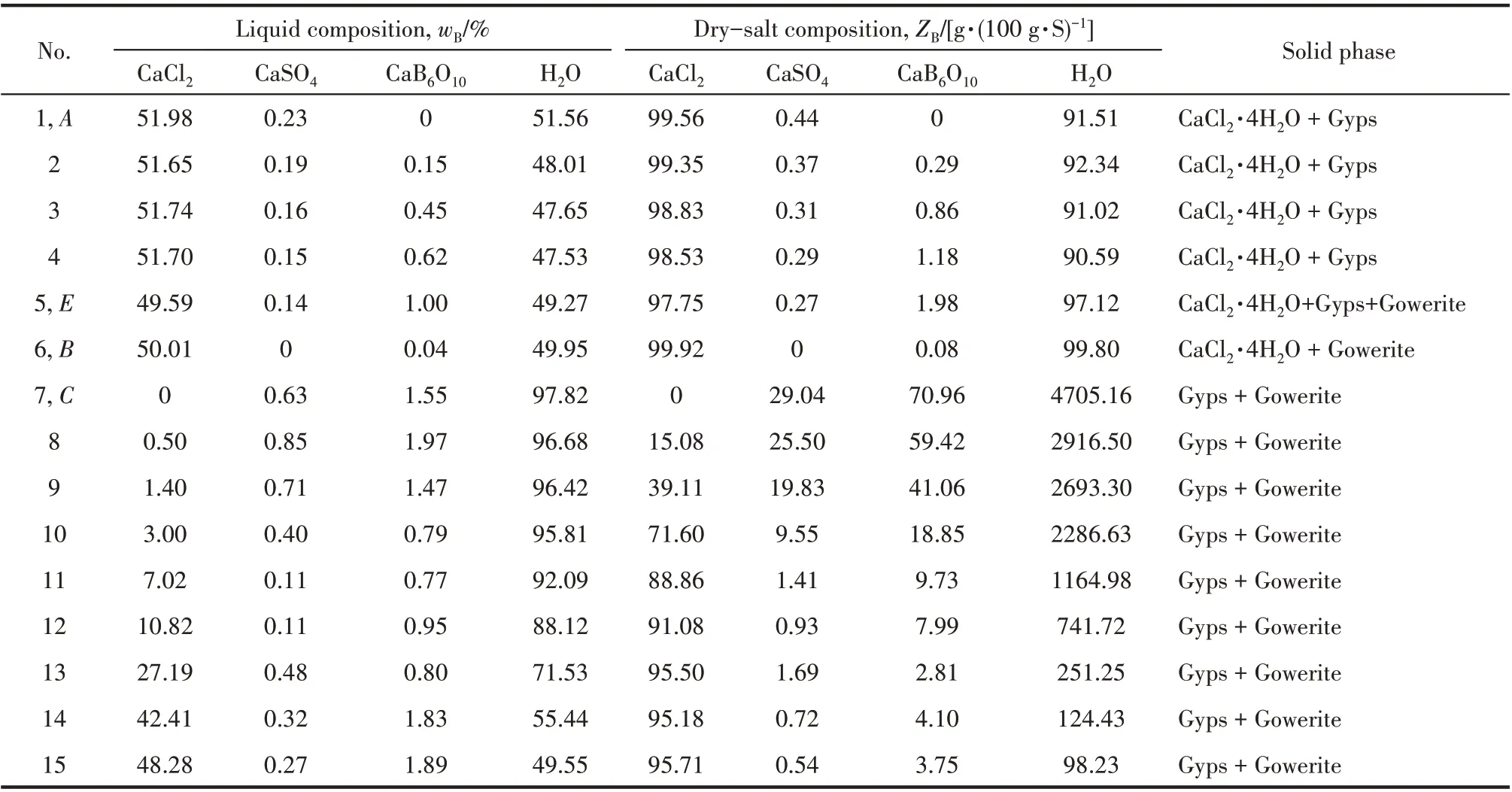
表2 四元體系CaCl2-CaSO4-CaB6O10-H2O在308.15 K下溶解度數據Table 2 Solubilities of quaternary system(CaCl2-CaSO4-CaB6O10-H2O)at 308.15 K
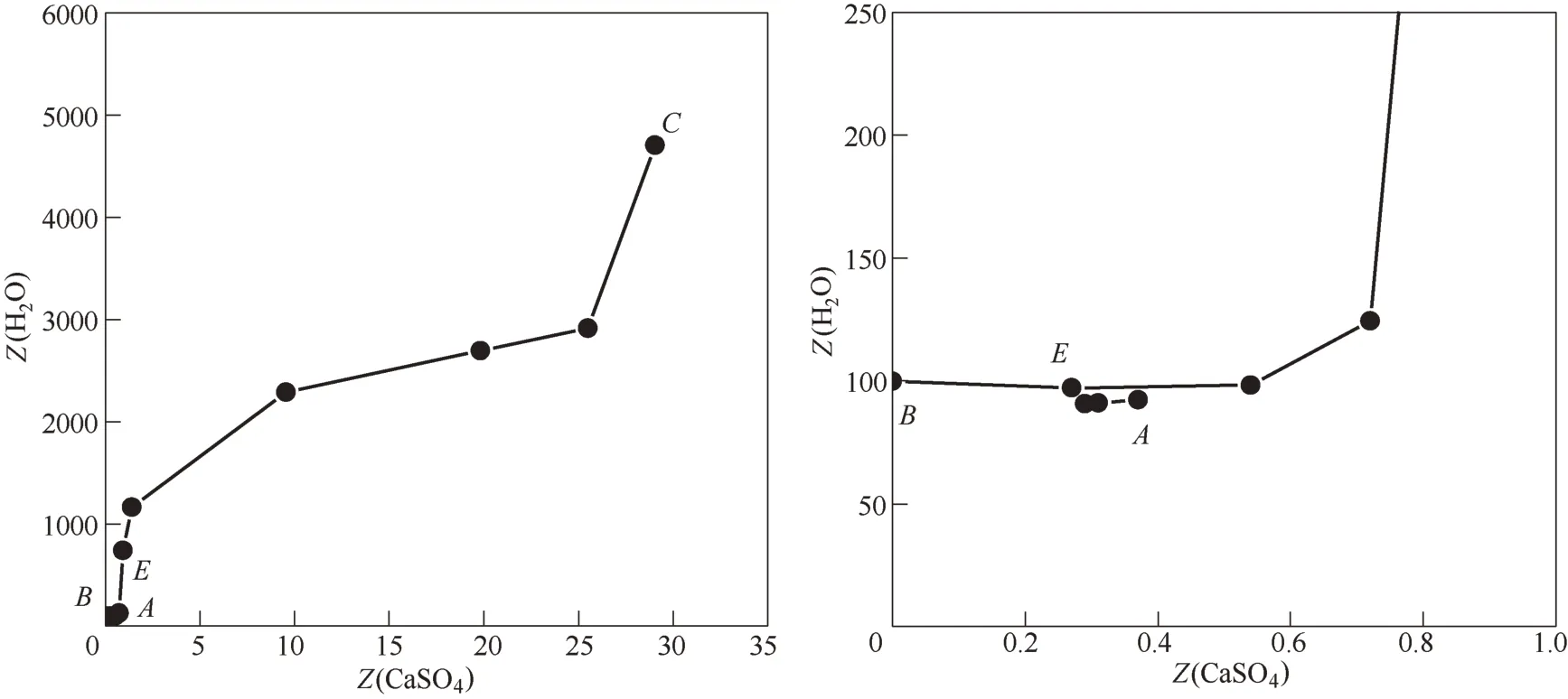
圖3 四元體系CaCl2-CaSO4-CaB6O10-H2O在308.15 K下的水圖及局部放大圖Fig.3 Water-phase diagram and part enlargement of water-phase diagram for quaternary system (CaCl2-CaSO4-CaB6O10-H2O)at 308.15 K
由圖2 可見,四元體系CaCl2-CaSO4-CaB6O10-H2O 在308.15 K 時既無復鹽也無固溶體生成,屬于簡單水合物I 型。該四元體系干基圖的3 個邊界點A、B和C分別對應于3個三元子體系的共飽點,依次是:①CaSO4-CaCl2-H2O 共飽點A的平衡固相為CaSO4·2H2O + CaCl2·4H2O;②CaCl2-CaB6O10-H2O,共 飽 點B的 平 衡 固 相 為CaCl2·4H2O + CaB6O10·5H2O;③CaB6O10-CaSO4-H2O,共飽點C的平衡固相為CaB6O10·5H2O + CaSO4·2H2O;該干基圖由1 個共飽 點E(組 成 為:w(CaCl2) = 49.59%,w(CaSO4) =0.14%,w(CaB6O10) = 1.00%),對應的平衡固相為CaCl2·4H2O+CaSO4·2H2O+CaB6O10·5H2O、3條單變量溶解度曲線(AE、BE和CE)、3 個單鹽結晶區(分別對應于為CaCl2·4H2O、CaSO4·2H2O 和CaB6O10·5H2O)組成。取共飽點E的平衡固相用X 射線粉晶衍射儀(XRD)進行表征,結果見圖4。從圖4 中可以看出平衡固相的峰位與標準圖譜一致,證明該點確實為該四 元 體 系 的 共 飽 點E(CaCl2·4H2O + CaSO4·2H2O +CaB6O10·5H2O)。由表2 和圖2 中可見,CaSO4溶解度最小,硬石膏CaSO4·2H2O結晶區面積最大,CaB6O10·5H2O 結 晶 面 積 次 之,而CaCl2溶 解 度 最 大,CaCl2·4H2O的結晶區最小。
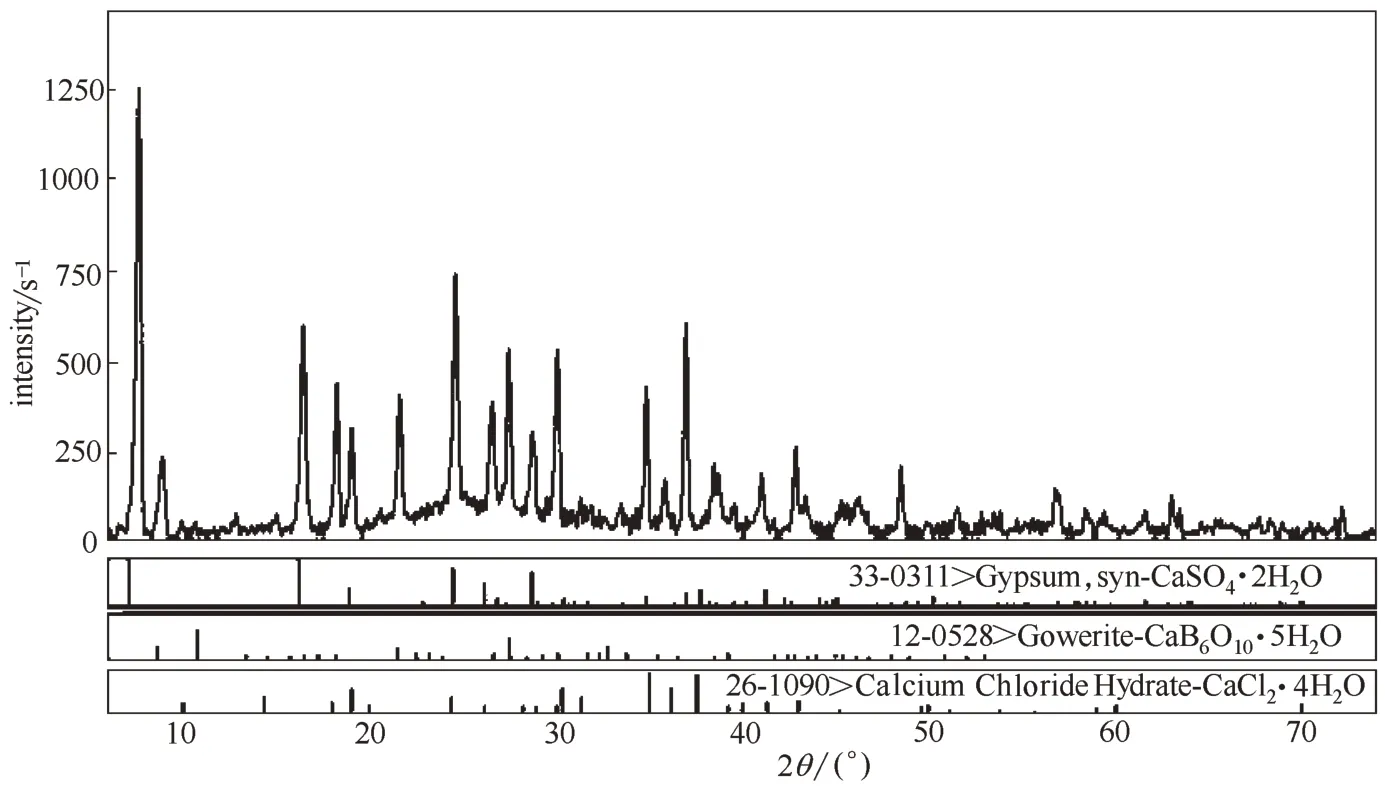
圖4 共飽點E(CaCl2·4H2O+CaSO4·2H2O+CaB6O10·5H2O)的XRD譜圖Fig.4 XRD pattern of invariant point E(CaCl2·4H2O+CaSO4·2H2O+CaB6O10·5H2O)
2.2 穩定相平衡物化性質研究
平衡液相的折射率、密度和pH 測定結果見表3。由表3 物化性質數據繪制了物化性質-組成圖(圖5)。由圖可以看出:①圖5(a)是折射率nD與氯化鈣(CaCl2)濃度組成圖。從圖中可以看出,隨著氯化鈣濃度的增加,溶液折射率整體呈逐漸增大的趨勢,且在共飽點E處發生轉折,此點的折射率為1.470097。隨后從E點到B點的過程中折射率逐漸增加,在B點處達到最大值1.473100;從E點到A點折射率又逐漸減小,最終至A點降至1.466014。②圖5(b)是密度ρ與氯化鈣(CaCl2)濃度組成圖。同折射率的變化規律相近,隨著氯化鈣濃度的增加溶液密度先增大,在共飽點E處發生轉折,該點的密度為1.51522 g·cm-3。隨后在B點達到最大值1.52760 g·cm-3;到A點降至1.50209 g·cm-3。③圖5(c)是pH 與氯化鈣(CaCl2)濃度組成圖,從圖中可以看出,pH 隨著氯化鈣濃度的變化呈先減小后增大的趨勢,同樣在共飽點E處發生轉折,該點的pH為2.80,共飽點E到A點逐漸增大至4.87,E點至B點過程中逐漸減小,到B點處達到最小值2.01。
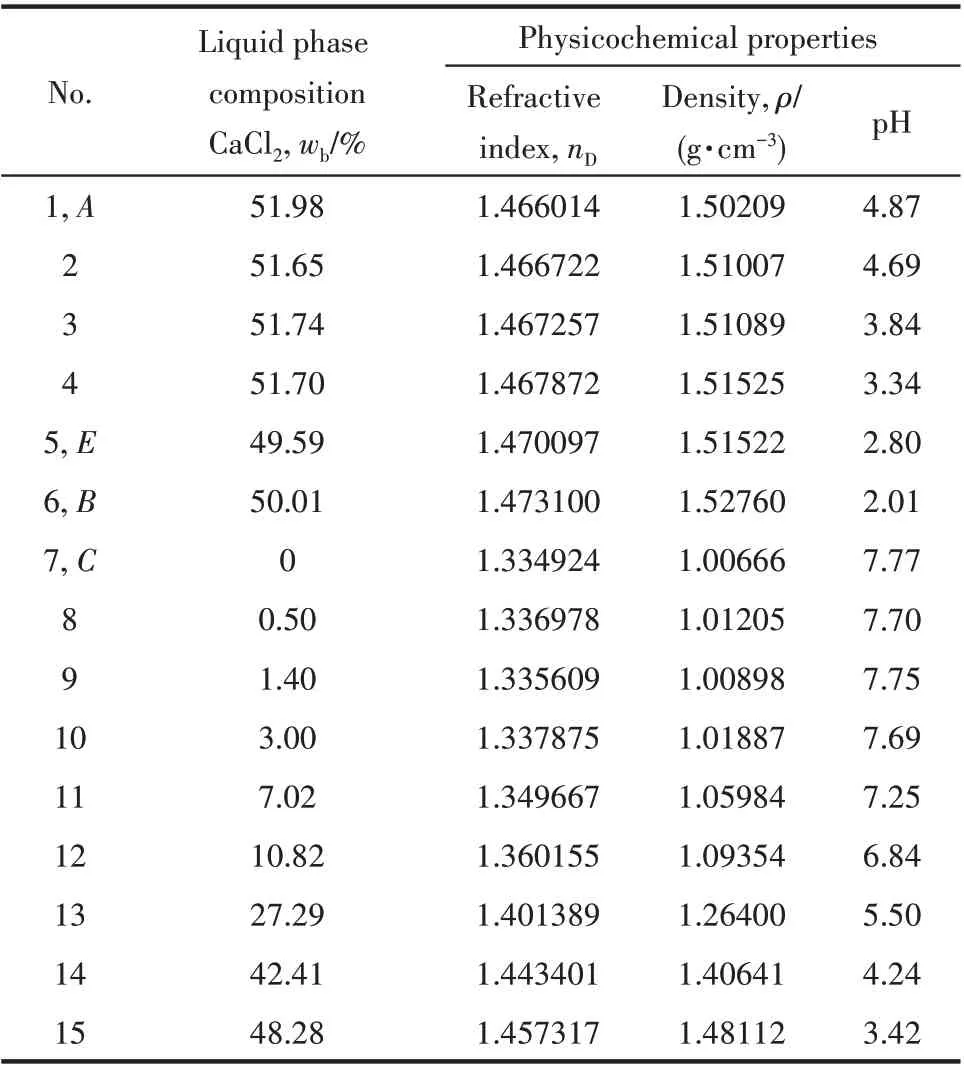
表3 四元體系CaCl2-CaSO4-CaB6O10-H2O在308.15 K的物化性質Table 3 Physicochemical properties of quaternary system(CaCl2-CaSO4-CaB6O10-H2O)at 308.15 K
3 結 論
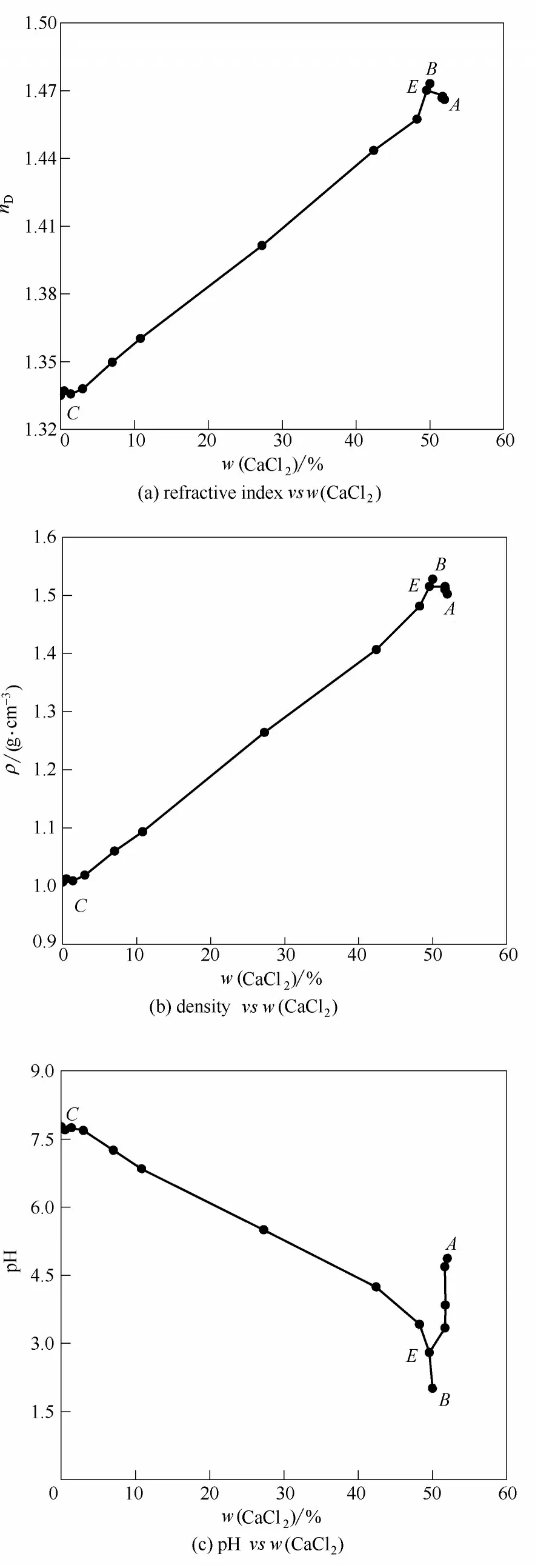
圖5 四元體系CaCl2-CaSO4-CaB6O10-H2O在308.15 K下物化性質與組成Fig.5 Physiochemical property versus composition diagram of titled quaternary system at 308.15 K
本文采用等溫溶解平衡法研究了四元體系CaCl2-CaSO4-CaB6O10-H2O 在308.15 K 下 的 穩 定 相平衡。測定該體系液相各組分的平衡溶解度及主要物化性質,包括折射率、密度和pH。且根據實驗數據繪制了相應的干基圖、水圖和物化性質組成圖。通過分析該四元體系的干基圖可知:該體系在308.15 K 時 有1 個 共 飽 點(CaCl2·4H2O + CaSO4·2H2O + CaB6O10·5H2O)、3 條單變量溶解度曲線和3個 單 鹽 結 晶 區,分 別 對 應 于CaCl2·4H2O、CaSO4·2H2O 和CaB6O10·5H2O。其中,由于CaCl2的溶解度較大,導致CaCl2·4H2O 的結晶區遠小于CaSO4·2H2O和CaB6O10·5H2O 的結晶區。此外,該體系在308.15 K下沒有復鹽和固溶體生成,屬于簡單化合物Ⅰ型。該四元體系的物化性質隨著氯化鈣濃度增加呈現規律性變化。折射率和密度隨著氯化鈣濃度的增加變化規律一致,pH隨著氯化鈣濃度的增加呈現不同的變化規律。對該體系的穩定相平衡研究,將填補鈣硼酸鹽溶解度數據空白,同時為綜合開發鹽湖鹵水資源提供重要的基礎數據。

