離子液體氣體干燥技術的研究進展
桂成敏,朱瑞松,張傑,雷志剛
(北京化工大學,化工資源有效利用國家重點實驗室,北京100029)
引 言
在應對氣候變化和推進綠色發展的全球大背景下,由于氣體能源具有低碳環保的優點,我國進一步加大天然氣、氫氣等清潔能源的開發力度,逐漸弱化對石油和煤炭的依賴[1]。近幾年全國天然氣消費量穩步增長,在2018 年消費增長率突破15%,為2013年以來的最高值[2]。在日益繁榮的氣體工業中,水分的存在會給氣體生產帶來巨大危害,它容易吸附塵埃從而堵塞氣體管道和閥門,當形成酸性水合物時則會對設備和管線造成腐蝕[3-4]。為此,開發綠色高效的氣體脫水技術對安全生產和資源有效利用具有重要意義。
目前大規模氣體干燥多采用溶劑吸收法,常用脫水劑有濃硫酸、二甘醇和三甘醇(triethylene glycol,TEG)等[5]。濃硫酸腐蝕性強并且廢硫酸回收難、污染大,而二甘醇由于其蒸氣壓較高存在溶劑損失大的問題[6]。TEG 在吸收塔易產生發泡現象,而且回收塔塔底再沸器溫度需要嚴格控制,否則超過204℃TEG 就會分解[7]。相比于傳統脫水劑,ILs具有可忽略的揮發性、熱力學與化學穩定性以及無毒性等優點[8]。除了無揮發性損失外,由于ILs 的回收流程簡單,使用ILs 可以降低工藝能耗。據流程模擬計算,在相同的流程條件下對CO2進行干燥,使用[BMIM][BF4]比使用TEG能降低設備8.13%的熱負荷和16.58%的冷負荷[9]。因此,研究ILs用于氣體脫水過程進而開發新型氣體干燥工藝是解決現有干燥問題的重要途徑。
在ILs 用于氣體干燥的研究中備受關注的領域有預測型熱力學模型的構建,脫水機理的揭示和脫水流程的開發。發展較早的UNIFAC 模型被擴展到ILs 體系能夠較好地預測體系相平衡,而COSMO 模型則被廣泛應用于ILs 的篩選[10-12]。近年來出現的人工智能網絡模型在氣體-ILs 體系的研究中取得了可觀的成果,但其預測準確性仍需要進一步提高[13]。在脫水機理方面的研究主要是對ILs-H2O 體系內的氫鍵、范德華力等弱相互作用進行分析。研究機理的手段從傳統的熱力學方法發展到了量子化學方法和分子動力學方法,為細致描述ILs 與水之間的相互作用提供了有利條件[14]。關于ILs 脫水流程國內外學者提出了多種工藝方案,它們的共同點是工藝流程處于實驗室規模的驗證階段,并且相比于使用傳統干燥劑的脫水流程,設備投資和能耗均能夠大幅降低[9,15-16]。
關于ILs 脫水工藝流程的研究最近幾年才被提出來,所以到目前為止還沒有系統論述ILs 脫水工藝的文章。本文重點從熱力學模型、溶解度測量方法、脫水機理和工藝流程四個方面對ILs 脫水工藝進行綜述,總結了ILs 脫水領域最新的研究成果,分析了此領域的研究熱點和尚未解決的問題,最后對未來研究方向作出展望。
1 預測型分子熱力學模型
1.1 UNIFAC模型
UNIFAC 模型被廣泛應用于預測流體的汽液相平衡,它將活度系數表達為組成和溫度的函數。該模型的核心在于基團貢獻法,即每種物質都可分為不同的基團,而不同的基團對活度系數的貢獻不一樣。
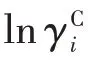
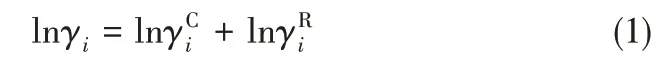
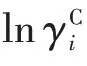
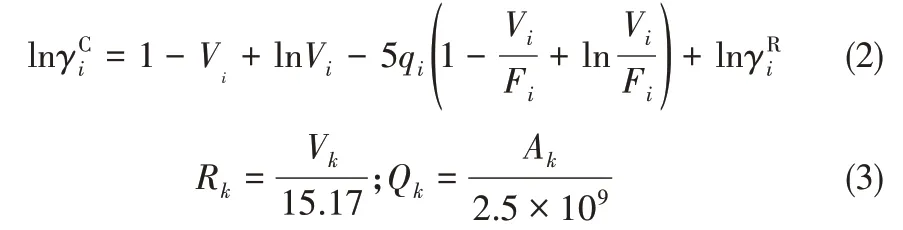
Fi和Vi分別是表面分數和體積分數,它們由范德華體積ri和表面積qi構成
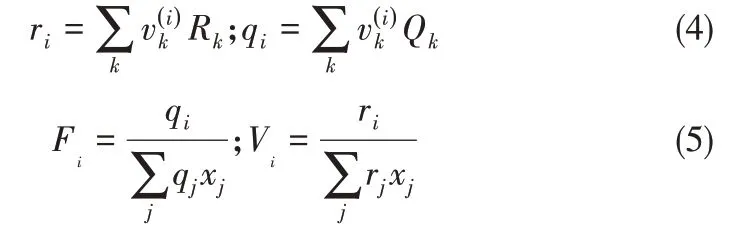
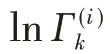
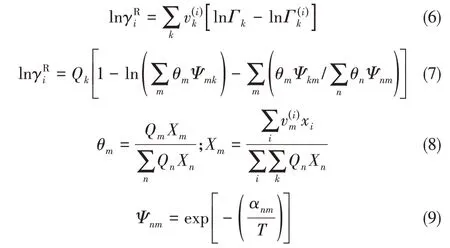
式中,Xm為基團m在混合物中的分率;T是熱力學溫度;αnm是與溫度有關的基團n和基團m之間的相互作用參數,并且αnm≠αmn。該模型不需要三元(或更高)參數來描述組分的汽液相平衡。
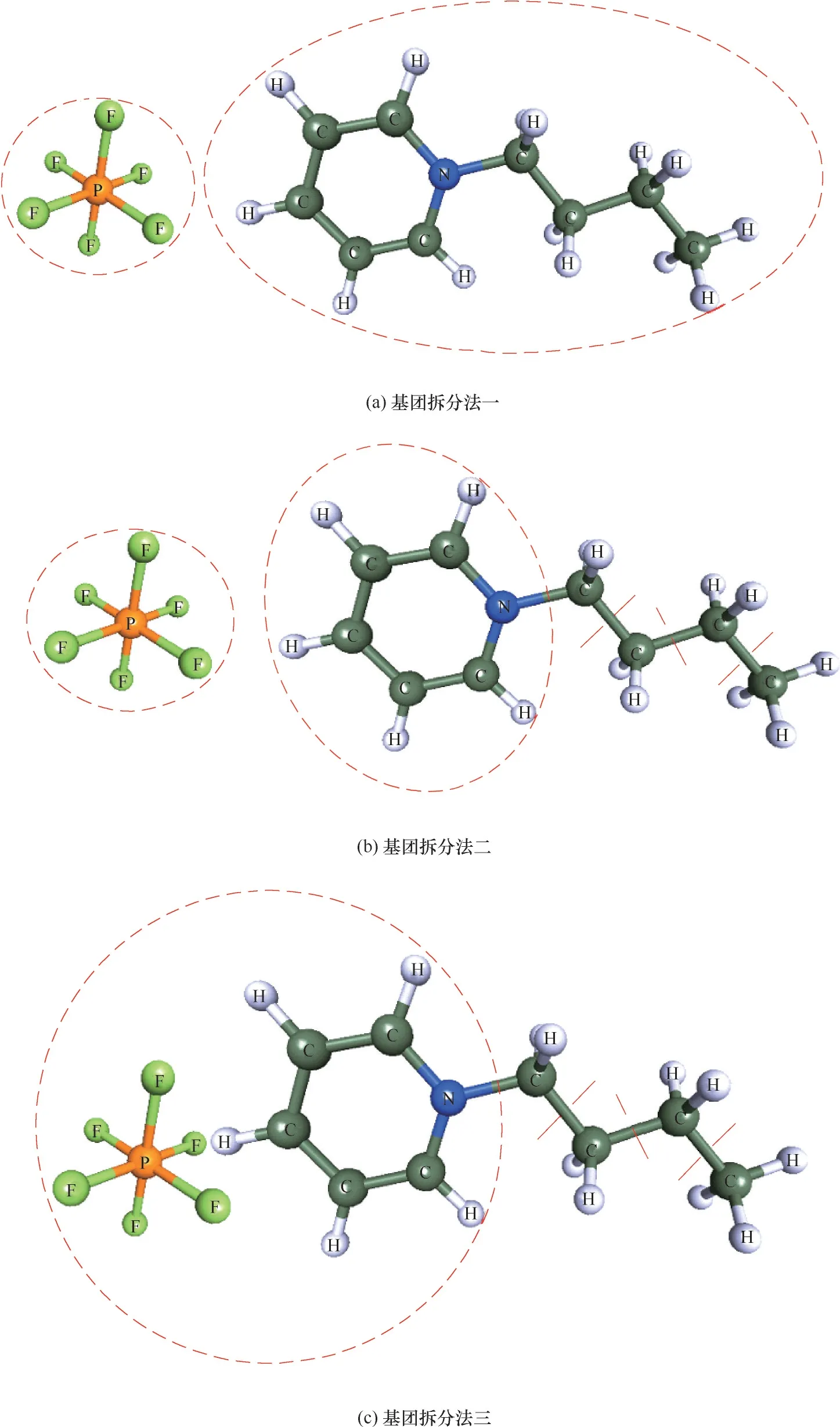
圖1 離子液體基團劃分方法Fig.1 Ionic liquid group division method
1.1.2 ILs 基團拆分方法 基于基團貢獻法的UNIFAC 模型基團拆分方法主要有三種,接下來以[BMIM][PF6]為例依次介紹這三種方法。如圖1(a)所示,方法一是將IL 拆分為陰離子[PF6]-和陽離子[BMIM]+兩個基團,這種方法得到的基團數目很少,但是當陰離子或者陽離子較為復雜時往往不能很好地體現ILs 的性質[18]。方法二如圖1(b)所示,先把陰陽離子拆開,再將它們拆分為更小的獨立的基團。在此方法中由于每個基團都帶電荷,必須加入Debye-Hu?ckel 長程靜電項[19-20]。方法三則是把ILs拆分為小的獨立的基團,再將陰陽離子主要骨架合并為一個電中性基團[21-24],如圖1(c)所示,IL 被拆分為3 個乙基基團、1 個甲基基團和一個電中性基團,這個電中性基團由咪唑環和[PF6]-構成。這種方法由Lei等[25]提出,很好地解決了基團帶電荷的問題。
1.1.3 模型參數獲取方法 當基團參數體積參數Rk和表面積參數Qk不能直接從文獻獲得時,可以通過以下兩種方式獲得。第一種是利用Doman?ska等[26]提出的摩爾體積計算關聯式計算,在已知離子液體摩爾體積和體積因子的條件下可以很方便求出基團的體積和表面積參數;第二種方法是通過COSMO-RS、Gaussian 09 等商用軟件計算。計算的關鍵步驟是基團結構的優化,得到最優結構的基團后,利用這些軟件可以算出ILs 各個基團的表面積和體積。
基團相互作用參數αnm和αmn一般通過擬合實驗的汽液相平衡數據獲得,當沒有相關的實驗值時,可以借助熱力學預測軟件算出體系的溶解度或者無限稀釋活度系數等熱力學數據。關于ILs 的基團參數如圖2 所示。理論上,獲得了UNIFAC 方法各個基團所有相應的模型參數,對于其他由這些基團構成的ILs 和溶質的熱力學參數都可以通過計算得到。由于一些模型參數來自于實驗測量,因而比純預測型的COSMO-RS 模型對物質的熱力學性質的預測準確性要高一些[27]。
1.2 COSMO-RS模型
COSMO-RS 模型是由Klamt 等[37]提出的一種基于量子化學計算的預測型熱力學方法。這種運算方法分別在1999 年和2009 年被嵌入到商業軟件COSMOtherm和ADF COSMO-RS 中。圖3 顯示的是ADF COSMO-RS 中COSMO-RS-Lei 2018 模 型 操 作界面。在沒有實驗數據的情況下,利用這些軟件程序可以對眾多純物質或者混合物的性質進行預測,它的計算原理如圖4所示。利用COSMO-RS可以對各種不同物質的脫水性能進行預測,評價其氣體脫水性能優良的參數有亨利系數和選擇性。圖5是利用COSMO-RS 方法計算出的三種不同類型的干燥劑對水的亨利系數和水相對于甲烷在干燥劑中的選擇性,從中可以觀察到[EMIM][Ac]的亨利系數最小而選擇性最大,說明它相對于固體無機鹽KSCN和傳統有機溶劑TEG 都具有更好的甲烷氣體干燥性能。
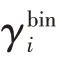
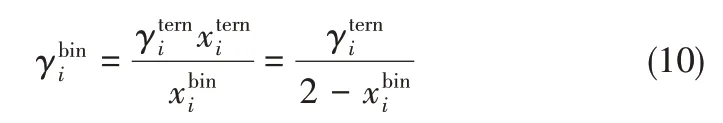

對于ILs 中氣體溶解度的預測雖然定性上符合實驗數據,但是定量上可能存在巨大的偏差。Manan 等[41]用COSMO-RS 模型對CO2、SO2等15 種氣體在27 種ILs 中的溶解度進行了預測,然后將預測值與IUPAC 數據庫實驗值相比較,發現模型只是定性上預測了ILs 中氣體溶解度,一些溶解度預測值偏差甚至超過了100%(摩爾分數)。當COSMO預測的偏差較大時可以通過調整內部參數來提高其準確性。前面提到的商用軟件ADF COSMO-RS 中有三個可調參數:失配能量系數、氫鍵系數和有效片段表面積常數。從文獻中獲得氣體在ILs 中無限稀釋活度系數值,用它們來校準這三個可調參數可以在一定程度上提高預測準確性。在298.2~333.2 K范 圍 內,Han 等[42]用COSMO-RS 方 法 對CO2在[BMIM][BF4]和[BMIM][PF6]中的溶解度進行預測,與實驗值相比平均相對偏差(ARD)分別是71.45%和39.24%,而用上述方法調整了參數后ARD分別降低為16.41%和5.39%。
綜上,COSMO-RS 模型可以對ILs-H2O 熱力學性質以及氣體在ILs 中溶解度進行定性預測,說明它具備篩選ILs 的能力,這可以為研究工作節省大量的時間和精力。
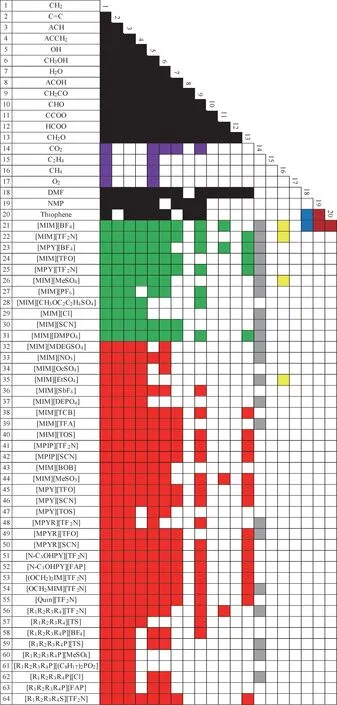
圖2 UNIFAC基團相互作用參數表(已知參數:黑色[28],綠色[17],紅色[25],黃色[29-32],紫色[33],灰色[34],藍色[35],棕色[36];未知參數:白色)Fig.2 UNIFAC group interaction parameter table(Parameters available:black[28],green[17],red[25],yellow[29-32],purple[33],gray[34],blue[35],brown[36];parameters unavailable:white)

圖3 ADF軟件中COSMO-RS-Lei 2018模型操作界面Fig.3 COSMO-RS-Lei 2018 model user interface in ADF software
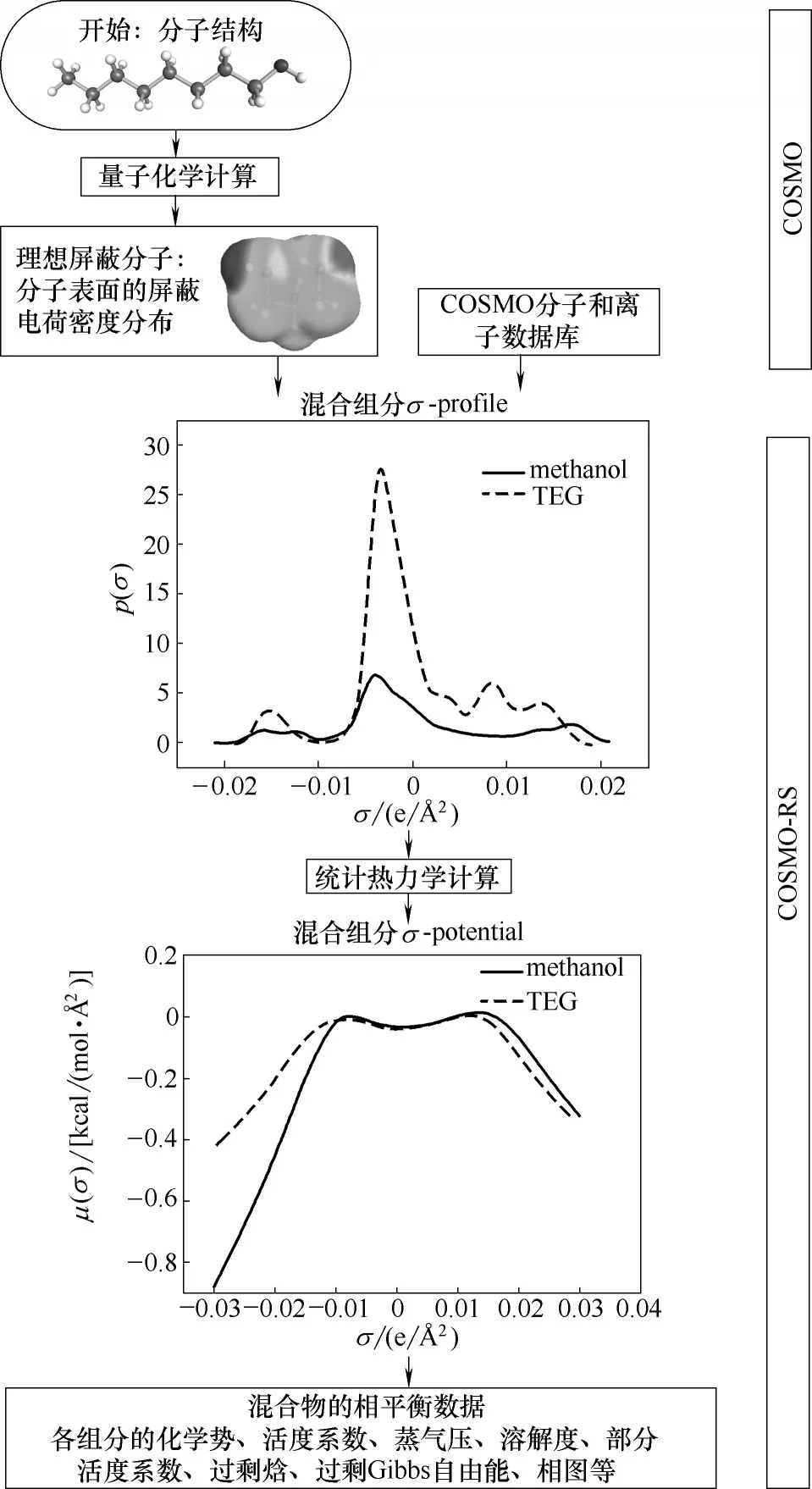
圖4 COSMO-RS模型計算原理[37]Fig.4 COSMO-RS model calculation principle[37]
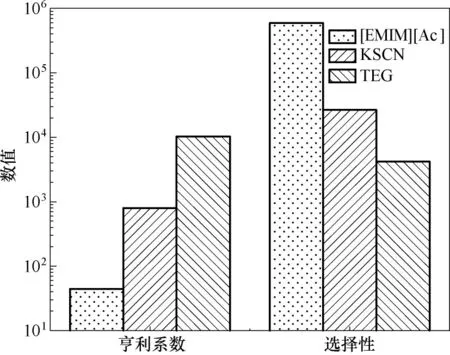
圖5 COSMO-RS方法計算出的亨利系數和選擇性Fig.5 Henry coefficient and selectivity calculated by COSMORS model
1.3 GC-EOS模型
GC-EOS 模型建立在普遍化的范德華方程和局部組合混合規則上,同時適用于極性體系和非極性體系。Bianca 等[43]首次將GC-EOS 模型擴展到預測氣體在ILs 中的溶解度,在其研究中,將CO2在二元均相離子液體混合物中的溶解度數據擬合得到的GC-EOS 參數可以較好地預測高壓下ILs 二元混合物的汽液相平衡。Pereda 等[44]將該方程進一步推廣應用于描述甲烷、乙烷和氫氣等氣體在咪唑類離子液體中的溶解度數據,通過擬合從而得到方程中ILs的臨界直徑、摩爾體積等參數。將新得到的參數應用于預測丙烷、丁烷和己烷等烷烴與不同碳支鏈長度咪唑類ILs 所組成系統的熱力學平衡性質,結果顯示GC-EOS 對汽液相平衡給出了較為準確的預測。Bermejo 等[29]將GC-EOS 方程應用于多種氣體在烷基硫酸根類ILs 中的相平衡的描述,結果發現該方程對CO2、CO、H2在IL 中的泡點的預測值與實驗值的相對偏差大部分都小于10%,而對甲烷和乙烷在IL 中的溶解度的預測效果很不理想。Kühne等[45]將GC-EOS 模型用于預測IL-CO2-有機溶劑三元相平衡,結果發現,GC-EOS 不僅可以定性預測汽液相平衡,還能預測液液相變。在Mota 等[46]的研究中,將PR-EOS 方 程(Peng-Robinson Equation of State)與GC-EOS 方程進行比較,對于CO2在低黏度的離子液體[HMIM][TCB]的汽液相平衡的描述,當參數足夠時,前者的準確性更強,GC-EOS 模型對參數的依賴性更弱一些,當參數很少時往往準確性好于前者。
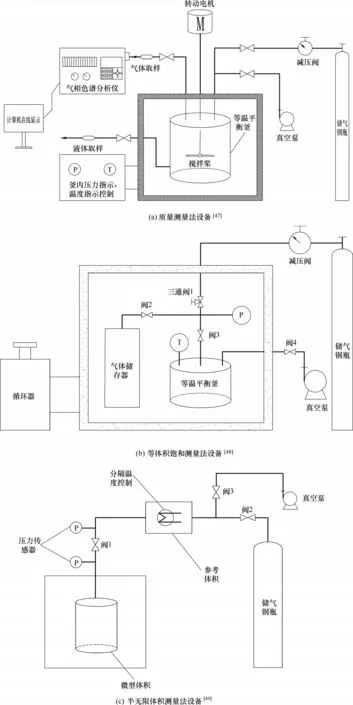
圖6 氣體溶解度測量裝置Fig.6 Gas solubility measuring device
2 氣體在ILs 中溶解度的實驗測量方法
2.1 質量測量法
質量測量法基于純液體溶劑和達到汽液相平衡時液相的質量差別來計算氣體溶質在ILs 中的溶解度。質量測量法的實驗裝置如圖6(a)所示。其主體是一個恒溫高壓平衡釜,反應釜的熱量由釜外硅油(高溫介質)或乙醇(低溫介質)提供,溫度和壓力通過溫度和壓力傳感器提供給自動指示儀表實時顯示。平衡釜有三個通道,氣體取樣口在裝置頂部,連接氣相色譜檢測氣體成分;氣體進口通道在釜上部,它與高壓鋼瓶連接,用于進氣;液體取樣口靠釜底部,可用于釜內液體取樣。當釜內加入待測離子液體并且通過檢測平衡釜密封性良好后,可以打開氣瓶通氣至指定壓力,關閉閥門后開啟釜內攪拌裝置,等待至裝置達到汽液相平衡。當ILs 吸收至飽和時,即可取出釜內富含氣體的液相通過質量差法進行測量,從而得出所取出的液相中氣體溶質的濃度。
這種溶解度測量方法溫度范圍一般為-60~100℃,壓力上限在200 bar(1 bar=105Pa)左右。它適合氣體在ILs 溶解度較高的情形,當氣體在ILs 中溶解度小于3%(摩爾分數)時,通過質量差法計算樣品中氣體溶解度將會變得困難,測量數據的準確性不好[50]。
2.2 等體積飽和測量法
典型的等體積飽和測量法的裝置如圖6(b)所示,裝置主體由等溫平衡釜和氣體儲存器組成,依靠氣體管線和閥門連接在一起。在實驗前需要測量出平衡釜體積、氣體儲存器和管線的總體積。平衡釜的體積可以通過向其中注入蒸餾水測量出,測量氣體儲存器和管線的總體積時可向其中注入氮氣,然后使用PVT 關聯式算出[51]。實驗開始時將已知質量和體積的ILs 注入平衡釜中,并且將平衡釜連上真空泵去除其中的氣體。隨之關閉閥3,打開閥1 和閥2 向氣體儲存器中通氣,記錄通氣平衡時儲存器的壓力。然后關閉閥1打開閥2,使得氣體儲存器中氣體與平衡釜內ILs 接觸,在期間可通過劇烈攪拌釜內液體以縮短平衡時間。隨著氣體逐漸溶解,氣體儲存器內壓力下降最后趨于固定值,根據儲存器中的初始氣體濃度與平衡時濃度之間的差值可以計算溶解氣體的量[48,52]。
與質量測量法相比,等體積飽和測量法裝置設計更加簡單,測量準確性也較高,但是吸收達到平衡所需時間比較長。值得注意的是,當氣體溶解后會改變ILs 的體積,體積如果變化不大時可以忽略,較大時則需通過其他方法矯正[53-54]。
2.3 半無限體積法
半無限體積法實驗裝置如圖6(c)所示,主要包括參考體積部分和微型體積部分。參考體積部分用來充入氣體溶質,而微型體積部分注入ILs。在裝置進料完成后的20 min 內進行擴散測量,通過使用水浴對ILs 進行嚴格溫度控制(0.02℃)以防止ILs 黏度的變化對計算結果造成干擾。擴散一段時間后,打開攪拌器,以便更快達到汽液平衡。在實驗過程中測量出微型體積內初始壓力和平衡壓力,由此壓力差計算氣體溶解度。
這種測量方法最初是由Camper 等[49]提出的,他們測量了乙烷、乙烯、丙烷、丙烯和二氧化碳在[EMIM][TF2N]中的溶解度。He 等[55]利用此方法測量了在30~70℃,0.1~1.4 bar范圍內制冷劑在三種咪唑類ILs中的溶解度,結果發現溶質在[HMIM][TF2N]中的溶解度比在[HMIM][TFO]和[HMIM][BF4]中的溶解度要大,這與文獻[56]報道值一致。
3 ILs脫水機理與工藝
3.1 ILs脫水動力學
評價吸收過程的三個動力學參數是吸收速率、飽和吸收量和吸收達到平衡所需要的時間。關于ILs 吸收水的動力學模型的研究目前只停留在靜態吸濕實驗。在Francesco 等[57]的研究中提出了水溶解于ILs 是三個步驟同時進行的結果:(1)水分子吸附到ILs 表面;(2)由于擴散水分子從表面遷移到溶液內部;(3)形成水-離子絡合物。由此,提出了吸收動力學方程如下

式中,x是溶液中水的摩爾分數;x∞是摩爾比的穩態值,代表達到平衡時每個IL 分子吸收多少個水分子;e 為自然常數,其值約為2.71828;β是吸收速率常數,表示達到平衡的速度。
從以上三個步驟出發可以看出ILs 本身性質對吸收的影響。第一步吸附過程與吸收速率有關,ILs暴露于表面的基團對水的親和性越強,吸收速率越快。含咪唑鹽傾向于使烷基遠離表面取向,從而使其他親水基團能與氣相中水分子有更多的接觸,這在一定程度上加快了吸收水分。在擴散階段,擴散速率受ILs 的黏度影響,而黏度與水含量存在密切關系。最后一步決定了ILs 的飽和吸水容量,短鏈的ILs 較容易形成三維網狀結構,從而飽和吸水量要大于長鏈的ILs。吸收達到平衡所需要的時間受吸收速率和飽和吸收量共同影響。
除ILs 本身外,氣體濕度和吸收溫度對吸收過程也有很大的影響[58]。氣體濕度越大,吸收容量和吸收速率都會增大,但是吸收容量增大的比值要大于吸收速率,所以最終導致吸收達到平衡的時間變長。在一定的溫度范圍內,溫度的升高會提高ILs對水分的吸收速率和飽和吸收量,并且吸收過程更容易達到平衡。對于ILs,溫度的升高會導致氣體動能的增加,同時也降低了ILs 的黏度。黏度的降低對吸收的促進作用大于分子動能增加對吸收的抑制作用,從而使得吸收速率加快。黏度的降低也會導致飽和吸收量的增加和達到平衡所需時間的縮短,達到吸收平衡所需時間由吸收速率和飽和吸收量共同決定,這說明溫度升高對吸收速率的影響要大于對吸收容量的影響。
3.2 ILs脫水機理
根據與水分子親和力強弱可把ILs 分為親水性ILs 和疏水性ILs。ILs 的親水性受陰陽離子共同影響,一般而言,陽離子上烷基鏈長度越長,其吸水能力越弱,可以通過增加陽離子上親水性官能團增強它的親水性。在[BMIM]+作為陽離子的ILs 中,陰離子吸水速率存在如下規律:[Ac]->[Cl]->[Br]->[TFA]->[NO3]->[TFO]->[BF4]->[TF2N]->[CHO]->[PF6]-,一般鹵化物、硝酸鹽、甲酸鹽類陰離子能增強其親水性,而[PF6]-、[TF2N]-等疏水性陰離子則會降低其親水性[59]。ILs 與水的親和性大多來源于ILs 的陰、陽離子與水分子之間產生了氫鍵。為了研究氫鍵在[EMIM][TF2N]-H2O 體系多種弱相互作用間的關系,Yu 等[60]對其混合焓進行分析,發現對混合焓貢獻最大的是氫鍵相互作用,而靜電相互作用和范德華相互作用幾乎可以忽略。
Han 等[38]為了考察[EMIM][TF2N]+H2O+CO2體系的氫鍵作用,通過COSMO-RS 方法計算出體系的分子表面屏蔽電荷密度分布(σ-profile),發現H2O 的σ-profile 的分布范圍很廣,在0.018 e/?2(1 ?=0.1 nm)處出現一個強峰,說明水分子可作為氫鍵受體。在對稱位置σ=-0.018 e/?2處同樣出現一個強峰,說明水分子可作為氫鍵供體。[TF2N]-在0.011 e/?2出現一個強峰,這是由含氧基團引起的,說明陰離子具有強的氫鍵受體能力,它能與水分子形成強的氫鍵。待干燥的CO2主要集中在非極性區域。[EMIM]+在-20.0082 e/?2區域有一個弱峰,說明其具有弱的氫鍵供體能力,這在Wang 等[61]的研究中得到了進一步證明,他們通過Gaussian 03 程序對水分子與[BMIM]+間的相互作用能量進行分析,結果表明水分子中氧原子與咪唑環上碳原子間可形成較強的氫鍵,綜上,[EMIM][TF2N]的親水性來源于[TF2N]-與水分子形成的強氫鍵,而[EMIM][TF2N]與CO2之間氫鍵相互作用很弱使得吸收過程中能大大降低CO2在吸收劑中的損失。
3.3 水對ILs的影響
水與ILs 的相互作用比較復雜,它不僅與陰陽離子種類以及配對方式有關,還與水含量有關[62]。對于可以與水互溶的ILs,在含水量較少時,水分子在IL 的陰陽離子周圍形成一個獨特的溶劑化外殼并削弱它們的相互作用。隨著水的比例增加,水分子之間相互連接形成巨大的滲透網絡,使得離子液體陰陽離子對解離程度加深。可見,H2O 的加入會改變ILs 的原有結構和相互作用,這些分子內部的變化會改變ILs 的熱力學性質。吸收過程中傳質效率、設備投資和能耗與吸收劑的黏度和氣體吸收率息息相關。
H2O 的加入可以降低ILs的黏度,并且隨著體系H2O 摩爾分數的增加黏度下降得更明顯。2000 年,Seddon 等[63]報道了對于20℃的H2O-[BMIM][BF4]體系,體系黏度隨著水的摩爾分數增加而呈拋物線形下降。當水的摩爾分數從0升至0.1時,體系的黏度從150 mPa·s 降低至110 mPa·s,摩爾分數增加至0.6時,體系黏度只有10 mPa·s。文中對原因進行了討論,提出IL 黏度的降低是由于水的加入減小了離子間靜電相互作用。Domańska 等[64]測量了298.15~348.15 K 范圍內[BMIM][SCN]的黏度隨H2O 濃度的變化,結果發現,在較低溫度下,體系的黏度對水含量變化更敏感,而高溫下由于純[BMIM][SCN]與H2O的黏度差異不大,隨著體系中水摩爾分數增加黏度下降不顯著。Tanner 等[65]在對膽堿和香草葉酸基的ILs 的研究中發現,在純IL 中加入水時物系黏度幾乎直線下降,但是在IL摩爾分數為0.3~0.5時體系黏度基本沒有變化,這與其他ILs 黏度的連續變化趨勢不同,可能是由于水的加入體系內其他相互作用(靜電相互作用和離子配對作用除外)對黏度有影響。
H2O 一般通過分解效應、稀釋效應和加強效應對ILs 中待干燥氣體溶解度造成影響。分解效應是指H2O 使得ILs 發生化學分解,如氯鋁酸鹽類ILs 遇到水分易發生分解,[PF6]-類ILs 接觸水分甚至會釋放有毒的氟化氫氣體。稀釋效應是指H2O與待干燥氣體競爭ILs 的結合位點,從而降低氣體溶解度。在[EMIM][TF2N]中添加質量分數2%的水后CO 和H2的溶解度相比于純IL 分別下降了40%和25%左右[50]。在[EMIM][CF3SO3]中添加質量分數10%的水較于純IL,CO2溶解度下降了10%左右,類似地在[BMIM][Ac]中添加水也能大幅度降低CO2的溶解度[66-67]。加強效應則是H2O 增強了某些氣體的化學吸收。當水存在時,可能會促進CO2與氨基絡合生成氨基甲酸酯,從而使CO2溶解度增加[68]。在一些情況下H2O對氣體在ILs中的溶解度基本沒有影響,這可能是稀釋效應和加強效應相互抵消的結果。
3.4 ILs脫水工藝
ILs 脫水工藝流程如圖7 所示。ILs 和待干燥氣體在吸收塔中逆流接觸,塔底富水的ILs 通過換熱器加熱后通往閃蒸罐進行再生,罐頂含有水分的混合氣體經冷卻后送往回收中心,罐底的ILs 預熱塔釜液后經過冷卻器冷卻至指定溫度送往塔頂繼續進行吸收。全流程較短,主要設備是吸收塔,可對其工藝參數進行優化調節。一般而言,吸收塔理論板數越多,吸收劑進料量越大,操作壓力越高,塔頂出口氣體水含量越少[69],同時要考慮操作費用、能耗和塔壁強度隨著這些操作參數的變化,不斷進行優化才能找到滿足產品要求的最佳操作條件。
ILs脫水工藝延續了傳統氣體吸收工藝特色,但是相對傳統的有機溶劑干燥過程有獨特的優點。首先,設備投資和能耗可以降低很多。其吸收劑再生過程只在閃蒸罐進行閃蒸,而傳統的有機溶劑如TEG 等則需要在精餾塔中進行蒸餾才能循環回吸收塔再次進行吸收[70],精餾塔的造價遠高于閃蒸罐,由于再沸器和冷凝器使得三甘醇干燥工藝能耗超過了ILs 干燥工藝。其次,ILs 脫水工藝的氣體干燥效果較好。很多ILs 親水性非常強,水在一些ILs 中的亨利系數甚至小于0.001,在理論板數較少的情況下,天然氣經ILs干燥后含水量往往能達到600×10-6(摩爾分數,下同)左右,而TEG 在相同流程條件下只能達到1600×10-6[71]。此外,ILs 損失量少。ILs 在常溫下基本不揮發,在吸收塔中相對傳統有機溶劑損失量少得多[72]。表1 是在化工軟件Aspen 中對CH4和CO2干燥過程的流程模擬結果,由表可知在相同的氣體進料條件下,使用[EMIM][TF2N]作為吸收劑相對TEG 流程產品氣體含水量更低,設備的熱負荷和冷負荷也大幅度下降。
ILs干燥氣體工藝除了可以在吸收塔中進行,還可與其他技術結合。很多ILs 黏度比較大,在普通板式塔或填料塔中傳質效率不高且壓降比較大。Wu 等[73]討論了在旋轉填料床(RPB)中利用離子液體[BMIM][Ac]干燥空氣的可能性。加入RPB 的ILs在離心力作用下被填充網撕裂為細小的液滴和薄膜,促進了傳質。研究結果顯示經ILs 干燥后空氣露點相比于用TEG 干燥有了大幅度提高,說明ILs干燥效果優于TEG。
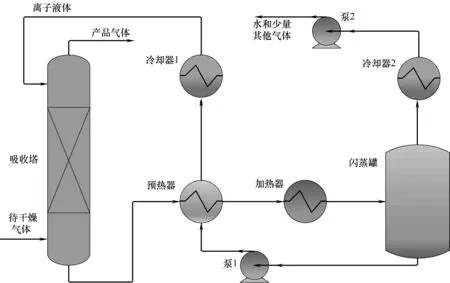
圖7 ILs用于氣體脫水工藝流程Fig.7 Flow diagram of ILs for gas dehydration process
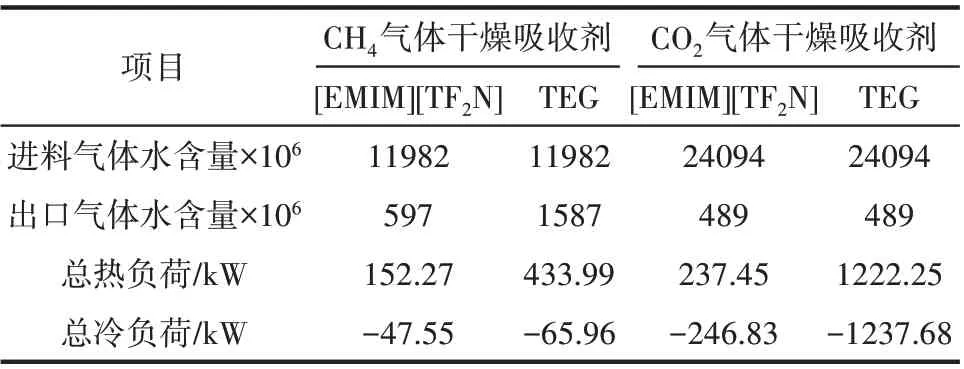
表1 CH4和CO2干燥過程的流程模擬結果[38,71]Table 1 Process simulation results for CH4 and CO2 drying processes[38,71]
4 總結與展望
目前,ILs用于氣體脫水領域遇到的問題主要集中在:現有的關于ILs 的熱力學模型適用范圍較窄,有些模型對關鍵組分與ILs 之間的熱力學性質預測不準;不同的溶解度實驗方法對同一體系的研究結果存在一些差異,還未系統研究評定各方法的準確性;現在報道的脫水工藝使用的ILs 種類較少,陽離子僅限于咪唑類離子,陰離子為[TF2N]-、[BF4]-等常見陰離子;現在很多研究對氣體的最終干燥效果考慮得比較多,忽略了如比熱容、黏度、表面張力、熱傳導性等性質,而這些熱力學性質不僅影響吸收的傳遞效果,還對流程的設備投資和能耗有重要影響。以后的研究可以從這幾個方面進行展開:(1)將多種預測型分子熱力學模型進行結合以提高其應用范圍和預測準確性(例如將COSMO-UNIFAC模型嵌入著名的Aspen Plus和ADF模擬軟件之中);(2)建立吸收塔內ILs 吸收水分的傳質動力學模型;(3)針對溶質和水的性質給ILs 增加功能化基團以增強脫水性,或者將ILs 與金屬有機骨架材料(MOF)、有機金屬骨架材料(COF)等新型材料結合使其獲得更好的分離性能;(4)借助量子力學和分子動力學方法探究ILs 與水分子之間獨特的相互作用;(5)設計脫水工藝時將ILs 的黏度、比熱容、表面張力等熱力學性質納入能耗和費用計算之中。
符 號 說 明
e——自然常數,其值約為2.71828
Fi——UNIFAC基團i的表面分數
Q——基團表面積參數
q——范德華表面積參數
R——基團體積參數
r——范德華體積參數
T——熱力學溫度,K
Vi——UNIFAC基團i的體積分數
vk——基團k在分子中的數目
Xm——基團m在混合物中的分率
xi——組分i摩爾分數
x∞——摩爾分數穩定值
β——吸收速率常數
Гk——組分k的剩余活度系數
γi——組分i的活度系數
θ——基團表面積分數
Ψnm——基團n和基團m的相互關聯參數上角標
bin——二元體系
tern——三元體系
離子液體陰陽離子名稱
[Ac]-——acetate
[BF4]-——tetrafluoroborate
[BMIM]+——1-butyl-3-methyl-imidazolium
[CF3SO3]-——mesylate
[CHO]-——cholate
[EMIM]+——1-ethyl-3-methyl-imidazolium
[HMIM]+——1-(2-hydroxyethyl)-3-methyl-imidazolium
[OMIM]+——1-octyl-3-methyl-imidazolium
[P4444]+——tetrabutylphosphonium
[PF6]-——hexafluorophosphate
[SCN]-——thiocyanate
[TCB]-——tetracyanoborate
[TFA]-——trifluoroacetate
[TF2N]-——bis(trifluoromethylsulfonyl)-amide
[TFO]-——trifuoromethanesulfonate
[TMPP]-——bis(2,4,4-trimethylpentyl)phosphinate

