低溫脅迫下香梨優斑螟內參篩選及HSP70、HSP90基因表達分析
王德鋼,賀鵬鵬,馬光皇,肖海兵,3,熊仁次,2,3*,韓 旭,3, 楊明祿,2,3*
(1.塔里木大學植物科學學院,新疆 阿拉爾 843300;2.南疆特色果樹高效優質栽培與深加工技術國家地方聯合工程實驗室,新疆 阿拉爾 843300;3.農業農村部阿拉爾作物有害生物科學觀測實驗站,新疆 阿拉爾 843300)
【研究意義】香梨優斑螟(Euzopherapyriella)屬鱗翅目螟蛾科,在新疆廣泛分布,可為害香梨、蘋果、棗、楊樹等果樹與林木,蛀食香梨與蘋果的果肉、果心、果皮和種子,在香梨、棗和楊樹上會蛀食韌皮部,導致腐爛病發生,使樹勢衰弱,嚴重時會造成枝干死亡,對新疆梨、棗、蘋果等產業健康發展影響較大。香梨優斑螟在南疆每年發生3~4代,后期有世代重疊現象,該蟲以老熟幼蟲越冬,10月份幼蟲逐漸進入越冬狀態,越冬代幼蟲翌年3月下旬開始化蛹,4月上中旬進行化蛹盛期,羽化盛期在4月下旬,第1、2代成蟲羽化高峰分別在6月上中旬和7月中下旬[1-3]。關于香梨優斑螟分子生物學方面的研究較少,僅限于利用COI基因和ND5基因分析香梨優斑螟遺傳結構、分子鑒定[4-6]及不同蟲態內參基因篩選[7]等研究。香梨優斑螟作為幼蟲越冬的害蟲,研究幼蟲熱激蛋白(Heat shock protein,HSP)基因表達對低溫響應特征有助于了解其低溫滯育機理。【前人研究進展】熱激蛋白是一種保守的抗逆蛋白[8],在昆蟲體內普遍存在,作為分子伴侶參與一些重要的細胞生理活動,協助細胞內其他蛋白折疊,避免蛋白聚集或錯誤折疊而降解,已發現的HSPs、HSP40、HSP60、HSP70、HSP90等多種類型[9]。HSPs對外界環境變化響應迅速,逆境脅迫下高表達的HSPs可能對細胞起到保護作用[10],促進維持細胞正常生理功能,提高機體響應的適應能力,從而增強抗逆性。1962年在黑腹果蠅(Drosophilamelanogaster)中首次發現一個基因與高溫誘導其唾腺的多線染色體產生膨突有關[11],后證實果蠅染色體出現的膨突由高溫激發基因轉錄合成一種特殊的蛋白引起[12],直到1982年在美國召開HSPs國際會議后HSPs才開始廣泛研究。HSPs對環境變化反應迅速,高溫和低溫的脅迫下都會誘導昆蟲表達不同的HSPs,助其度過不良的環境[13],低溫和高溫處理沙蔥螢葉甲(Galerucadaurica)1 h及恢復室溫30 min后均能誘導HSP20.6基因表達上調[14],-5 和0 ℃低溫處理的藥材甲(Stegobiumpaniceum)成蟲體內HSP60的表達量均顯著高于對照組[15],HSP70在高低溫脅迫下西花薊馬(Frankliniellaoccidentalis)能夠被誘導并且顯著表達[16],沙棘木蠹蛾(Eogystiahippophaecolus)在低溫脅迫后HSP70基因表達上調,冷休克恢復處理后的1 h內,HSP70的表達顯著增加,然后減少,冷休克促進了HSP70的表達[17],沙棘木蠹蛾在不同的低溫處理下,Hsp90基因的表達也會上調,呈先升后下降的趨勢[18]。【本研究切入點】HSPs家族基因對溫度變化誘導高水平表達很多在昆蟲中都被證實,從對6和12月香梨優斑螟幼蟲轉錄組數據庫的研究發現HSP70和HSP90基因的表達差異較大。【擬解決的關鍵問題】本文篩選香梨優斑螟幼蟲低溫脅迫下的內參基因,進而選擇對溫度較敏感的HSP70和HSP90基因為目標,研究HSP70和HSP90基因對低溫脅迫的響應規律。
1 材料與方法
1.1 蟲源
香梨優斑螟5齡幼蟲,6月中旬采集自阿拉爾市塔里木大學校內梨園。
1.2 主要試劑與儀器
TRIzon Reagent(康為世紀生物科技有限公司);SGExcel UltraSYBR Master(上海生工生物有限公司);PrimeScript RT Reagent Kit with gDNA Eraser(寶日醫生物技術有限公司)。超微量分光光度計(NanoDrop 2000,賽默飛世爾科技公司);熒光定量PCR儀(Eprealplex4 S,Eppendorf)。
1.3 試驗方法
1.3.1 處理方法 香梨優斑螟幼蟲分別于4 ℃低溫脅迫下處理0(CK)、0.25、1、3、8、12、18、24 h,每處理3頭幼蟲,重復3次,實時熒光PCR 4 個技術重復。處理后幼蟲立即放入液氮中冷凍,后置于-80 ℃冰箱備用。
1.3.2 總RNA提取與cDNA合成 將樣品勻漿后,按照TRIzon Reagent說明書提取總RNA,超微量分光光度計檢測RNA樣品質量和濃度。按照PrimeScript RT Reagent Kit with gDNA Erase說明去除總RNA中基因組DNA,并以1.0 μg總RNA為模板合成cDNA,稀釋10倍于-20 ℃保存備用。
1.3.3 內參及HSP基因引物設計 從實驗室香梨優斑螟轉錄組數據庫獲得目標基因序列,分別是β-肌動蛋白基因(β-Actin,Actin)、β-微管蛋白基因(TUBulinbeta,TUB)、甘油醛-3-磷酸脫氫酶基因(glyceraldehyde-3-phos-phat dehydrogenase,GAPDH)、18s核糖體RNA(18s ribosomal RNA, 18s)、多聚泛素基因(ubiquitin,UBQ),熱激蛋白基因HSP70和HSP90,利用Primer Premier 5.0軟件設計熒光定量PCR引物(表1)。
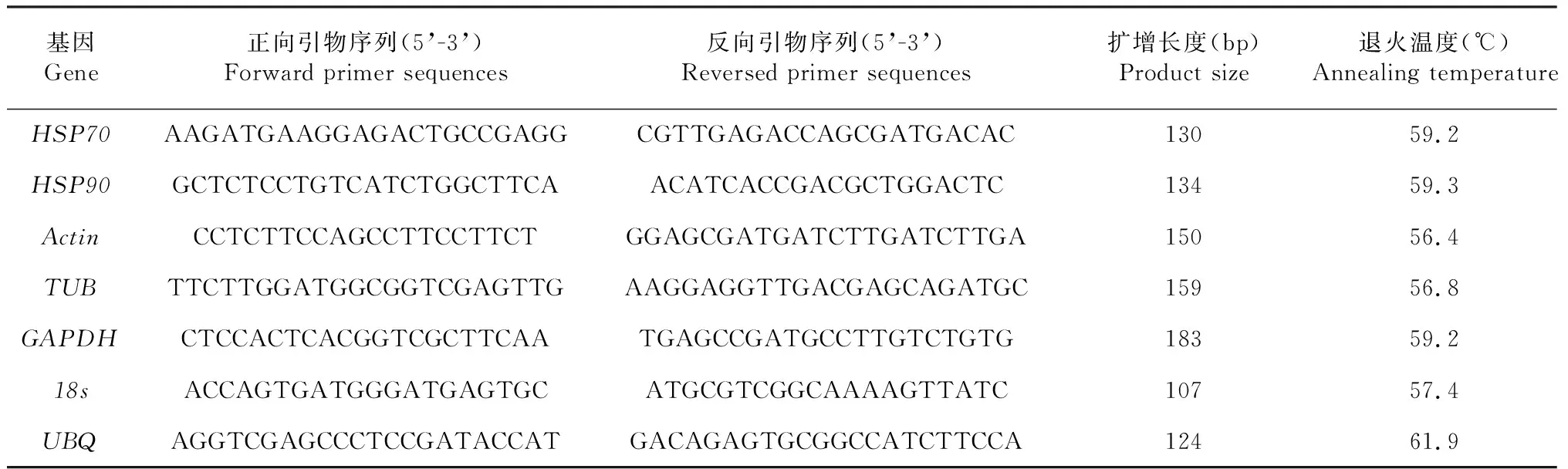
表1 RT-qPCR引物序列
1.3.4 實時熒光PCR及擴增效率 擴增體系(20 μl):熒光mix 12.5 μl,上下游引物各0.4 μl (終濃度0.2 μM),cDNA模板1 μl,加ddH2O至20 μl。
擴增條件:95℃ 3 min(預變性),95 ℃變性15 s,56 ℃退火20 s,72 ℃延伸25 s, 40個循環;熔解曲線:95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。
通過設置10倍梯度稀釋,即cDNA 依次稀釋10、102、103、104、105倍作為模板進行擴增,繪制標準曲線,計算引物的擴增效率[19]。
1.4 數據分析
采用ΔCt法[20]、GeNorm[21]、NormFinder[22]、BestKeeper[23]和RefFinder[24]軟件分析內參基因穩定性。利用所篩選的穩定內參計算熱激蛋白基因相對表達量,公式為相對表達量=2-(ΔΔCt)[25],利用DPS的Duncan法進行顯著性分析。
2 結果與分析
2.1 總RNA提取及引物擴增效率分析
香梨優斑螟幼蟲總RNA的OD260/280比值在1.9~2.1,利用試劑盒轉錄為cDNA備用。所設計引物的擴增產物溶解曲線為單一峰,均具有較好的特異性,擴增線性相關系數R2為0.9817~0.9958,擴增效率也在93.08 %~100.97 %(表2),設計引物符合相對定量檢測需要。
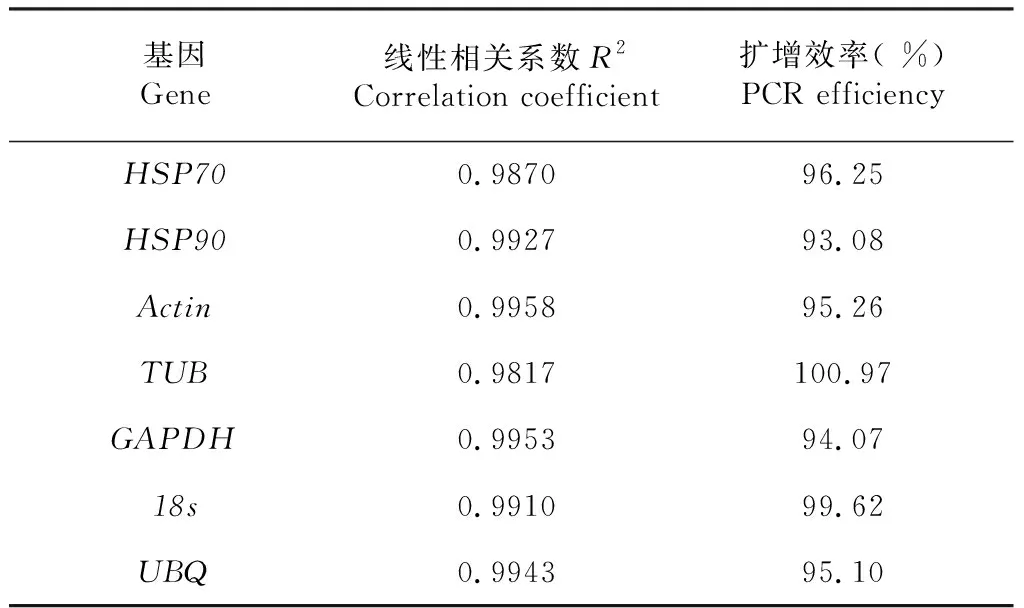
表2 引物擴增效率
2.2 候選內參基因Ct值變化
候選的香梨優斑螟5個內參基因低溫脅迫下Ct值較為穩定,變化趨勢較為一致。18s內參基因表達豐度最高,Ct值5.38~9.58,GAPDH,TUB和UBQ基因表達豐度相對較低,Ct值15.16~24.58, 在低溫處理24 h時內參基因表達都有一定的下降趨勢(圖1)。
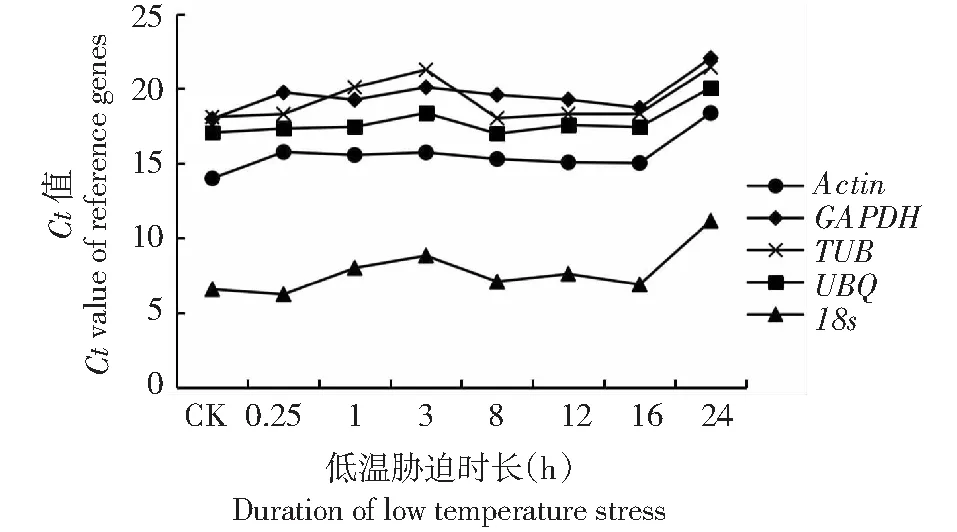
圖1 內參基因Ct值變化趨勢Fig.1 Variation trend of Ct value of reference genes
2.3 低溫脅迫候選內參基因穩定性
△Ct法計算結果UBQ分值最小,其次為GAPDH,TUB基因的分值最高、穩定性最差(圖2-A)。NormFinder軟件分析的穩定性為UBQ>GAPDH>Actin>18s>TUB(圖2-B)。GeNorm以參數M=1.5為閾值來判斷基因的穩定性,小于1.5時表明該基因穩定性良好,并且根據M值的大小來判斷基因穩定性高低,M值越大則基因穩定性越差,M值越小則基因的穩定性越好[22],所選內參基因M值大小為0.563~1.446,說明候選內參基因穩定性都較好,依次為Actin=GAPDH>UBQ>18s>TUB(圖2-C)。BestKeeper分析的為18s>UBQ>Actin>GAPDH>TUB,最穩定的基因為18s,這與其他軟件的結果有所不同(表3)。經RefFinder軟件綜合分析發現其穩定性依次為UBQ>GAPDH>Actin>18s>TUB(圖2-D),UBQ和GAPDH基因綜合穩定性最好,Actin穩定性相對UBQ和GAPDH稍差,仍是較為穩定的內參基因,TUB穩定性最差,對18s基因的穩定性評價上存在一定分歧。

表3 BestKeeper 軟件分析內參基因穩定性
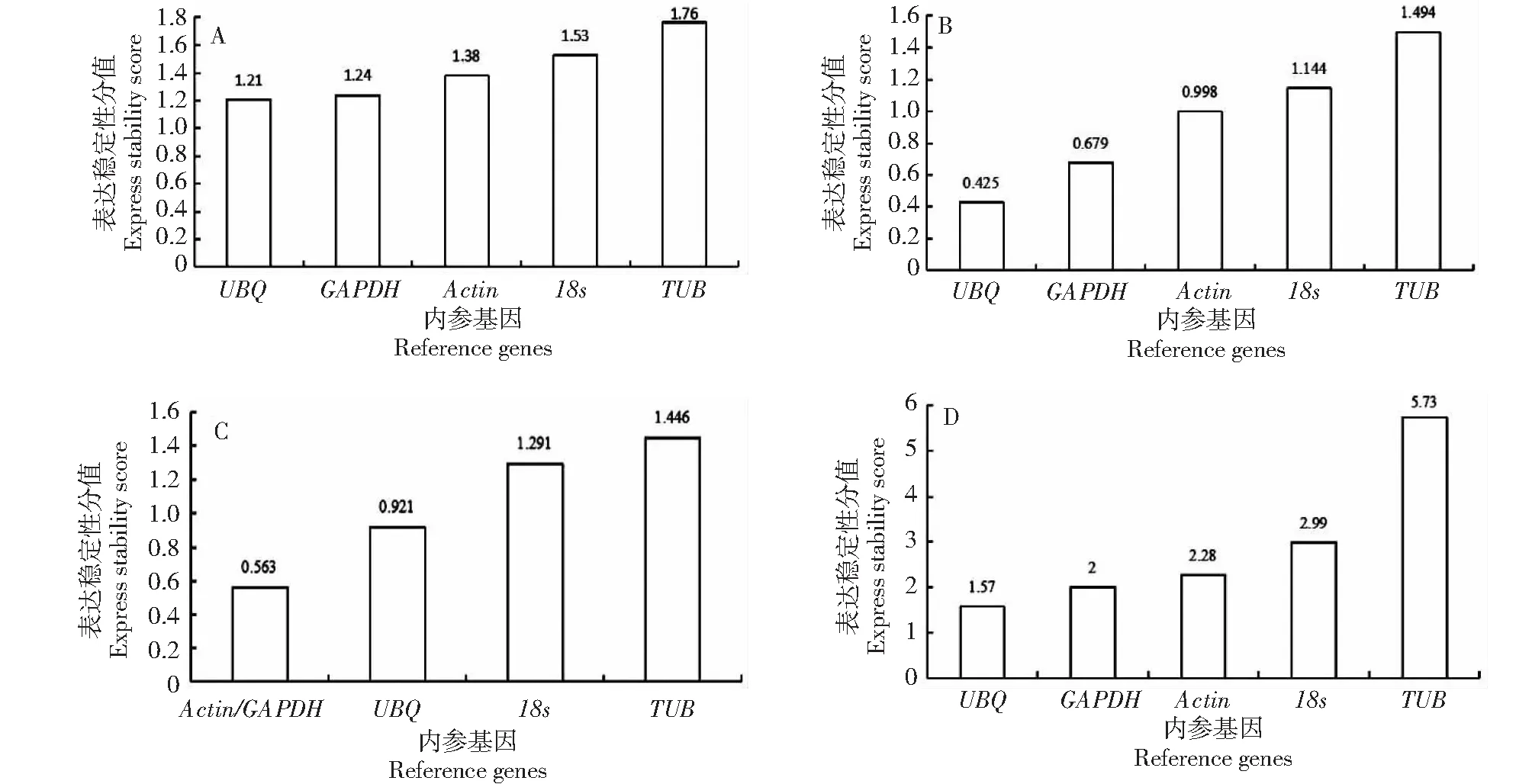
a.△Ct法評價結果,B.Normfinder軟件評價結果,C.Genorm軟件評價結果,D.RefFinder軟件評價結果A:Evaluation results of △Ct,B:Evaluation results of Normfinder,C:Evaluation results of Genorm,D:Evaluation results of RefFinder
2.4 低溫處理下HSP70和HSP90基因表達特征
HSP70基因經過低溫脅迫處理后,其相對表達
量分別是對照組的5.08、8.79、2.52、4.09、1.50、6.50、3.76倍,并于1 h處理時達到峰值,HSP70基因相對表達量明顯高于對照,初期及24 h末期顯著高于對照(圖3)。HSP90基因分別是對照組的4.01、12.80、7.00、2.60、1.70、4.48、4.48倍,于1 h處理時達到峰值,表達特征也與HSP70基因相似,在18 h后相對表達量趨于穩定(圖4)。

圖3 HSP70基因的相對表達量Fig.3 Relative expression of HSP70 gene

圖4 HSP90基因的相對表達量Fig.4 Relative expression of HSP90 gene
3 討 論
實時熒光定量PCR是生物基因表達研究最廣泛的手段之一,而基因相對表達研究中內參基因的選擇對結果影響很大[26]。曾在很長時間內認為維持細胞正常生命代謝所必需的管家基因非常穩定[27],但隨著研究深入發現管家基因表達并非完全恒定的[28],在不同處理條件下各管家基因的表達穩定性存在一定差異,因此選擇適合的內參基因顯得十分重要[29]。研究香梨優斑螟在受低溫脅迫下熱激蛋白家族中HSP70和HSP90基因表達特征,首先需要篩選穩定的管家基因作為內參,借助軟件評價內參基因的穩定性,但不同軟件的評價結果存在一定差異,這種差異的出現是不同軟件的算法引起的[30],在內參基因篩選的研究中普遍存在,最終的穩定性排名需要綜合分析[31-32],昆蟲內參篩選研究中Actin常被認為是理想的內參,即使作為溫度脅迫時也較為穩定[33-34],在本研究中發現香梨優斑螟老熟幼蟲在低溫脅迫處理后Actin基因也比較穩定性,其穩定性比UBQ和GAPDH基因要差些,這點與水稻害蟲褐飛虱(Nilaparvatalugens)和白背飛虱(Sogatellafurcifera)的研究結果相同[35]。GAPDH基因穩定性相對較好,在斜紋夜蛾(Ctenopseustisobliquana)溫度脅迫時被認為GAPDH是最佳內參[28],而在對瓜實蠅(Bactroceracucurbitae)的溫度脅迫研究中GAPDH基因穩定性并不好[36],昆蟲種類甚至蟲態不同內參穩定性都會存在差異,如二化螟(Chilosuppressalis)和褐飛虱(Nilaparvatalugens) 溫度脅迫的研究中以TUB基因作為內參[37-38],而本研究中發現TUB是5個候選內參基因中最不穩定的。
HSPs基因對外界環境的迅速響應可能與細胞保護作用有關[10],香梨優斑螟幼蟲低溫脅迫下HSP70和HSP90在30 min顯著高表達,約1 h后達到峰值,推測HSPs受到外界低溫刺激后被大量誘導表達,以避免受到低溫傷害;在之后的處理時間內表達量有所下降,應該是受到相應HSPs積累量調控所致,這種調控還表現在18 h時基因表達有所回升的現象,這與三葉草斑潛蠅(Liriomyzatrifolii)和B型煙粉虱(BemisiatabaciB-biotype)研究結論相似[39-40]。
4 結 論
5種內參基因在香梨優斑螟幼蟲低溫脅迫處理后表達有一定差異,除了TUB基因外,表現比較穩定,其中UBQ基因穩定性最好。在低溫脅迫下,HSP70和HSP90基因相對表達量都呈現先上升后下降的趨勢,并在18 h后有小幅度上升,并維持在較高的水平,這可能有助于提升幼蟲對低溫的耐受力。

