異丁酰輔酶A脫氫酶在便秘型腸易激綜合征結腸黏膜的表達
張春燕,歐陽晶,孫 剛,張修禮,王巍峰,楊云生
腸易激綜合征(irritable bowel syndrome,IBS)是一種功能性腸病,表現為反復發作的腹痛,與排便相關或伴隨排便習慣改變,是消化系統常見的疾病之一。目前,IBS的發病機制還不完全清楚。我們在前期工作中發現異丁酰輔酶A脫氫酶(isobutyryl-CoA dehydrogenase,ICD)在腹瀉型IBS患者結腸黏膜表達異常[1]。作為代謝相關酶ICD是哺乳動物乙烯還原酶家族成員之一,屬于核編碼的線粒體黃素酶家族成員,它以可溶性同源四聚體的形式存在于線粒體的基質中,涉及脂肪酸β-氧化以及亮氨酸、異亮氨酸、賴氨酸以及加壓素的代謝[2]。對人類代謝組學的全基因組關聯研究顯示與β-氧化相關的許多代謝產物的正常變化具有很強的遺傳相關性[3-4]。雖然β-氧化的極端異常導致短鏈或中鏈酰基肉堿脫氫酶缺乏易導致罕見病癥,但β-氧化不太嚴重的異常與許多成人慢性病如2型糖尿病、肥胖、癌癥、潰瘍性結腸炎和神經退行性變有關[5]。ICD參與脂肪酸β-氧化,本研究進一步觀察ICD在便秘型IBS(IBS with constipation,IBS-C)患者結腸黏膜的表達情況,以期為IBS發病機制提供進一步佐證。
1 材料和方法
1.1 一般資料 按照羅馬Ⅲ診斷標準及羅馬Ⅲ科研診斷標準,選擇同時符合標準的IBS-C患者12例,男女各6例,年齡36~58(45.8±6.2)歲;選取健康對照者12例,男女各6例,年齡40~56(47.8±4.5歲)。均獲得知情同意,并經中心倫理委員會批準。根據前期研究的方法鉗取盲腸、乙狀結腸黏膜組織[1]。
1.2 實驗方法
1.2.1 結腸黏膜HE染色 各部位標本以10%甲醛固定、石蠟包埋、4 μm厚連續切片,按常規進行。病理切片的觀察由2名病理學專家完成。
1.2.2 Western Blot方法檢測 取20 μg所提取的蛋白經過12%的分離膠分離,上樣量20 μg;一抗小鼠抗人ICD多克隆抗體(中國臺灣Abnova公司,效價1∶100),室溫孵育1 h;二抗HRP標記的羊抗小鼠IgG(1∶10 000)室溫孵育1 h。用ECL顯色試劑對膜進行顯色,結果分析以β-actin蛋白表達作為參照,應用BioRad公司提供的QuantityOne分析軟件進行圖像分析。測定目的顯影條帶和內參照β-actin(稀釋度1∶2 000)的灰度值,結果以比值(樣本灰度值/內參照灰度值)表示。
1.2.3 熒光定量PCR方法檢測ICD mRNA的表達 將分離的組織懸液200 μL 加入1 mL TRIzol,提取RNA;按照逆轉錄試劑盒說明將RNA反轉成cDNA。根據基因總長進行引物設計。ICD引物序列:上游5′-GTGCCTGGATGATTGATAG-3′,下游5′-TCTCCCTGTTTCTTAGCG-3′;GAPDH引物序列:上游5′-TTGTCAGCAATGCATCCTGCAC-3′,下游5′-ACAGCTTTCCAGAGGGGCCATC-3′,引物由上海英俊生物有限公司合成。
熒光定量PCR擴增反應體系如下:下游引物各0.25 μL,滅菌注射用水7.5 μL,熒光定量PCR Mix10 μL,cDNA 2 μL,反應總體系20 μL。反應條件:預變性95 ℃ 5 min;變性95 ℃ 30 s, 退火55 ℃ 30 s,延伸72 ℃ 30 s,反應40個循環;60 ℃ 30 s(收集溶解曲線),反應40個循環。擴增產物用實時定量PCR儀Bio-rad IQ5軟件進行分析。

2 結果
2.1 Western Blot方法檢測結腸黏膜ICD表達情況ICD在乙狀結腸黏膜的表達IBS-C組低于健康對照組(P<0.05);ICD在IBS-C組乙狀結腸、盲腸的表達差異比較無統計學意義(P>0.05);ICD在健康對照組乙狀結腸、盲腸表達差異比較無統計學意義(P>0.05)。圖1。
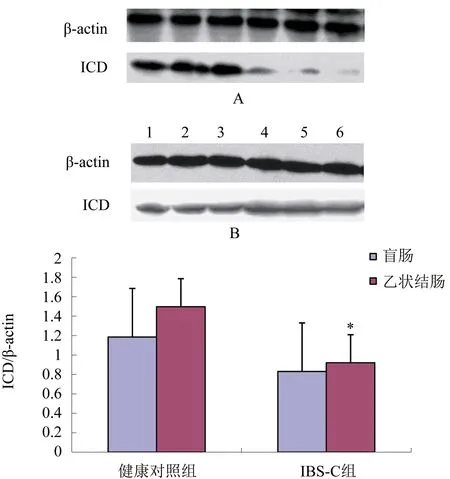
A:ICD在乙狀結腸的表達;B:ICD在盲腸的表達(泳道1-3為健康對照組;泳道4-6為IBS-C組);C:ICD/β-actin IBS-C組與健康對照組比較,*P<0.05
2.2 熒光定量PCR檢測ICD mRNA的相對表達量與健康對照組比較,IBS-C組乙狀結腸ICD mRNA的表達明顯下調(P<0.05);與健康對照組比較,IBS-C組盲腸ICD mRNA的表達差異比較無統計學意義(P>0.05,圖2)。
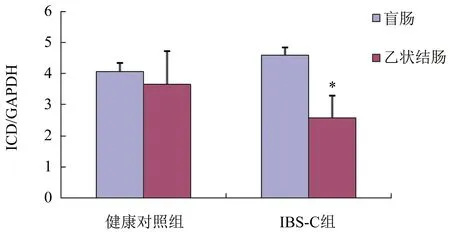
與健康對照比較,*P<0.05
3 討論
ICD是哺乳動物乙烯還原酶家族成員之一,屬于核編碼的線粒體黃素酶家族成員,它以可溶性同源四聚體的形式存在于線粒體的基質中,由N-末端α螺旋區域,α β片狀區域以及另外C-末端的α螺旋區域組成,涉及脂肪酸β-氧化和亮氨酸、異亮氨酸、賴氨酸、加壓素的代謝[6]。ICD在代謝過程中催化脂酰輔酶A中間產物的α,β脫氫(作用),在代謝支鏈氨基酸加壓素的代謝中催化異丁酰輔酶A轉化異丁烯酰基輔酶A,在亮氨酸的代謝中催化異戊酰輔酶A的脫氫作用[7]。
ICD的遺傳缺陷導致異戊酸酸血癥,ICD缺乏癥是一種罕見的代謝性疾病,常在兒童期發病,其發病與體內編碼ICD的基因發生突變有關[8]。1998年,Roe等[9]報道了首例ICD缺乏癥。直到2002年,Nguyen等[10]首次報道病癥的基礎是在DNA水平的異常。大多數患者無癥狀僅在串聯質譜法新生兒篩查時發現此病,常有報道經篩查出的患者沒有給予任何治療依然無任何癥狀[11]。蛋白結構和折疊研究已經發現與疾病相關的ACAD基因變異導致蛋白錯折疊以及不穩定[12]。ACADS基因的突變分析揭示了突變R302Q(指的是在成熟蛋白質中的全長蛋白質對應的氨基酸280)的同合子性,使精氨酸被谷氨酰胺所代替,在體外能導致酶失活[10]。R302Q影響FAD輔助因子的作用以及ICD四聚體分子亞單位之間相互作用或FAD與四聚體亞單位間的作用[12]。
本研究通過Western Blot方法檢測發現健康對照組及IBS-C患者結腸黏膜上皮細胞均有ICD的表達,ICD在IBS-C乙狀結腸表達明顯低于健康對照組的相應部位,但ICD在盲腸的表達差異比較無統計學意義。通過熒光定量PCR也進一步確認了IBS-C組乙狀結腸的ICD mRNA表達下調。結腸黏膜ICD的表達下調提示亮氨酸、異亮氨酸、賴氨酸以及加壓素代謝可能異常。ICD除了在先天性代謝性疾病的研究外,有關ICD與疾病的研究較少,Wollmer等[13]發現ICD基因多態性與散發型Alzheimer’s病有關。選擇性剪接小鼠編碼ICD的基因可導致線粒體缺陷和引起小鼠肝臟脂肪變性[14]。人肝脂肪變性與ICD的關系需進一步研究證實。亮氨酸、異亮氨酸及加壓素等支鏈氨基酸對于正常細胞的生長和發育尤其重要,IBS結腸組織中這些氨基酸代謝異常,必然影響結腸上皮細胞正常的功能。ICD的表達減低是否也跟基因突變有關?是否會引起其上游代謝產物在結腸黏膜局部累積,是否存在氨基酸代謝異常,從而導致IBS患者的癥狀?我們在前期研究中發現糖代謝相關酶醛縮酶A在IBS結腸黏膜表達異常[15]。兩者是否相互關聯?與β-氧化的關系怎樣?這些問題都有待于進一步研究。

