自噬相關基因LC3、Beclin1及mTOR與乳腺癌發生發展及預后的相關性
楊燕 張毓
(錦州醫科大學,遼寧 錦州 121000)
乳腺癌的發病率和死亡率逐年增加〔1〕。雖然目前乳腺癌的治療有很多選擇,如外科手術、激素治療、放療、化療、靶向治療〔2〕,但也存在諸多局限,如狹窄的治療范圍,增加的感染風險,對正常組織的非選擇性毒性作用及嚴重的副作用可能在治療完成后持續數月或數年等〔3〕。乳腺癌的特征是異常細胞的積累,可能歸因于細胞增殖失衡、細胞凋亡及自噬調節紊亂〔1〕。自噬是一種進化上保守并依賴溶酶體降解缺陷細胞質和細胞器的過程,被認為是一種重要的程序性細胞死亡,由至少15個基因對其進行高度復雜的表達調控,協調完成誘導、成核、延伸和自噬溶酶體的動態過程。微管相關蛋白輕鏈(LC)3、Beclin1(一種哺乳動物的酵母Atg6基因同源物)及哺乳動物雷帕霉素靶蛋白(mTOR)在該過程中發揮了重要作用,三者處于不同的自噬階段,mTOR作用于自噬誘導期,通過去磷酸化后激活細胞內泛素樣激酶復合物誘導自噬的起始;Beclin1涉及自噬小體形成的早期階段(成核階段),它與Ⅲ型磷酸肌醇3激酶(PI3KC3)形成復合體,調節其他自噬相關基因表達蛋白在自噬前體中的結構定位,從而促進自噬體形成,被認為是自噬起始的重要組成部分,LC3以LC3-Ⅰ和LC3-Ⅱ兩種形式存在并參與自噬的后期,LC3-Ⅰ在正常情況下定位于細胞質,當自噬被誘導,LC3的胞質形式LC3-Ⅰ通過與脂質分子磷脂酰乙醇胺(PE)結合轉化為LC3-Ⅱ,靶向定位于自噬體膜介導自噬溶酶體的形成〔1,4~6〕。自噬具有雙面性,在正常細胞中,自噬可作為腫瘤抑制機制,消除有毒物質、受損的細胞器、錯誤折疊的蛋白質、減少氧化應激和保護細胞免受遺傳損傷;在腫瘤細胞中,自噬可能在饑餓、缺氧和治療性應激等條件下成為一種生存途徑〔6,7〕。在乳腺癌的發生發展進程中,自噬被認為起著矛盾的作用,它是抑癌還是促癌取決于應激刺激的性質、遺傳背景、腫瘤發生階段等〔1〕,一些研究表明自噬減少會導致乳腺癌進展〔8~10〕,而其他研究表明自噬活性增加與乳腺癌預后較差相關〔11,12〕。本研究擬探討乳腺癌組織中自噬相關基因LC3、Beclin1及mTOR的表達情況及其與乳腺癌發生發展及預后的相關性。
1 資料與方法
1.1一般資料 2010年1月至2013年1月在錦州醫科大學附屬醫院行手術治療的乳腺癌組織為乳腺癌組,同時取癌旁組織(距癌組織邊緣>5 cm)為對照組。入組標準:①初診患者,有手術指征,無手術禁忌;②術前未行放療、化療、生物免疫等抗腫瘤治療;③術后病理診斷確診為乳腺癌;④術后按乳腺癌診療規范根據病情完成相應治療;⑤臨床及病理資料完整,依從性好,隨訪內容完整可靠。排除標準:①合并其他惡性腫瘤;②確診后需首選其他抗腫瘤治療,而非手術治療;③合并嚴重基礎疾病、認知障礙或精神類疾病。共有92例符合標準的乳腺癌患者入組,年齡23~65〔平均(41.2±2.5)〕歲。按美國癌癥聯合委員會乳腺癌分期第6版標準〔13〕:ⅠA期11例,ⅠB期26例,ⅡA期34例,ⅡB期21例;細胞分化程度:高分化29例,中分化33例,低分化30例;有淋巴結轉移者31例,無淋巴結轉移者61例。患者術后隨訪時間為11~60個月,平均47.2個月,隨訪方式為入院、門診或電話,隨訪期間定期復查血常規、肝腎功、心電圖、腫瘤標記物、CT、骨掃描,隨訪截止于2018年1月,總生存期(OS)計算從術后病理確診至患者死亡或隨訪結束。本研究經錦州醫科大學附屬醫院醫學倫理委員會批準,入組患者均簽署知情同意書。
1.2試劑與方法 兔抗人LC3A/B單克隆抗體 (4599T、3868T) 購自Cell Signaling公司,羊抗人Beclin1(3663-100)購自艾美捷科技,兔抗人mTOR(T2949)購自Sigma公司,HRP標記的羊抗兔二抗(BHR101)購自博爾西公司。
1.3免疫組化Envision法檢測LC3、Beclin1及mTOR表達 手術組織標本使用10%甲醛固定、石蠟包埋、4 μm切片,60℃溫箱烘烤30 min,二甲苯脫蠟3次,每次5 min,遞減梯度乙醇復水,磷酸鹽緩沖液(PBS)沖洗后將切片放入檸檬酸鹽緩沖液中高溫修復暴露抗原,待自然冷卻再次使用PBS沖洗,將切片置于3%H2O2中恒溫孵育10 min封閉內源性過氧化物酶,使用蒸餾水及PBS沖洗,蛋清封閉后在室溫中放置10 min,分別滴加羊抗人一抗(LC3工作濃度1∶25;Beclin1工作濃度1∶50;mTOR工作濃度1∶25)后將切片置于4℃冰箱過夜,次日使用蒸餾水及PBS沖洗后在切片上滴加辣根過氧化物酶(HRP)標記的兔抗羊二抗(工作濃度1∶100),37℃恒溫箱孵育30 min,蒸餾水及PBS液沖洗切片后使用二氨基聯苯胺(DAB)試劑盒染色2~5 min,顯色完成后蒸餾水沖洗切片中止顯色并使用蘇木素復染3~5 min,蒸餾水沖洗后1%鹽酸酒精分化3~5 s,充分沖洗后遞增梯度乙醇反向脫水、烤片、中性樹膠封片。
1.4結果判定 免疫組化染色結果按染色強度和腫瘤細胞陽性細胞比例進行判定〔14〕,將每張染色切片的染色深淺與背景著色對比后按染色強度分級計分:無色計0分,淡黃計1分,棕黃計2分,棕褐計3分;按腫瘤細胞陽性比例計分:陰性計0分,≤10%計1分,11%~50%計2分,51%~75%計3分,>75%計4分。雙盲法評分,以染色強度及腫瘤細胞陽性比例分數相乘得到的積分作為最后判定結果,≤3分為陰性,>3分為陽性。
1.5統計學方法 采用GraphPad Prism5軟件繪制生存曲線圖。采用SPSS17.0軟件進行χ2檢驗、Fisher精確概率檢驗及Log-rank檢驗。
2 結 果
2.1兩組LC3、Beclin1及mTOR表達情況 兩組標本中均有LC3、Beclin1及mTOR表達,乳腺癌組LC3、Beclin1及mTOR表達陽性率〔41.30%(38例)、32.60%(30例)、45.65%(42例)〕顯著低于對照組〔10.87%(10例)、13.04%(12例)、11.96%(11例)〕(P<0.05)。見圖1。
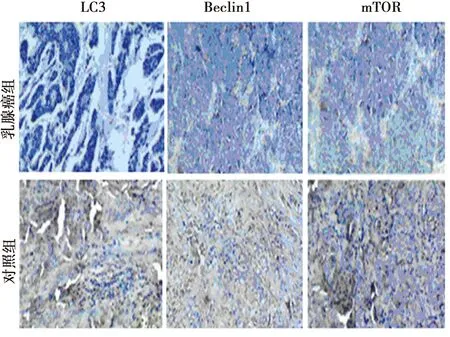
圖1 兩組LC3、Beclin1及mTOR的免疫組化(DAB染色,×40)
2.2乳腺癌組LC3、Beclin1及mTOR表達與臨床病理特征的關系 乳腺癌組中LC3及mTOR表達與細胞分化程度、臨床分期及淋巴結轉移有關(均P<0.05),分化程度差、臨床分期晚、伴有淋巴轉移的患者LC3及mTOR陽性表達率明顯增高。Beclin1表達與腫瘤直徑、分化程度、臨床分期及淋巴結轉移有關(均P<0.05)。腫瘤直徑≤2 cm、分化程度好、臨床分期早、不伴有淋巴轉移的患者Beclin1陽性表達率增高。見表1。
2.3乳腺癌組LC3、Beclin1及mTOR表達與生存期的關系 乳腺癌組LC3陽性表達組5年OS(62.63%)顯著低于LC3陰性表達組(93.94%,χ2=6.391,P=0.012);乳腺癌組Beclin1陽性表達組5年OS(94.44%)顯著高于Beclin1陰性表達組(71.26%,χ2=4.352,P=0.037);乳腺癌組mTOR陽性表達組5年OS(66.76%)顯著低于mTOR陰性表達組(93.59%,χ2=4.538,P=0.033)。見圖2。
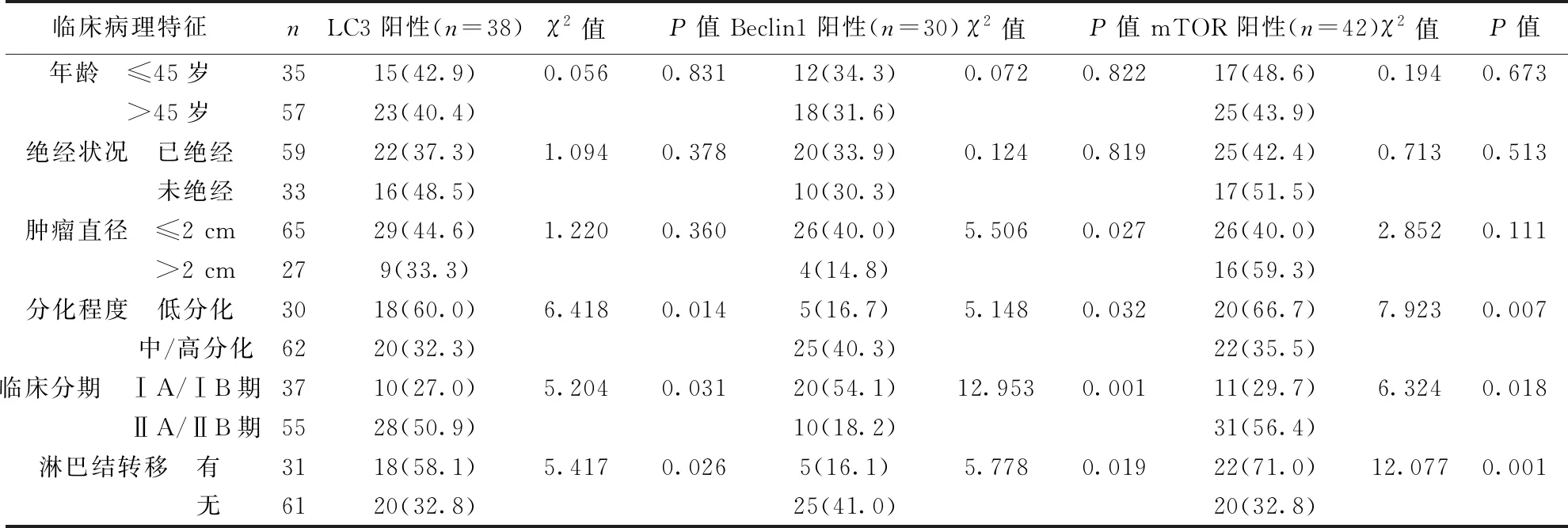
表1 LC3、Beclin1及mTOR表達與乳腺癌臨床病理特征的關系〔n(%)〕

圖2 乳腺癌組LC3、Beclin1及mTOR表達對OS的影響
3 討 論
自噬是一個降解細胞內成分以緩沖饑餓條件下代謝壓力的過程,其失調與癌癥的進展有關,基于基因表達譜的研究發現自噬相關基因與乳腺癌有關,但自噬是抑制或促進腫瘤細胞的生長一直是爭論的焦點〔15〕。研究認為,自噬具有維持細胞內穩態的重要作用,在乳腺癌發生早期,自噬能夠通過抑制炎癥反應、控制細胞應激反應、破壞基因突變等方式阻止腫瘤的發生發展〔7,16,17〕。本研究提示乳腺癌中LC3、Beclin1及mTOR的表達與乳腺癌的發生有關。LC3是自噬體膜上的標記蛋白,存在于自噬溶酶體的降解過程中,被廣泛視為自噬標志物,自噬溶酶體形成后,自噬體通過吞噬消除細胞中的有害因子并為正常細胞提供能量〔1,7〕,LC3表達水平的降低提示自噬體形成減少,細胞自噬下調;Beclin1于1999年被確認為是一種抑癌基因,在正常的乳腺上皮細胞中呈高表達,在人乳腺癌上皮組織中,Beclin1 mRNA和蛋白表達水平明顯降低,而過表達Beclin1可增強自噬從而抑制人乳腺癌細胞MCF-7的細胞增殖和腫瘤形成〔18〕,40%~75%的散發性乳腺癌中存在Beclin1一個等位基因的缺失,被認為是導致乳腺癌細胞自噬缺陷及自噬活性降低的原因〔6〕;mTOR是一個絲氨酸/蘇氨酸蛋白激酶,能夠在細胞水平上將影響營養利用的生長信號進行整合從而調控細胞內能量代謝和細胞自噬等過程,mTOR對自噬有誘導作用,但營養不良的細胞外環境也會抑制mTOR的活性,因此惡性腫瘤中mTOR多為低表達,同時,乳腺癌的發生與磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)/mTOR信號傳導通路的激活關系密切,在超過30%的浸潤性乳腺癌中可發現該通路中基因分子的改變〔1,7〕。三者作為作用不同自噬階段的自噬相關基因,其表達水平的下調可能抑制正常乳腺細胞的自噬活性,從而導致乳腺癌的發生。
自噬具有雙面性,在消除細胞有害因子抑制腫瘤發生的同時也可能促進腫瘤的發展,研究發現,在惡劣環境中,自噬將會通過降解細胞內蛋白質和細胞器為腫瘤細胞的生長提供能量,從而維持其在營養缺乏條件下的生存,導致腫瘤進行性發展〔7,18〕。Beclin1是抑癌基因,有研究證實Beclin1在淋巴結轉移陽性、遠端轉移陽性及Ki67陽性的乳腺癌組織中表達更低〔5〕,同時,AKT和細胞外調節蛋白激酶(ERK)的磷酸化水平在Beclin1缺失的乳腺癌細胞MDA-MB-231中升高,Beclin1與生長因子受體信號通路持續的強度及時間存在負相關,提示Beclin1可以抑制乳腺癌細胞的侵襲轉移〔19〕,這或許是本研究中發現乳腺癌患者Beclin1表達與腫瘤負荷呈負相關的原因。此外,癌癥基因組圖譜(TCGA)和乳腺癌國際聯盟(METABRIC)兩個大型數據庫中乳腺癌患者的mRNA表達模式顯示,與乳腺癌中惡性程度比較低的亞型(LuminalA/B)相比,Beclin1低表達在乳腺癌惡性程度比較高的亞型人類表皮生長因子(HER)-2和基底細胞樣(多為三陰性)中更常見,并且與晚期腫瘤級別密切相關〔9〕。腫瘤直徑、細胞分化程度、臨床分期及淋巴結轉移情況均是體現腫瘤負荷和惡性程度的臨床病理指標,對乳腺癌患者的預后具有一定的預測作用,而本研究的生存分析結果也證實了這一點。由于自噬在乳腺癌中的矛盾性,LC3、Beclin1及mTOR對乳腺癌預后的預測作用尚不明確,TCGA和METABRIC兩個大型數據庫中乳腺癌患者的mRNA表達模式顯示LC3和mTOR高表達量的患者生存率顯著低于低表達量者,與本研究結果一致〔9〕。有研究從幾個獨立隊列的mRNA和蛋白水平上驗證得出LC3是三陰性乳腺癌不良預后的可靠標記的結論,抑制自噬是三陰性乳腺癌一種有前途的治療策略,而LC3對乳腺癌其他亞型的預后無預測價值〔20〕;而針對23項不同癌癥的研究進行系統審查和薈萃分析則顯示Beclin1可能是胃癌、乳腺癌和淋巴瘤有利預后的預測因素,LC3可能預示乳腺癌的不良預后(HR=1.98,95%CI=1.25~3.13)〔21〕,Tang等〔9〕也發現Beclin1的低表達與預后不良有關,其表達是生存的獨立預測因子。當前大部分研究還是傾向于Beclin1的表達下降與預后不良和整體生存率降低有關,在乳腺癌中,Beclin1表達越高其預后越好〔22〕。
綜上,LC3、Beclin1及mTOR在乳腺癌中表達均降低,與乳腺癌的發生發展及預后相關。自噬的失活與乳腺癌患者的生存期縮短有關,自噬信號的預后價值獨立于已知的臨床預后因素,包括年齡、腫瘤大小、級別、雌激素受體狀態、孕激素受體狀態、酪氨酸激酶受體(ERBB)2狀態、淋巴結狀態和腫瘤蛋白53突變狀態,同時,自噬信號也可以預測乳腺癌無遠處轉移的存活率〔15〕,但由于自噬過程調控的復雜性,尚需針對不同的乳腺癌亞型進行大樣本的前瞻性研究并深入探討基因層面的機制調控,以尋找到針對乳腺癌的特異性自噬信號開發新的治療策略。

