挪威槭“普林斯頓金”快繁技術研究
瞿蒙滔 張承妹 孫 健 姚吉賽
(上海妙農植物科技有限公司,上海市浦東新區 201314)
挪威槭原產于歐洲高加索山脈,土耳其北部和北愛爾蘭地區,是槭樹科槭屬落葉大喬木,高度可達12 m,枝條繁茂,卵圓樹形;樹葉表面脈紋明顯,葉掌狀、大、5裂、基部心形、邊緣有少數齒;樹皮灰褐色。挪威槭“普林斯頓金”(Acer platanoides‘Princeton Gold’)為挪威槭中春色葉和秋色葉品種,春季葉片為金黃色,夏季葉片為綠色,秋季葉片又變為靚麗的金黃色,在國外綠化中大多為孤植或作為行道樹[1]。該樹種適生區域較廣,耐輕度鹽堿、生長速度中等,具有耐寒(-40 ℃)、耐熱(36 ℃)等優點,且在引進上海的初期生長觀察中,夏天高溫時老葉雖有焦傷,但不影響其生長及秋季觀賞[2-3]。
目前,由于挪威槭“普林斯頓金”繁殖困難,扦插繁殖系數低,不能播種繁殖,故其在國內推廣的主要擴繁方式是嫁接;而組織培養實現大量快速繁殖,加快育苗進程;此外,與挪威槭同屬的槭組織培養和快速繁殖己有報道,但挪威槭“普林斯頓金”的組培仍未見報道。在此背景下,為了快速擴大挪威槭“普林斯頓金”的種群數量,筆者以其休眠芽及其當年生的嫩莖為外植體,進行了其快繁技術研究,以期建立完整的挪威槭“普林斯頓金”離體快繁技術體系。現將相關研究結果報道如下。
1 材料與方法
供試材料為挪威槭“普林斯頓金”的休眠芽及其當年生的嫩莖。試驗時間為2016年11月至2017年6月,于初春選晴天中午,剪取帶休眠芽的枝條及當年生的嫩莖(剪成長1.5~2.5 cm的莖段)帶回實驗室,用2%洗滌靈溶液沖洗1 min,去除表面油污和塵土,然后流水沖洗2 h以上,再用70%乙醇進行表面消毒30 s,然后用無菌水沖洗1~2次。
用0.05%二氧化氯消毒液和0.1%升汞分別浸泡5、10、15、20 min,然后用無菌水沖洗4~5次;將消毒后的外植體分別接種在不同的不定芽誘導培養基上和繼代增殖培養基(按外源激素不同設置處理)上;待分化出的小苗長出2~3張小葉、苗高3 cm左右時,將其接種在不同的生根培養基(按外源激素不同設置處理)上進行培養。其中,不定芽誘導培養基和繼代增殖培養基均附加蔗糖30 g/L、瓊脂6.5 g/L,根誘導培養基附加蔗糖25 g/L、瓊脂6.5 g/L。不同培養基處理見表1、表2、表3[4]。
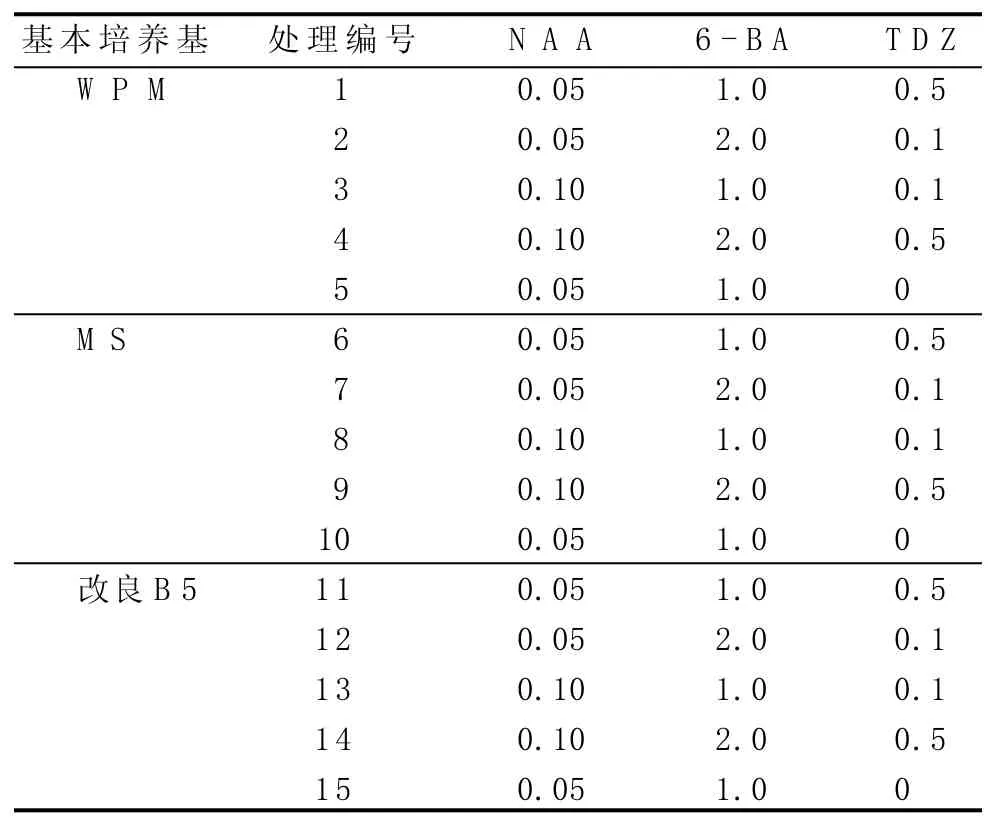
表1 不定芽誘導培養基處理設計 (單位:mg/L)
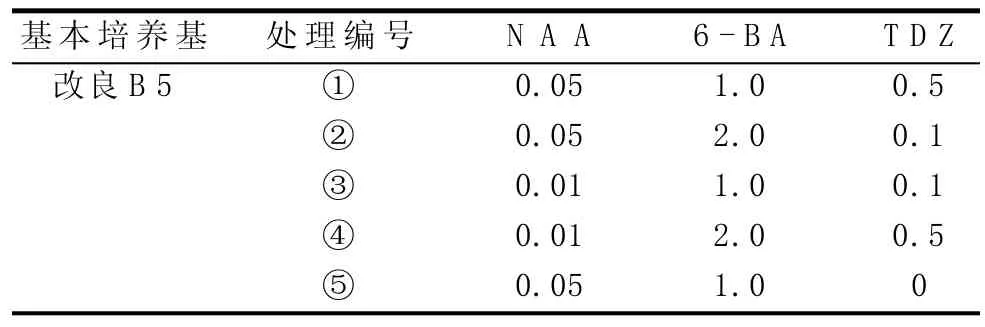
表2 繼代增殖培養基處理設計 (單位:mg/L)
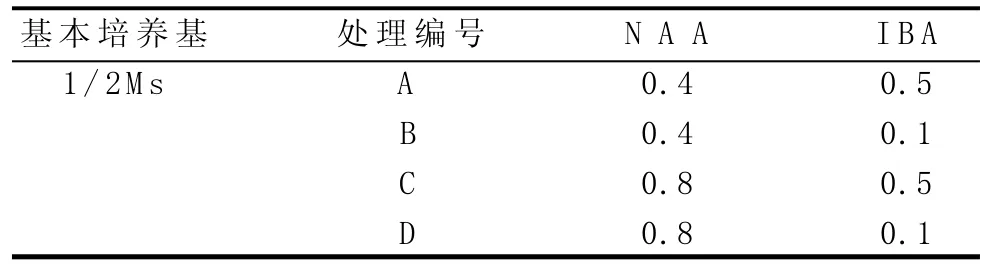
表3 生根培養基處理設計(單位:mg/L)
2 結果與分析
2.1 無菌體系的建立
在植物組織培養中,篩選適當的滅菌材料、確定最佳的處理時間是無菌體系建成的重要環節。消毒時間太短,不能對外植體進行徹底消毒,會導致材料污染;消毒時間過長,易將外植體的組織細胞殺死,致使其褐化或枯死。由表4可知,用0.1%升汞浸泡10 min的消毒效果最好,其褐變率為0、污染率為20%。0.05%二氧化氯消毒液浸泡5、10 min的消毒效果也較好,污染率分別為40%、30%,但有一定的褐變率。
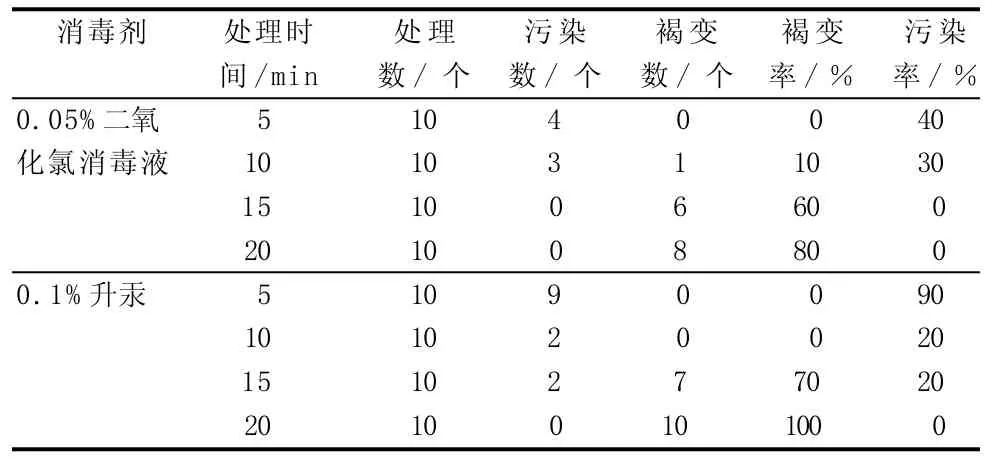
表4 消毒效果統計分析
2.2 不定芽誘導
據試驗期間觀察,用挪威槭“普林斯頓金”的休眠芽為外植體進行不定芽誘導,其成活率較高;用當年生的嫩莖為外植體,由于嫩莖傷口處有白色乳汁,易受污染,后期大多干枯死亡,很少有不定芽產生。
由表5可知,采用改良B5作為基本培養基比采用WPM、MS作為基本培養基更有利于挪威槭“普林斯頓金”的不定芽分化誘導,說明在挪威槭“普林斯頓金”的組織培養過程中,無機鹽的濃度和種類對不定芽的分化誘導有重要影響。添加NAA+6-BA+TDZ有利于挪威槭“普林斯頓金”的不定芽分化誘導;經觀察,添加TDZ是必需的,但其濃度不同,會導致玻璃化現象出現;NAA+6-BA的濃度對挪威槭“普林斯頓金”的不定芽分化誘導也起著重要作用,其中6-BA以 1.0 mg/L為適宜濃度。
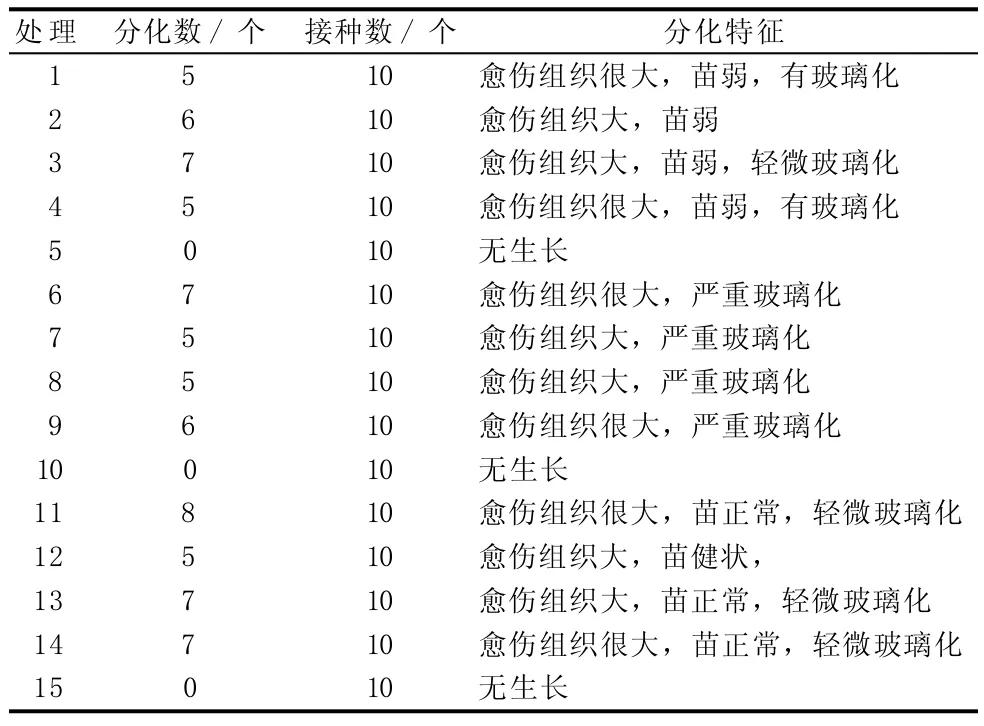
表5 不定芽誘導培養結果統計分析
2.3 繼代增殖培養
由表6可知,在挪威槭”普林斯頓”不定芽組培中,以培養基配方為改良B5+NAA 0.01 mg/L+6-BA 1.0 mg/L+TDZ 0.1 mg/L+蔗糖30 g/L(pH 5.5)的分化率較高,且分化出的芽生長狀況良好;雖然提高TDZ濃度可提高增殖率,但分化出的小苗出現了玻璃化現象。
增殖培養基選用改良B5+NAA 0.01 mg/L+6-BA 1.0 mg/L+TDZ 0.1 mg/L+蔗糖30 g/L(pH 5.5),由于其和不定芽誘導培養基的成分相同,故不定芽誘導和繼代增殖可同時進行,從而可縮短無菌體系建立的時間。
值得注意的是,挪威槭“普林斯頓金”在組織培養過程中極易褐化,而吳婉婉等的研究表明,在植物組織培養過程中,及時轉瓶、更換新的培養基可有效降低褐化率。因此,在挪威槭“普林斯頓金”組織培養過程中,要定期更換成分相同的新培養基,更換時間間隔為20 d。

表6 繼代增殖培養結果統計分析
2.4 生根培養
由表7可知,在挪威槭“普林斯頓金”組織培養中,以培養基配方為1/2 MS+NAA 0.4 mg/L+IBA 0.5 mg/L+25 g/L蔗糖(pH 6.2)的生根率較高,為86%,且培養10 d即有不定根生成,生根所用時間較短,不定根的生長狀況較為良好。

表7 生根培養結果統計分析
3 結 論
試驗結果表明,利用挪威槭“普林斯頓金”的休眠芽為外植體可建立穩定的快繁技術體系,其技術流程為:休眠芽用2%洗滌靈溶液沖洗1 min,去除表面油污和塵土,然后流水沖洗2 h以上,再用70%乙醇進行表面消毒30 s,然后用無菌水沖洗1~2次,再用0.1%升汞浸泡10 min后,用無菌水沖洗,去除殘留后,剝去外層芽苞(由于升汞對環境和人體的危害較大,也可用二氧化氯消毒液作為消毒劑,效果也較好)。不定芽誘導的基本培養基宜選用改良B5,通過添加適宜濃度的NAA+6-BA+TDZ,在此培養基上亦可直接進行增殖誘導,以縮短無菌體系建立的時間,但需每隔20 d更換1次培養基,以有效防止褐化[5-6]。待分化出的小苗長出2~3張小葉、苗高為3 cm左右時,將其接種到生根培養基[1/2 MS+NAA 0.4 mg/L+IBA 0.5 mg/L+25 g/L蔗糖(pH 6.2)]上進行培養,可誘導不定根形成,從而完成植株再生。
挪威槭“普林斯頓金”是園林裝飾的優良樹種,其未來發展空間巨大,但由于其繁殖困難、扦插繁殖系數低,不能播種繁殖。通過建立挪威槭“普林斯頓金”快繁技術體系,可在短期內實現大量快速繁殖,加快其育苗進程,從而滿足市場需求。因此,挪威槭“普林斯頓金”快繁技術體系具有較大的推廣應用價值。

