共表達分子伴侶提高漆酶在畢赤酵母中的分泌
王晨蕾, 劉 松, 堵國成, 陳 堅*
(1. 江南大學 工業生物技術教育部重點實驗室, 江蘇 無錫214122;2. 江南大學 生物工程學院, 江蘇 無錫214122)
漆酶是含多個銅原子的一種多酚氧化酶,廣泛分布于真菌、高等植物、細菌和昆蟲等生物中[1]。 漆酶可以高效地催化作用于各種酚類及非酚類化合物[2],伴隨著將氧分子還原為水分子。 漆酶作為化合物合成或結構修飾的催化劑被廣泛應用于環境的生物修復[3]、生物燃料生產[4]和生物制漿、紡織工業[5]等。 尤其在造紙工業中,采用傳統的強酸強堿高溫蒸煮制漿和化學法漂白,使廢液中含有多種有毒有害的有機化合物[6]。 漆酶作為生物制漿和生物漂白的催化劑在造紙工業中得到應用[7],與其它木素分解酶相比,漆酶催化效能高、反應條件溫和、對反應設備的要求低[8]。 隨著漆酶用途的不斷發現,對該酶的需求越來越大,因此提高漆酶的產量備受關注。
漆酶大多來源于絲狀真菌,發酵周期長、操作復雜、產生多種漆酶同工酶,阻礙了后續純化[9]。 異源表達不僅可以克服此障礙,且可采用蛋白質工程手段對酶分子改造,既可以提高產量,又能改善酶學性能[10],擴大其工業應用。目前漆酶在細菌、植物、酵母中均已實現異源表達。 細菌分泌漆酶能力普遍較低[11-12],且易形成聚合體難以純化。 Paulo 等[12]在E. coliAH3517 中用5 L 體系發酵漆酶, 產量最高為5 600 U/L。在轉基因植物中,漆酶產量更低,只有50~250 U/L[13-14]。 漆酶在酵母中主要以Pichia pastoris和Saccharomyces cerevisiae為宿主, 已有較多表達成功的例子,然而普遍產量也不高,表達水平不僅與酵母種類有關,還受漆酶同工酶種類的影響[15]。
巴斯德畢赤酵母(P. pastoris)作為一種相對簡單的真核表達系統,可以對外源重組蛋白質進行正確的折疊加工、糖基化修飾等,使用AOX1 強啟動子,以甲醇作為碳源,實現了多種外源產物的高效表達而得到廣泛應用[16]。研究報道,不同的蛋白質在畢赤酵母中表達時可能有不同的未折疊蛋白質響應(UPR)效應,可以通過改善蛋白折疊加工、運輸、脅迫應激等通路來提高UPR 因子效應,從而幫助外源蛋白質更好地分泌表達[17-19]。 Higashio 等[17]的研究結果表明, 在S. cerevisiae表達系統中過量表達T. reesei來源UPR 轉錄因子HAC1,使α 淀粉酶分泌量提高了2.4 倍。陳鳳祥[18]等在P. pastoris中共表達PDI 使重組菌IFNβ-HAS 表達量提高了90%。
為提高漆酶的表達水平,作者擬通過表達蛋白質折疊(BIP、ERO1)、囊泡運輸(SEC53、SEC1)、脅迫應激(HAC1、GCN4)等相關6 種分子伴侶,以期提高Cerrenasp. WR1 漆酶在重組P. pastoris中的表達水平。
1 材料與方法
1.1 材料
1.1.1 菌株及質粒Cerrenasp. WR1 來源的漆酶(GeneID:899203):由南京金斯瑞公司按照P. pastoris密 碼 子 偏 好 性 合 成;E. coliJM109、pMD-19T Simple、pGAPZB 和 含 重 組 質 粒pPIC9K-laccase 的P. pastoris菌株PP-L:均為作者所在實驗室保存。
1.1.2 主要試劑限制性內切酶PmlI、XhoI 和AvrII:均購自Thermo 公司;膠回收柱回收試劑盒、感受態制備試劑盒、Primer STAR HS DNA 聚合酶、DNA 連接酶: 均購自大連寶生物TaKaRa 公司;質粒提取試劑盒、G418: 購自上海生工生物工程股份有限公司;酵母基因組DNA 抽提試劑盒:購自天根;酵母粉與胰蛋白胨:購自Oxoid 公司;底物ABTS:購自Sigma 公司(美國);博萊霉素Zeocin(100 mg/mL):購自Invitrogen 公司;蛋白質Maker、考馬斯亮藍染色液: 均購自碧云天生物技術研究所;NuPAGE?Novex?Bis-Tris 預制凝膠: 購自Life Technologies 公司;其他常規試劑及藥品:為國產或進口分裝。
1.1.3 培養基LB 低鹽培養基:0.5 g/dL 酵母提取物,1 g/dL 蛋白胨,0.5 g/dL NaCl,pH 7.0。
YPD 培養基:1 g/dL 酵母提取物,2 g/dL 蛋白胨,2 g/dL D-葡萄糖。
BMGY 培養基:1 g/dL 酵母提取物,2 g/dL 蛋白胨,2 g/dL 甘油,體積分數10%的100 mmol/L 的PB(pH 6.0), 體積分數10%的10×YNB 酵母基礎氮源母液,4×10-5g/dL 生物素。
BMMY 培養基:1 g/dL 酵母提取物,2 g/dL 蛋白胨,2 g/dL 甲醇,體積分數10%的100 mmol/L 的PB(pH 6.0), 體積分數10%的10×YNB 酵母基礎氮源母液,4×10-5g/dL 生物素。
1.2 方法
1.2.1 畢赤酵母分子伴侶共表達質粒的構建GS115 基因組DNA 依照天根的酵母基因組DNA 提取試劑盒說明書進行。配制0.8 g/dL 的瓊脂糖對抽提的基因組DNA 進行凝膠電泳檢測純度, 使用Nanodrop 檢測其濃度,作為擴增分子伴侶基因的模板。
結合參考文獻, 作者分別選取蛋白折疊(BIP、ERO1)、 囊泡運輸(SEC53、SEC1)、 脅迫應激反應(HAC1、GCN4)模塊中的6 個基因,設計引物擴增P. pastorisGS115 分子伴侶基因,見表1。 取0.5 μL的GS115 基因組DNA 為擴增模板, 分別加入表1中的6 組分子伴侶基因擴增引物,用Primer Star HS高保真酶擴增。 擴增產物經瓊脂糖凝膠電泳檢測確認大小正確后,膠回收,用PmlI 和XhoI 酶切;質粒pGAPZB 同樣用PmlI 和XhoI 酶切,柱回收;連接, 構建成功6 個分子伴侶的組成型表達質粒,并將對分泌表達量有提高的分子伴侶進行組合共表達,構建一系列質粒及菌株,見表2。

表1 擴增分子伴侶所用引物Table 1 Primers used for amplification of chaperones
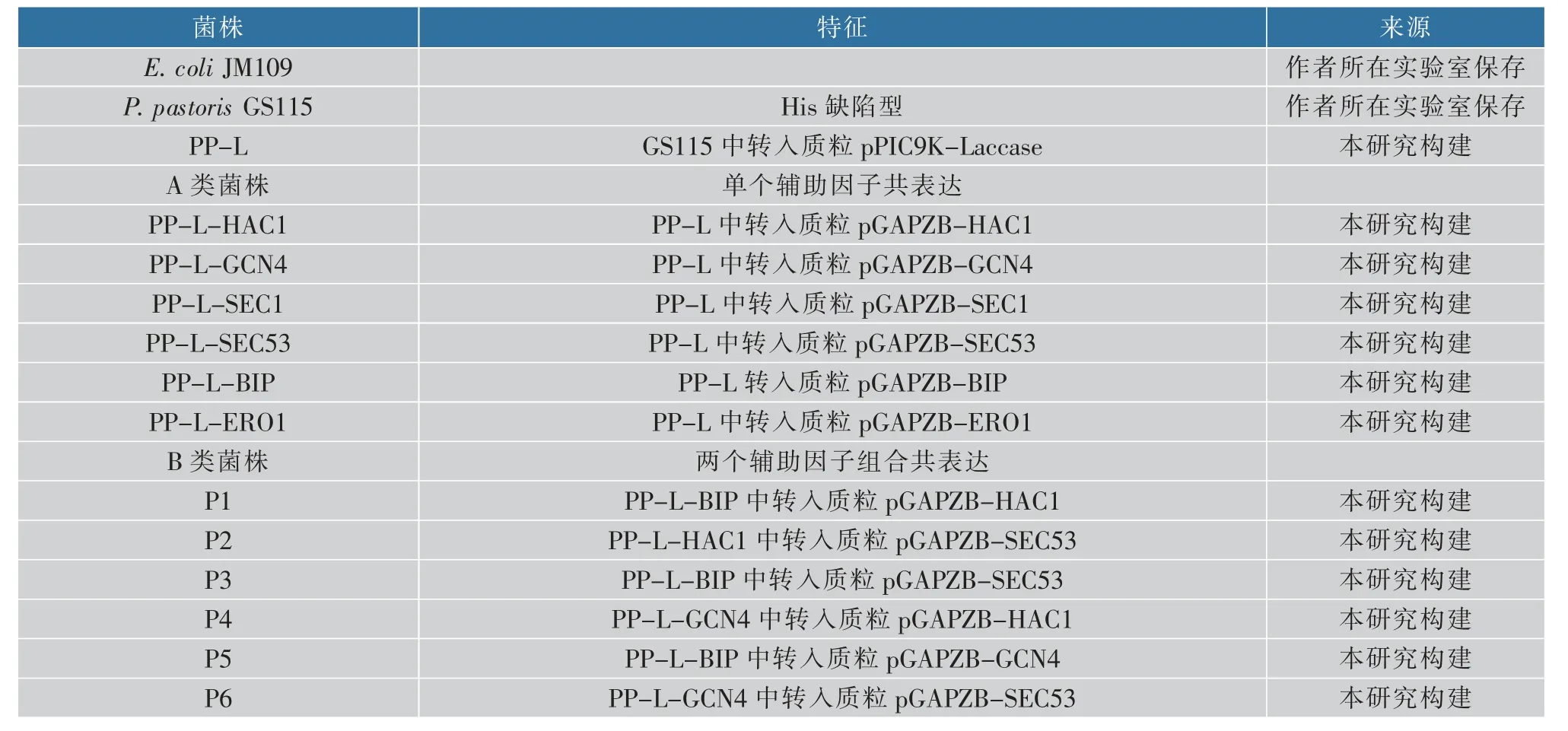
表2 本研究使用的菌株和共表達質粒Table 2 Strains and plasmids used in this study
1.2.2 畢赤酵母轉化與篩選漆酶表達質粒:將pPIC9K-Laccase 質粒用SalI 單酶切線性化, 柱回收后轉化P. pastorisGS115 感受態,涂布MD 平板,長出單菌落后,用含G418 抗生素的YPD 平板進行拷貝數篩選。
分子伴侶表達質粒:將上述構建好的分子伴侶共表達質粒,分別進行單酶切(Avr II)線性化,柱回收后轉化PP-L 感受態, 篩選平板選用含博萊霉素Zeocin 的YPD 平板,并進行菌落PCR 驗證,獲得單一目標分子伴侶DNA 條帶的菌株即為陽性轉化子;B 類菌株構建基于A 類菌株制作的感受態,同樣電擊轉化相應線性化質粒后, 用含博萊霉素Zeocin 的YPD 平板篩選,菌落PCR 驗證,同時獲得兩條目標分子伴侶DNA 條帶的菌株即為陽性轉化子。
1.2.3 重組菌發酵種子培養:取重組菌單菌落接種于YPD 培養基中,30 ℃、220 r/min 培養14 h 左右活化種子。
生長培養:上述活化的種子液以體積分數10%轉接于BMGY生長培養基中,30 ℃、220 r/min 培養24 h。
發酵培養:將上述培養液以5 000 r/min、4 ℃離心5 min,菌體沉淀用無菌水洗滌1~2 次后,全部轉接與BMMY 發酵培養基中,220 r/min、25 ℃搖瓶培養, 每24 小時補加2%甲醇誘導培養, 取樣進行SDS-PAGE 鑒定。
1.2.4 重組菌發酵生物量的測定菌體從BMGY生長培養基轉接到BMMY 發酵培養基后, 每24 小時取發酵液,稀釋,測定OD600,計算菌體密度。
1.2.5 漆酶酶活測定漆酶酶活力檢測:取一定的發酵液,8 000 r/min 離心10 min, 取上清液作為粗酶液。 漆酶反應體系為:0.1 mL 酶稀釋液,1 mmol/L的ABTS 0.5 mL,100 mmol/L(pH 3.4)的檸檬酸-檸檬酸鈉緩沖液2.4 mL,失活的酶液為空白對照。 漆酶反應條件為:30 ℃將ABTS 和檸檬酸-檸檬酸鈉緩沖液分別保溫5 min,加入酶液,于420 nm 處測定3 min 內吸光值的變化。
1.2.6 SDS-PAGE 凝膠電泳分析樣品與4×Loading buffer 混勻后,72 ℃加熱10 min, 蛋白質預制膠購自Life Technologies 公司,150 V 電泳30 min,具體操作方法參考說明書。
1.2.7 漆酶的純化及酶學性質測定發酵液8 000 r/min,4 ℃低溫離心10 min,得含漆酶的上清液。 將上清液放在冰中保持低溫,在磁力攪拌器上邊攪拌邊加入硫酸銨粉末使其終質量濃度為75 g/dL,離心后將沉淀用A 液(10 mmol/L 的PB,pH 6.0)復溶后放入透析袋中,磁力攪拌器攪拌24 h,用0.25 μmol/L的微孔濾膜過濾, 所得樣品用5 mL 陰離子柱Q 柱進行純化。 柱純化條件如下:用5~10 倍柱體積的A液對Q 柱進行平衡, 待電導穩定后, 流速設置為1 mL/min 從進樣管道進樣; 流速設置為3 mL/min,用5 倍柱體積的A 液淋洗柱子;以0、20%、40%、60%、80%、100%的B 液(10 mmol/L 的PB,pH 6.0,1 mol/L NaCl)進行梯度洗脫;取測到漆酶酶活的洗脫液在A液中過夜透析,4 ℃保存。
漆酶蛋白質質量濃度測定按照Bradford 蛋白質質量濃度測定試劑盒操作說明書進行;適當稀釋純化后的漆酶測定酶活力及蛋白質質量濃度后,計算比酶活;
按照1.2.5 方法在不同溫度下(20~70 ℃,以5 ℃為間隔)測定酶活力,得到最適溫度;在最適條件下,分別以不同濃度ABTS(檸檬酸-檸檬酸鈉溶液)為底物, 測定不同ABTS 濃度下漆酶的酶活力,Km和Vmax用GraphPad Prism5 擬合得到; 分別測定酶液在50、60、70 ℃保溫0~220 min 殘留酶活,計算t1/2。
2 結果與討論
2.1 共表達質粒的構建
按照圖1 構建各共表達質粒, 以1.2.1 所述方法PCR 擴增這6 種分子伴侶基因片段,得到與理論值大小一致的條帶, 見圖2 (a)。 將各擴增基因的PCR 產物回收后,以表1 所列的相應酶切位點雙酶切,pGAPZB 用相同酶切位點雙酶切后連接、 轉化,提取重組質粒進行雙酶切鑒定,見圖2(b)。 各重組表達質粒的命名見表2。 用于轉化的各表達質粒均測序驗證,測序結果與理論值一致。
2.2 共表達菌株產漆酶驗證
將測序驗證正確的各個共表達質粒分別用Avr II 單酶切線性化后,電擊轉化PP-L 菌株,使用含博萊霉素Zeocin 的YPD 平板篩選后, 挑取A 類菌株使用pGAPZB 通用引物進行菌落PCR 驗證。 將A類菌株的陽性轉化子進行發酵,測定漆酶產量。
為了考察組成型共表達各分子伴侶是否對親本菌株生長產生不利影響,將構建的各共表達菌株在BMMY 培養基上的生長曲線進行測定,結果見圖3。 各共表達菌株的生長與對照菌株(PP-L)沒有顯著差異,說明共表達質粒的整合沒有影響菌株生長。
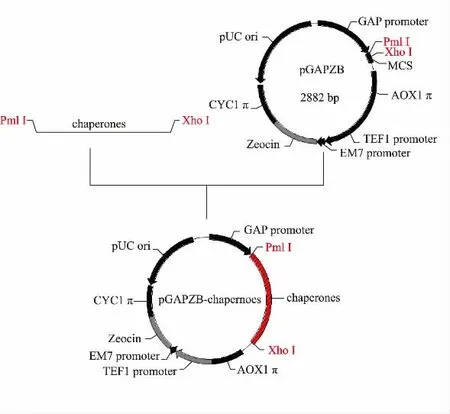
圖1 共表達質粒構建流程圖Fig.1 Construction of co-expression plasmid of chaperones
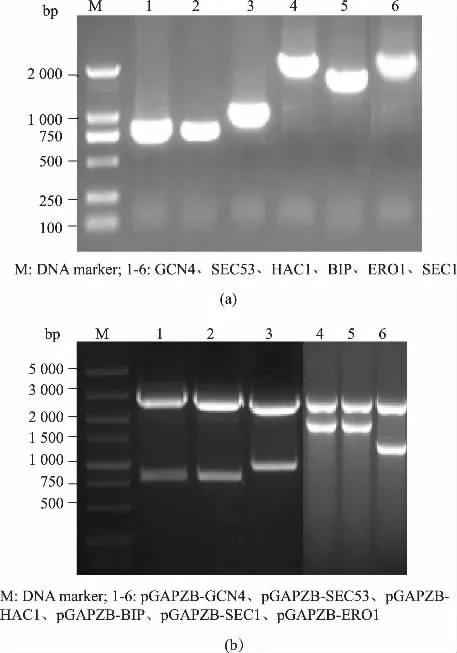
圖2 GS115 來源的分子伴侶編碼基因的克隆和重組共表達質粒的雙酶切鑒定Fig. 2 Cloning of chaperones coding genes from GS115 and identification of recombinant plasmids for chaperones
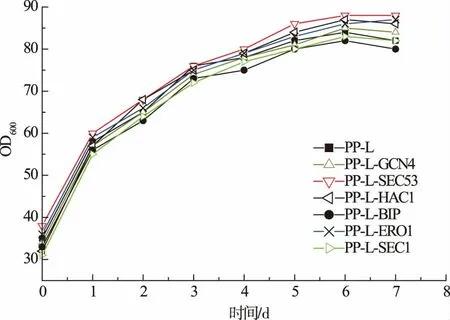
圖3 含分子伴侶菌株的生長曲線Fig. 3 Growth curves of strains with additional cassette of chaperones
篩選表達量提高最明顯的各共表達菌株轉化子作進一步的表達分析。 以表達菌株PP-L 作為對照,在相同的培養條件下培養各共表達菌株,發酵7 d 后離心取上清液,進行SDS-PAGE 分析,見圖4。結果表明,各共表達菌株均成功表達漆酶,與對照菌株相比,表達量有不同程度的提高。取發酵7 d 的發酵液離心取上清液作為粗酶液,測定各菌株的漆酶酶活力,見圖5。各共表達菌株的酶活力有不同程度的提高,PP-L-ERO1 除外。 尤其是PP-L-BIP 的酶活力為對照菌株的4.59 倍。
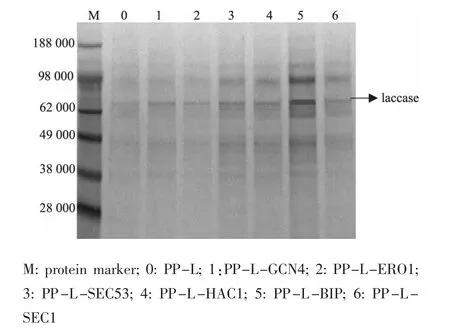
圖4 各共表達菌株發酵上清液SDS-PAGE 電泳分析Fig. 4 SDS-PAGE analysis of additional overexperssion cassette of chaperones
為了考察不同模塊的分子伴侶對外源蛋白質表達的影響,選取上述各模塊中效果好的A 類菌株進行不同模塊間的組合共表達,即對表2 中的6 種B 類菌株進行發酵。

圖5 搖瓶發酵各共表達菌株的相對酶活Fig. 5 Effects of co-expression of chaperones on the laccase in shake flasks
如圖6 所示,組合共表達菌株的產量基本都有不同程度的提高(6%~53%),部分組合共表達菌株較單個共表達菌株胞外酶活下降, 如P4、P2 下降26%。

圖6 不同共表達基因組合優化對異源表達漆酶的影響Fig. 6 Optimization of different co-expression chaperones on heterologous protein production of laccase in P.pastoris
2.3 漆酶的純化及酶學性質測定
按照1.2.7 所述方法對漆酶進行純化, 在20%梯度洗脫時漆酶被洗脫出來。 SDS-PAGE 純化條帶單一,見圖7。 用Bradford 測定蛋白質質量濃度,然后計算比酶活并測定最適溫度、Km、kcat、溫度穩定性(50、60、70 ℃),見表3。
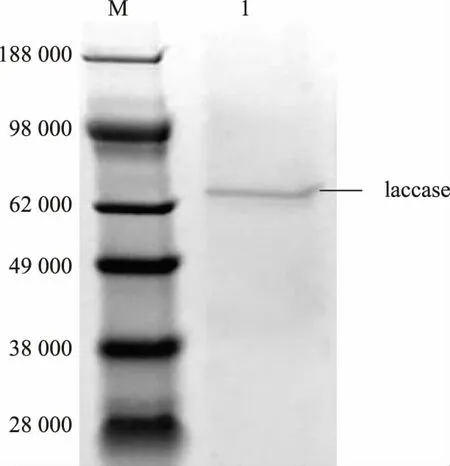
圖7 純化的漆酶的SDS-PAGE 蛋白質電泳分析Fig. 7 SDS-PAGE of purified laccase
2.4 共表達分子伴侶影響漆酶蛋白活力機制解析
外源蛋白質的分泌表達需要多個環節調控,在內質網(ER)中蛋白質折疊成天然構象后被初步修飾, 轉運到高爾基體中作進一步糖基化等修飾,經囊泡運輸等環節最終分泌到胞外,錯誤折疊或未折疊的蛋白質則被降解。 傳統提高酶活的方法大都集中在發酵條件的優化、啟動子、信號肽、密碼子優化等方法上。 作者首次通過過表達不同功能模塊的分子伴侶來提高漆酶的產量,最終得到一株較出發菌株漆酶酶活力提高602%的菌株。 這是因為初生肽鏈結合在ER 中的BIP 分子伴侶后穩定性增強,折疊效率提高[20];大量未折疊或錯誤折疊蛋白質會使細胞產生未折疊蛋白質響應 (UPR),HAC1 通過過表達其控制的ERO1、SEC1 等分子伴侶以緩解代謝壓力,調控UPR 信號[21],促進蛋白質折疊效率。 上述結果說明漆酶在P. pastoris中的折疊能力和未折疊蛋白質引起的脅迫壓力是限制漆酶高效表達的關鍵因素。

表3 漆酶的動力學特征Table 3 Kinetic proerties of laccase
3 結 語
關于漆酶的異源表達已有大量研究報道,然而從細胞層面對菌株改造鮮有報道。 本研究第一次通過共表達分子伴侶提高漆酶在P. pastoris中的分泌表達。 結果顯示, 過表達酵母中蛋白質折疊(BIP、ERO1)、 運輸 (SEC53、SEC1)、 脅迫應激(HAC1、GCN4)通路中的相關分子伴侶,與PP-L(胞外活力為555 U/L) 相比, 胞外漆酶活力提高18%-359%(ERO1 除外),其中共表達BIP 酶活力提高了359%,250 mL 搖瓶發酵使得胞外酶活達2 547 U/L; 接著組合共表達不同模塊中效果較好的共表達元件,漆酶產量進一步提高6%-53%,重組菌P1(同時共表達BIP 與HAC1) 較PP-L 胞外漆酶酶活力提高602%,250 mL 搖瓶發酵胞外酶活力最高達3 896 U/L。本研究首次通過過表達不同功能模塊的分子伴侶來提高漆酶的產量,研究結果表明,這一措施有顯著效果,這一舉措對促進漆酶的產業化進程提供了新的思路。

