SRT1720鞘內給藥對乳腺癌骨轉移大鼠疼痛的影響及其機制
郝苗苗,余良主,秦方,謝敏,朱海麗
(湖北科技學院藥學院,湖北咸寧437100)
病理性疼痛是一種慢性疾病,其臨床表現為痛覺過敏、自發性疼痛以及痛覺超敏等[1],嚴重影響患者生活質量,甚至可導致患者喪失生活自理能力。腫瘤細胞可激活外周傷害性感受器,并將疼痛信號上行傳導至脊髓和脊髓上中樞,導致膠質細胞活化、內源性阿片系統功能抑制、神經元活化、突觸重構等,致使中樞敏化,從而產生病理性疼痛[2]。SRT1720屬于喹喔啉甲酰胺鹽酸鹽,分子式為C25H23N7OS,相對分子質量為506.02,是一種選擇性人源沉默信息調節因子2同源物1(SIRT1)激活劑,可通過氨基末端催化區的變構位點結合到SIRT1上,從而發揮作用[3]。2018年6~10月,本研究觀察了SRT1720鞘內給藥對乳腺癌骨轉移大鼠疼痛的影響,并探討其相關機制,以期為慢性病理性疼痛的機制研究及小分子鎮痛藥物開發提供依據。
1 材料與方法
1.1 材料 動物:雌性SD大鼠18只購于湖北省實驗動物中心,體質量160~200 g,6~8周齡。細胞:大鼠乳腺癌MRMT-1細胞購自廣州吉妮歐生物科技有限公司。主要試劑:二甲基亞砜(DMSO)、SRT1720、蛋白酶抑制劑cocktail均購自美國Sigma公司,加強型RIPA lysis buffer、SDS-PAGE凝膠快速配制試劑盒、BCA蛋白濃度測定試劑盒、HRP標記山羊抗兔lgG(H+L,A0208)均購自上海碧云天生物技術有限公司,RPMI1640培養基、胰蛋白酶、青霉素+鏈霉素混合液均購自美國HyClone公司,胎牛血清購自美國Gibco公司,anti-SIRT1(A0127)、anti-rabbit-β-actin(A1978)均購自中國ABclonal公司,anti-rabbit-pSer47-SIRT1(PA5-17391)購自美國Thermo Fisher公司。
1.2 模型建立及分組處理 將18只雌性SD大鼠適應性喂養1周,隨機分為假手術組、模型組和SRT1720組,每組6只。模型組和SRT1720組均建立乳腺癌骨轉移疼痛模型,方法如下[4]:將大鼠乳腺癌MRMT-1細胞置于含10% FBS、1% L-谷氨酰胺、2% 青霉素+鏈霉素的RPMI1640培養基中進行培養,收集細胞并重懸于HBSS緩沖液。模型組和SRT1720組采用戊巴比妥鈉(50 mg/kg)腹膜麻醉,剃毛消毒;脛骨上半部分開口,微量注射器將10 μL MRMT-1細胞懸液(含3×105個細胞)注射到左側脛骨髓腔內,骨蠟封口。假手術組注射相同體積HBSS緩沖液。將SRT1720溶解在DMSO中,使用前用生理鹽水按體積比1∶1進行稀釋,調整濃度為20 mmol/L。建模12 d后,SRT1720組剃除注射部位毛發并進行注射部位皮膚表面消毒,用無菌微量注射器于L5和L6脊椎棘突間隙垂直進針,當出現空洞感時證明注射器已進入蛛網膜下腔,將注射器由垂直緩慢傾斜至45°;根據體質量單次注射SRT1720 1.0 mg/kg,注射完畢后緩慢取出微量注射器,輕輕按壓注射部位1~2 min[5]。模型組與假手術組注射相同體積DMSO+生理鹽水(體積比為1∶1)。
1.3 疼痛情況觀察 采用50%縮足閾值(PWT)評價。各組給藥后0、1、3、5、7、24 h,根據up-down法檢測50% PWT。方法如下:將動物放置于行為測試籠內,當其安靜狀態時,用Von Frey纖維(0.4~26 g)對大鼠后足底正中部進行垂直剌激,刺激時纖維稍微彎曲2~3 s即可,每相鄰的兩次刺激之間間隔2 min。安靜狀態下動物在受到刺激后出現舔足或者抬足等行為視為陽性反應,反之則為陰性反應。當出現陽性反應時,需用相鄰較低一級力度的Von Frey纖維進行刺激;當出現陰性反應時,需用相鄰較高一級力度的Von Frey纖維進行刺激。在出現與前一次測試反應不一致的測試結果時開始記錄(連同反應出現變化前的一次測試在內),記錄6次數據后結束檢測[6]。50% PWT(g)=(10[Xf+Kδ])/10 000,Xf為本次行為學測試中使用的最后一個Von Frey纖維的階數,K為痛覺閾矯正系數(可查表獲得),δ為相鄰不同纖維刺激之間的差異,即0.224[7]。
1.4 脊髓組織SIRT1、p-SIRT1表達檢測 采用Western blotting法。各組給藥后24 h,給予戊巴比妥鈉50 mg/kg處死,分離整個脊柱。用眼科剪從中間分離脊柱,暴露脊髓,用解剖剪剝離脊膜,得到完整的脊髓,分離腰段脊髓。加入含有酶抑制劑的RIPA裂解液勻漿組織,4 ℃條件下10 000 r/min離心15 min;取上清,加入1/3體積的4×上樣緩沖液,沸水浴加熱10 min,BCA蛋白分析試劑盒檢測上清中的蛋白質濃度。SDS-PAGE分離蛋白質樣品,電轉移到PVDF膜,5%脫脂奶粉在室溫下封閉1 h,TBS-T洗膜5 min×3次。分別加入SIRT1、p-SIRT1一抗(稀釋比例均為1∶1 000),4 ℃條件下孵育過夜。加入二抗,室溫孵育1 h。TBS-T緩沖液洗膜3次,Universal HoodⅡ凝膠成像系統掃描觀察,Image J軟件分析條帶灰度值。以β-actin為內參,以目的蛋白與內參蛋白條帶灰度值的比值計算SIRT1、p-SIRT1蛋白相對表達量,并計算p-SIRT1/SIRT1。
1.5 脊髓組織TNF-α表達檢測 采用ELISA法。取各組大鼠腰段脊髓組織,使用含有蛋白酶抑制劑混合物的PBS緩沖液(pH 7.4)進行勻漿,將不同濃度標準品、樣品各100 μL加入孔中,37 ℃條件下反應90 min。棄液后按每孔100 μL依次加入抗TNF-α抗體工作液,37 ℃條件下反應60 min。洗滌后加入100 μL ABC工作液,37 ℃條件下反應30 min。洗滌后加入90 μL TMB顯色液,37 ℃條件下反應25~30 min,加入TMB終止液。使用酶標儀檢測450 nm波長處的OD值。
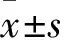
2 結果
2.1 各組不同時間點50% PWT比較 與假手術組比較,模型組給藥后0、1、3、5、7、24 h的50% PWT均降低,SRT1720組給藥后0、24 h的50% PWT均降低(P均<0.05);與模型組同時間點比較,SRT1720組給藥后1、3、5、7、24 h的50% PWT均升高(P均<0.05)。見表1。

表1 各組不同時間點50% PWT比較
注:與假手術組比較,*P<0.05;與模型組比較,#P<0.05。
2.2 各組脊髓組織SIRT1、p-SIRT1、TNF-α表達及p-SIRT1/SIRT1比較 與假手術組比較,模型組脊髓組織SIRT1、p-SIRT表達均降低,TNF-α表達升高(P均<0.05);與模型組比較,SRT1720組脊髓組織SIRT1、p-SIRT1表達及p-SIRT1/SIRT1均升高,TNF-α表達降低(P均<0.05)。見表2。

表2 各組脊髓組織SIRT1、p-SIRT1、TNF-α表達比較
注:與假手術組比較,*P<0.05;與模型組比較,#P<0.05。
3 討論
病理性疼痛會引發外周敏化和中樞敏化,外周敏化的特征為傷害性感受器激活,導致痛覺閾值降低;中樞敏化表現為脊髓膠質細胞激活、神經興奮性和突觸功能增加等[7]。基于乳腺癌的發病率和轉移率均較高[8],本研究將大鼠乳腺癌細胞MRMT-1注入大鼠脛骨骨髓腔內,利用雌性大鼠構建乳腺癌骨轉移疼痛模型。結果顯示,模型組、SRT1720組給藥后0 h的50% PWT均明顯低于假手術組,表明建模成功;模型組給藥后1、3、5、7、24 h的50% PWT均低于假手術組,表明乳腺癌骨轉移大鼠的機械痛敏增加;SRT1720組給藥后1、3、5、7、24 h的50% PWT均高于模型組,表明SRT1720鞘內給藥可降低乳腺癌骨轉移大鼠的機械痛敏、減輕其疼痛。
SIRT1是一種NAD+依賴型的去乙酰化酶,其激動劑可明顯改善鼠類痛覺行為,而SIRT1沉默可逆轉這種鎮痛效果[9,10]。SIRT1能夠催化組蛋白底物和非組蛋白底物的乙酰賴氨酸,并進行去乙酰化反應,其中乙酰賴氨酸修飾指將乙酰基添加到目標蛋白內部賴氨酸殘基的ε-NH3上;賴氨酸去乙酰化酶將賴氨酸上的乙酰基團移除,使蛋白質發生去乙酰化修飾[11]。SIRT1通過其去乙酰化酶活性在染色質重塑、基因調控、代謝、癌癥等相關疾病發生及延緩衰老等方面發揮重要作用[12]。SIRT1-Ser47是SIRT1酶活的活化位點,該位點的磷酸化水平表示SIRT1酶活,其磷酸化水平上調表明SIRT1活性升高,并可激活SIRT1靶基因表達[13]。本研究以p-SIRT1/SIRT1表示SIRT1的激活程度,即活化的SIRT1在總SIRT1中所占的比例。結果顯示,模型組脊髓組織SIRT1、p-SIRT1蛋白相對表達量均低于假手術組,表明其SIRT1表達和活性均下降;SRT1720組脊髓組織SIRT1、p-SIRT1蛋白相對表達量均高于模型組,表明SRT1720鞘內給藥可顯著激活SIRT1活性。
SIRT1可通過多種途徑參與痛覺的調控。SIRT1可調控NF-κB p65亞單位轉錄后的乙酰化修飾水平,上調NF-κB活性,影響炎癥反應的發生[14]。在神經病理性疼痛模型大鼠中,脊髓SIRT1可下調代謝性谷氨酸受體(mGluR1/5)表達,影響膜受體及離子通道功能,參與突觸可塑性并影響突觸傳遞效能[15]。在嗎啡耐受痛覺模型大鼠中,激活SIRT1可逆轉已上調的NMDA受體(NR1和NR2B)表達,抑制突觸后信號傳導及炎癥反應[16]。在乳腺癌骨轉移疼痛模型大鼠背根神經節中,SIRT1通過細胞自噬途徑調節酸離子通道表達,抑制H+介導的疼痛信號[3]。在糖尿病引發神經痛模型中,激活SIRT1可降低突觸結構相關蛋白突觸后致密體蛋白95和生長相關蛋白43表達,抑制已增強的結構突觸可塑性[17]。
在中樞神經系統中,星形膠質細胞在結構上與突觸密切相關,有助于神經元回路建立和重組、神經元活動調節和突觸結構維持[18]。星形膠質細胞在各種疼痛相關的損傷狀態下被激活,并且可持續很長時間[19]。活化的星形膠質細胞可釋放多種炎癥介質如TNF-α,以增強和延長持續性疼痛[20]。本研究結果顯示,模型組脊髓組織TNF-α表達均高于假手術組和SRT1720組,而假手術組和SRT1720組脊髓組織TNF-α表達無明顯差異;這表明TNF-α參與了乳腺癌骨轉移大鼠的疼痛過程,而SRT1720鞘內給藥可顯著減輕TNF-α引起的炎性反應。但是,TNF-α是否為SIRT1參與痛覺的調控途徑之一,以及SIRT1與TNF-α的相互作用仍需進一步探討。
綜上所述,SRT1720鞘內給藥可減輕乳腺癌骨轉移大鼠疼痛,其機制可能與激活脊髓SIRT1活性及抑制炎癥反應有關。

