雷帕霉素對特發性肺間質纖維化小鼠的治療作用及其機制
穆清爽,張繼云,古力鮮·馬合木提,盧雪玲
(新疆醫科大學第二附屬醫院,烏魯木齊830063)
特發性肺間質纖維化(IPF)是一種發生于肺間質、累及肺泡上皮和肺血管的肺部炎癥性疾病,常見于中老年人,臨床表現為肺限制性通氣或換氣功能障礙,可進一步誘發呼吸衰竭。IPF患者的生存時間僅為3~5年,臨床5年生存率不足50%[1]。既往研究認為,IPF發病與肺間質纖維母細胞增生、肌成纖維細胞分化和細胞外基質(ECM)沉積有關[2,3],而mTOR信號通路介導的細胞異常增殖和下游相關p70S6、4EBP1蛋白異常激活被證實與上述病理變化有關[4]。雷帕霉素(RAPA)是一種mTOR信號通路抑制劑,臨床常用于器官移植后的免疫抑制治療,關于其抗纖維化作用目前報道不多。2018年10月~2019年6月,本研究觀察了RAPA對IPF小鼠的治療作用及其對mTOR信號通路的影響。現報告如下。
1 材料與方法
1.1 材料 45只BALB/c雄性小鼠,6~8月齡,體質量(21.0±2.0)g,購于新疆醫科大學實驗動物中心。注射用鹽酸博來霉素溶液(15 mg/支)購于日本化藥株式會社,RAPA(5 mg/支)購于江蘇碧云天生物技術研究所;羥脯氨酸(HYP)ELISA試劑盒購于美國MyBioSource公司,蛋白磷酸酶抑制劑(PMSF)、RIPA裂解液、BCA蛋白定量試劑盒購于上海天能生物科技有限公司,TRIzol試劑、反轉錄及SYBR Green試劑盒均購于日本TaKaRa公司,抗體纖溶酶原激活物抑制物1(PAI-1,ab82218)、轉化生長因子β1(TGF-β1,ab64715)、mTOR(ab2732)、Ⅱ型微管相關蛋白1輕鏈3(LC3-Ⅱ,ab48394)、磷酸化蛋白激酶B(p-Akt,ab38449)、磷酸化S6核糖體蛋白(p-S6,109393)、結締組織生長因子(CTGF,ab6992)以及HRP標記的多聚抗鼠IgG(ab6728)均購于美國Abcam公司。
1.2 建模與分組處理 45只BALB/c雄性小鼠適應性喂養1周,隨機分為模型組、治療組及對照組,每組15只。模型組、治療組參照文獻[5]方法建立IPF模型,即采用異氟烷進行麻醉,仰臥位固定后縱向切皮分離氣管,向氣管內滴注0.2 mL博來霉素(4 mg/L);對照組向氣管內滴注等量生理鹽水。各組滴注完成后迅速直立旋轉小鼠使藥物分布均勻,縫合皮膚并進行消毒。治療組按照體質量給予2 mg/kg RAPA腹腔注射,1次/d,連續15 d;模型組與對照組給予等量生理鹽水腹腔注射。各組給藥21 d后處死,立即分離肺臟組織,取部分新鮮組織立即用于制備石蠟切片及HYP含量測定,其余組織液氮保存。
1.3 肺組織病理觀察 ①HE染色:取各組肺組織石蠟切片,常規進行HE染色,PBS沖洗,經梯度乙醇脫水、二甲苯透明,中性樹膠封片。于200倍光學顯微鏡下觀察肺泡出血程度、肺泡腔或血管壁中性粒細胞浸潤程度、肺泡壁厚度及是否形成透明膜等4個方面,對各組肺組織病理改變及炎癥情況進行評分,分數越高表示小鼠病理變化越嚴重、炎癥浸潤越明顯。②Masson染色:取各組肺組織石蠟切片,梯度水化,先后用Regaud蘇木精和Masson麗春紅酸性染液染色5 min;PBS沖洗后吸干水分,2%冰醋酸浸潤洗滌1次,1%磷鉬酸水溶液浸潤3 min;苯胺藍復染5 min,行Masson染色。經梯度乙醇脫水、二甲苯透明,中性樹膠封片。于200倍光學顯微鏡下觀察肺組織纖維化程度,Masson染色可將膠原纖維染成藍色、肌纖維染成紅色;參照文獻[14]方法,每個樣本取5個視野進行纖維化評分,取平均值。
1.4 肺組織HYP含量檢測 采用ELISA法。各組取10 mg新鮮肺組織,干燥后攪碎并充分混合,根據堿水解法采用110 ℃、6 mol/L HCl溶液懸浮水解組織樣品,加入等量6 mol/L NaOH溶液高壓堿式消化16 h。參照ELISA檢測試劑盒加入二甲氨基苯甲醛與吡咯環反應,測定生成的紅色化合物在558 nm波長處的光密度值,以此計算肺組織HYP含量。
1.5 肺組織TGF-β1、PAI-1蛋白表達檢測 采用免疫組化法。取各組肺組織石蠟切片,脫蠟后經常規梯度水化及抗原修復,采用30% H2O2溶液室溫孵育30 min,5% BSA室溫封閉1 h。分別加入TGF-β1和PAI-1一抗(1∶500),4 ℃孵育8 h或至過夜;PBS沖洗3次,滴加HRP標記的二抗(1∶1 000),37 ℃孵育1 h。PBS沖洗3次,加入DAB顯色液室溫顯色5 min后沖凈染色液,二甲苯透明,中性樹脂封片。于200倍光學顯微鏡下觀察,TGF-β1、PAI-1陽性細胞呈棕褐色深染,記錄同一視野下陽性染色細胞數及總細胞數,計算TGF-β1、PAI-1陽性表達率。
1.6 肺組織膠原蛋白1(Collagen1)、Collagen3及CTGF mRNA表達檢測 采用實時熒光定量PCR法。取各組液氮保存的肺組織,充分研磨成粉末后加入TRIzol試劑,提取總RNA;微量核酸定量儀定量檢測各樣本RNA濃度及純度合格后,參照反轉錄試劑盒逆轉錄RNA合成cDNA。參照SYBR Green試劑盒說明書進行實時熒光定量PCR檢測。以GAPDH為內參,采用2-ΔΔCt法計算Collagen1、Collagen3、CTGF mRNA相對表達量。
1.7 肺組織mTOR、LC3-Ⅱ、p-S6、p-Akt蛋白表達檢測 采用Western blotting法。取各組液氮凍存的肺組織50 mg,加入5倍體積預冷的RIPA裂解液及1%的PMSF,組織勻漿,取上清用于BCA蛋白定量。調節樣品濃度一致,加入等體積SDS上樣緩沖液,100 ℃變性蛋白樣品5 min;各樣品取30 g蛋白加入12% SDS-PAGE凝膠上樣孔,120 V恒壓電泳90 min;轉移蛋白條帶至活化后的PVDF膜,固定轉膜夾,0.2 A恒流轉膜75 min。采用5% BSA室溫封閉后行常規抗體孵育,凝膠成像儀曝光成像,Image J軟件分析蛋白條帶灰度值。以GAPDH為內參蛋白,以目的條帶與內參條帶灰度值的比值計算各蛋白相對表達量。
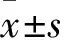
2 結果
2.1 各組肺組織病理情況比較 ①HE染色結果:對照組肺泡結構清晰,未見異常病變;模型組肺泡腔消失,組織間隙可見大量炎癥細胞浸潤,成纖維細胞增多;治療組組織病變較模型組減輕,肺泡腔形態基本恢復,肺泡內炎癥浸潤減輕;模型組、治療組和對照組炎癥評分分別為(2.51±0.40)、(1.61±0.36)、(1.15±0.27)分,組間兩兩比較P均<0.05。②Masson染色結果:對照組無明顯藍染,模型組可見清晰的藍染膠原纖維積聚并伴隨肺泡腔皺縮,治療組氣道周圍少許索條狀藍染;模型組、治療組和對照組纖維化評分分別為(3.08±0.54)、(2.31±0.33)、(1.26±0.31)分,組間兩兩比較P均<0.05。
2.2 各組肺組織HYP含量及TGF-β1、PAI-1蛋白陽性表達率比較 見表1。
2.3 各組肺組織Collagen1、Collagen3、CTGF mRNA相對表達量比較 見表2。

表1 各組肺組織HYP含量及TGF-β1、PAI-1蛋白陽性表達率比較
注:與對照組比較,*P<0.05;與治療組比較,#P<0.05。

表2 各組肺組織Collagen1、Collagen3、CTGF mRNA相對表達量比較
注:與對照組比較,*P<0.05;與治療組比較,#P<0.05。
2.4 各組肺組織mTOR、LC3-Ⅱ、p-S6、p-Akt蛋白相對表達量比較 見表3。

表3 各組肺組織mTOR、LC3-Ⅱ、p-S6、p-Akt蛋白相對表達量比較
注:與對照組比較,*P<0.05;與治療組比較,#P<0.05。
3 討論
mTOR屬于磷酸肌醇激酶相關蛋白激酶家族,是一種廣泛存在于人體和哺乳動物中的不典型絲/蘇氨酸蛋白激酶[6],以mTOR complex 1(mTORC1)和mTOR complex 2(mTORC2)復合物形式存在,而在與RAPA相關mTOR信號通路的研究中發現,只有mTORC1對RAPA刺激敏感[7,8]。有研究表明,RAPA可分別通過介導IGF/PI3K/Akt/mTOR、TSC1-Tsc2/Rheb/mTOR或AMPK/TSC/mTOR信號通路及其下游蛋白磷酸化水平,參與多種疾病發生過程中的蛋白質合成、細胞自噬或線粒體代謝等生物學過程[9,10]。但是,關于RAPA對IPF的治療作用及其機制相關研究較少。
本研究首先通過組織切片染色觀察各組炎癥及纖維化等病理變化,結果可見模型組纖維化程度明顯,其炎癥及纖維化評分較對照組顯著升高,證實IPF小鼠模型建造成功;治療組給予RAPA連續治療15 d后,其肺組織在組織結構完整性、肺泡間質炎性細胞浸潤及組織膠原堆積等方面均存在改善,說明RAPA對博來霉素誘導的IPF小鼠具有一定治療作用。Masson染色結果表明,治療組較模型組肺組織膠原纖維沉積明顯減少,纖維化評分降低。HYP作為機體膠原蛋白的主要成分之一,可作為衡量不同組織間膠原蛋白沉積的重要指標。肺組織膠原蛋白沉積及纖維結締組織生成是IPF發生、發展的重要標志。本研究結果顯示,治療組肺組織HYP含量及Collagen 1、Collagen 3、CTGF mRNA表達均明顯低于模型組,提示RAPA能夠通過減少IPF小鼠肺組織膠原蛋白沉積和結締組織生成而逆轉IPF進程。
以往研究顯示,CTGF mRNA轉錄受上游TGF-β1調控,TGF-β1可結合CTGF啟動子區順式結合元件,招募Smad結合元件共同誘導CTGF表達,同時TGF-β1可參與以膠原為主的ECM生成[11~13]。因此,TGF-β1與CTGF可共同誘導IPF的發生。TGF-β1、PAI-1表達與肺纖維化程度呈正相關,并且二者協同參與調控纖維蛋白溶解系統及體內成纖維細胞的表型轉化[12]。PAI-1參與膠原重塑依賴性纖溶酶/基質金屬蛋白酶10(MMP-10)/MMP-1軸,或體內microRNA表達調控相關Collagen1/3的合成[13]。本研究結果顯示,模型組、治療組和對照組TGF-β1、PAI-1陽性表達率均依次降低;說明RAPA可能通過抑制TGF-β1、PAI-1表達,調控下游Collagen1、Collagen3、CTGF表達,進而發揮促進纖溶酶原激活、抑制成纖維細胞過度生長及體內ECM沉積的作用。
在原代肺成纖維細胞纖維化模型中,TGF-β1可促進mTORC1活化和Collagen3、纖維黏連蛋白(FN)表達[14],而mTOR的異常表達可間接反映肺纖維化進程,因此本研究通過檢測mTOR及相關蛋白表達變化以驗證RAPA對IPF小鼠的治療作用。結果表明,模型組肺組織mTOR與p-S6蛋白表達水平較對照組顯著增加,而治療組二者表達水平較模型組顯著降低,但仍與對照組存在顯著差異。有研究報道,RAPA能夠通過調控相關細胞因子表達而激活組織及細胞自噬活性,在這類級聯反應中,各類細胞因子可通過激活PI3K而促進下游Akt的磷酸化,進而使得mTOR受到Tsc1/Tsc2的激活而活化[15]。LC3-Ⅱ介導的自噬活性下降可促進α-平滑肌肌動蛋白和FN表達,進而加劇ECM沉積,促進IPF進程[16]。本研究結果顯示,治療組肺組織p-Akt、LC3-Ⅱ蛋白表達水平較模型組顯著升高,提示RAPA可逆轉博來霉素誘導的小鼠肺組織自噬缺陷。綜合上述mTOR表達結果,表明RAPA可靶向抑制mTOR信號通路,從而發揮對PI3K/Akt/mTOR通路相關蛋白因子的表達調控作用,減輕IPF小鼠的炎癥及纖維化程度。
綜上所述,RAPA可減輕IPF小鼠的炎癥及纖維化程度,其機制可能與抑制TGF-β1及mTOR表達進而調控PI3K/Akt/mTOR信號通路級聯反應有關。

