瑞舒伐他汀鈣片體內外一致性評價研究*
李 攀,薛敏華,唐 婉,石蓓佳,杭太俊,陸益紅**
1 中國藥科大學藥物分析系,南京 210009;2 江蘇省食品藥品監督檢驗研究院,南京 210019;3 徐州醫科大學藥物分析教研室,徐州 221004
開展仿制藥一致性評價,保障仿制藥在質量和療效上與原研藥一致,在臨床上實現與原研藥相互替代,不僅可以節約醫療費用,也有助于提升我國仿制藥質量和制藥行業的整體發展水平,保證公眾用藥安全有效。仿制藥能替代原研藥在臨床上使用的前提,是仿制制劑與指定的參比制劑藥學等效(Pharmaceutical equivalence,PE)和生物等效(bioequivalence,BE),以此證明仿制制劑具有與參比制劑相同的質量和療效。對于固體口服制劑PE 的重要組成部分是考察仿制藥和原研藥在多種不同pH溶出介質中的溶出行為的相似性,這是對口服固體制劑內在質量評價的最主要方法。然而,體外溶出曲線相似性評價僅模擬表征了藥物在胃腸道中的釋放和溶解過程,雖然可以提高仿制藥生物等效的可能性,卻難以準確地表征藥物在體內的真實過程,因此,需要進行BE 研究以確保仿制藥與原研藥療效的一致性。
軟件模擬被廣泛地應用于藥物體內藥代動力學的研究[1],它可以為體內外相關性研究、BE 試驗的設計提供幫助。本文采用的GastroPlusTM軟件內置了獨有的高級房室吸收與轉運模型(advanced compartmental absorption and transit model,ACAT),它按生理學特征將胃腸道分為9 個房室,考慮了藥物在胃腸道中的6 種狀態,可以構建藥物特異性胃腸道吸收模型[2,3]。其基于生理學的藥代動力學(physiologically based pharmacokinetic,PBPK)模型考慮了解剖學和生理學以及藥物和制劑的物理化學性質,描述了藥物吸收、分布、代謝和排泄的動力學過程[4,5]。將藥物的理化性質參數輸入到ACAT 模型用于表征藥物的胃腸道吸收和轉運,建立藥物的PBPK 模型用于表征藥物的處置過程,將藥物的體外溶出曲線導入到軟件中,以評估制劑的溶出行為對藥物體內過程的影響;因此,結合體外溶出曲線相似性評價,同時采用計算機軟件模擬技術的建模,可以模擬藥物在體內的過程[6]。
瑞舒伐他汀鈣(Rosuvastatin Calcium)為3-羥基-3-甲基戊二酰輔酶A(HMG-CoA)還原酶抑制劑,由日本鹽野義制藥株式會社于20 世紀80 年代末合成,后由英國阿斯利康公司開發研制,臨床用于調節血脂。國內已有多個廠家對瑞舒伐他汀鈣片進行仿制[7-9]。從體外溶出曲線研究和體內生物等效性評價兩個方面系統評價國產瑞舒伐他汀鈣片,關于這方面的研究,尚未見文獻報道。
本研究結合瑞舒伐他汀鈣的BCS 特性,使用體外溶出曲線和GastroplusTM評估瑞舒伐他汀鈣片國產仿制制劑與參比制劑的生物等效性,并與臨床試驗結果對比,驗證模擬BE 的可行性,以及軟件評估的可靠性,為仿制藥的一致性評價提供參考。
1 儀器與藥品、試劑
1.1 儀器
Sciex API 5000 三重四級桿質譜儀(配有ESI源及Analyst 定量處理軟件,美國Sciex 公司);島津LC20 高相液相色譜儀(SPD-M20A,日本Shimadzu公司);AT7 smart 自動溶出儀(瑞士Sotax 公司);ZKT-18F 真空脫氣機(天津天大天發科技有限公司);XSE205 十萬分之一電子天平(瑞士梅特勒-托利多公司);Seven Excellence 多參數測定儀(瑞士梅特勒-托利多公司);0.45 μm 針頭濾膜(PES 和尼龍,上海安譜實驗科技股份有限公司)。
GastroPlusTM(版本9.5.0004,Simulations Plus,Inc.,Lancaster,CA,USA)。
1.2 藥品與試劑
參比制劑(R)瑞舒伐他汀鈣片(規格10 mg,批號131343、131347、131358,AstraZeneca UK Limited 公司);仿制制劑(T)(規格10 mg,批號171701、170702、170703,A 制藥公司);瑞舒伐他汀鈣對照品(純度97.6%,批號101028-201202,中國食品藥品檢定研究院);瑞舒伐他汀鈣-d6(純度98.65%,批號2-WEN-131-1,加拿大TRC 公司)。
鹽酸、氫氧化鈉、檸檬酸三鈉二水合物、檸檬酸一水合物、乙酸鈉、冰醋酸、磷酸均為分析純(國藥集團化學試劑有限公司);乙腈、甲醇(色譜純,德國Merck KGaA 公司);甲酸(色譜純,美國Anaqua Chemical 公司);溶出介質試驗用水:超純水,均采用脫氣裝置經40 ℃脫氣30 min 后立即使用。
2 方法
2.1 體外溶出曲線相似性評價
2.1.1 pH-溶解度曲線的測定 將過量的瑞舒伐他汀鈣分別加入pH 值為1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0 的緩沖液中,在37 ℃振搖24 h,使成飽和溶液,濾過,取續濾液適量,用25%乙腈適宜倍數稀釋后采用HPLC 法[10]測定峰面積,按外標法計算溶液中瑞舒伐他汀的含量,從而確定在不同pH 值緩沖液中瑞舒伐他汀的飽和溶解度。當釋放介質的體積為藥物飽和溶液所需介質體積的至少3 倍量時,認為滿足漏槽條件[11],可作為體外溶出相似性評價的介質。
2.1.2 體外溶出測試 比較進口注冊標準(JX20030283)[12],瑞舒伐他汀鈣片的溶出度檢查項下溶出介質(pH 6.6 枸櫞酸鹽緩沖液)、健康人體胃中生理液pH(0.1 mol·L-1鹽酸溶液)以及“普通口服固體制劑溶出曲線測定與比較指導原則”[10]推薦的溶出介質(pH 4.5)。參照“普通口服固體制劑溶出度試驗技術指導原則”[13],最終選擇0.1 mol·L-1鹽酸(pH 1.0)、pH 4.5 醋酸鹽緩沖液、pH 6.6 枸櫞酸鹽緩沖液作為溶出介質,對兩制劑進行溶出曲線研究。
取仿制制劑(T)和參比制劑(R)各3 批(n=12),照溶出度與釋放度測定法(《中國藥典》2015 年版通則0931 第二法)分別以3 種介質900 mL 為溶出介質,轉速為50 r·min-1,依法操作,在5、10、20、30、45、60 min 時,分別取樣10 mL 并及時補液。將取出的溶液濾過,取續濾液作為供試品溶液;另精密稱取瑞舒伐他汀鈣對照品適量,加溶出介質并定量稀釋制成每毫升中約含10 μg 的溶液作為對照品溶液,參照瑞舒伐他汀鈣片進口注冊標準(JX20030283)[12]溶出度項下的色譜條件測定,色譜條件為:
色譜柱:Waters X-Bridge C18(4.6 mm×150 mm,3.5 μm);流動相:磷酸-水-乙腈(1∶600∶400);檢測波長:242 nm;柱溫:30 ℃;流速:1.0 mL·min-1;進樣量:10 μL。典型色譜圖如圖1 所示。
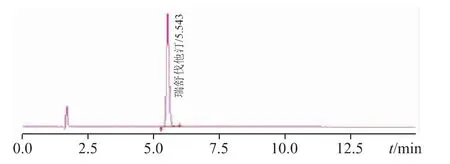
圖1 體外溶出測試典型色譜圖
2.1.3 數據分析 當仿制制劑和參比制劑在15 min時的平均溶出量均不低于85%時,認為兩者的溶出曲線相似;否則,用相似因子(f2)法比較溶出曲線相似性[14]。當f2值不小于50 時,認為兩條溶出曲線相似,否則認為不相似[14,15]。以下等式定義f2:
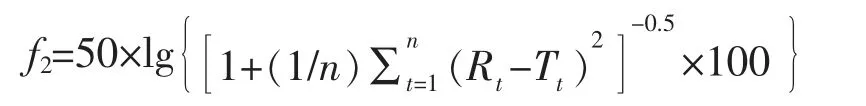
其中Rt和Tt表示在時間點(t)的參比和仿制制劑的平均溶出百分數,n 是比較平均溶出時間點的數量。
2.2 體內藥代動力學研究
2.2.1 研究對象 依據CFDA 最新頒布的“生物等效性指南”對生物等效性試驗入組受試者性別的建議:研究將擬用于兩種性別的人群;且FDA 關于瑞舒伐他汀鈣的Clinical Pharmacology Biopharmaceutics Review 中一則生物等效性試驗所用受試者例數為31 例,另一則為32 例。參考以上情況,試驗擬入組30 例健康受試者,實際入組28 例,男性18例,女性10 例,20~43 周歲,體重不低于50 kg,體重指數(BMI)在19.0~26.0 kg·m-1,無吸煙、嗜酒史,全面體檢各項指標均正常。
受試者試驗開始前3 個月內未參加其它任何藥物臨床試驗,且6 周內未服用任何藥物。受試者本人簽署知情同意書,并經浙江大學醫學院附屬第二醫院人體研究倫理委員會審批同意。
受試者隨機分為2 組,禁食10~12 h 后,空腹口服仿制制劑(批號170701)或參比制劑(批號131343)1 片,用250 mL 溫開水吞服藥物,受試者口服藥物前0 h(服藥前0.5 h 內)和服藥后0.25、0.5、1.0、2.0、3.0、4.0、5.0、6.0、8.0、10.0、12.0、16.0、24.0、36.0、48.0、72.0 h 分別于肘靜脈取血約2.5 mL,分別置于含EDTA-2K 抗凝試管中,試管提前置于冰上預冷。4 ℃、3 000 r·min-1離心10 min。吸取上層血漿,-80 ℃保存,供血藥濃度測定用。
2.2.2 分析方法 以瑞舒伐他汀鈣-d6作為內標,100 μL 血漿樣品經甲醇沉淀蛋白,采用經過驗證的超高效液相色譜-串聯質譜(UPLC-MS/MS)方法檢測血漿樣本中瑞舒伐他汀的濃度。
色譜條件:色譜柱:SunFireTMC18(2.1mm×50mm,3.5 μm);流動相A:0.1%甲酸水溶液,B:0.1%甲酸乙腈溶液[梯度:0~2 min(35%B~70%B);2.05~3.50 min(95%B~95%B);3.55~5 min(35%B~35%B)];流速:0.6 mL·min-1;柱溫:40 ℃;進樣量:10 μL。
質譜條件:采用大氣壓電噴霧離子源(ESI+);正離子模式,選擇多反應離子監測(MRM),用于定量的離子反應為:瑞舒伐他汀選擇性反應監測:m/z 482.2→m/z 258.2,瑞舒伐他汀-d6選擇性反應監測:m/z 488.2→m/z 264.2。
2.2.3 數據統計分析 使用Phoenix WinNonlin Version 7.0 以非房室模型進行PK 分析,藥代動力學參數包括:Cmax、AUC0-t、AUC0-∞、Tmax。使用SAS Version 9.2 對主要藥動學參數Cmax、AUC0-t、AUC0-∞經對數轉換后進行方差分析及雙單側t 檢驗,并計算90%置信區間,考察仿制制劑與參比制劑的生物等效性,如果Cmax、AUC0-t和AUC0-∞的幾何平均比(仿制/參比)的90%置信區間在80.00%~125.00%,則認為兩制劑生物等效[16]。相對生物利用度的計算公式為
(AUC0-t)T 為仿制制劑的AUC0-t,(AUC0-t)R 為參比制劑的AUC0-t。
2.3 群體藥代動力學模擬
利用GastroPlusTM模擬軟件構建虛擬群體(n=28,20~50 歲,健康中國人,男性和女性均50%)模擬單次口服每種瑞舒伐他汀鈣片的體內藥代動力學。模型建立參數見表1。計算每個虛擬受試者的Cmax、Tmax、AUC0-∞和AUC0-t。報告中位數和直接采用5%和95%的結果表示90%的置信區間。
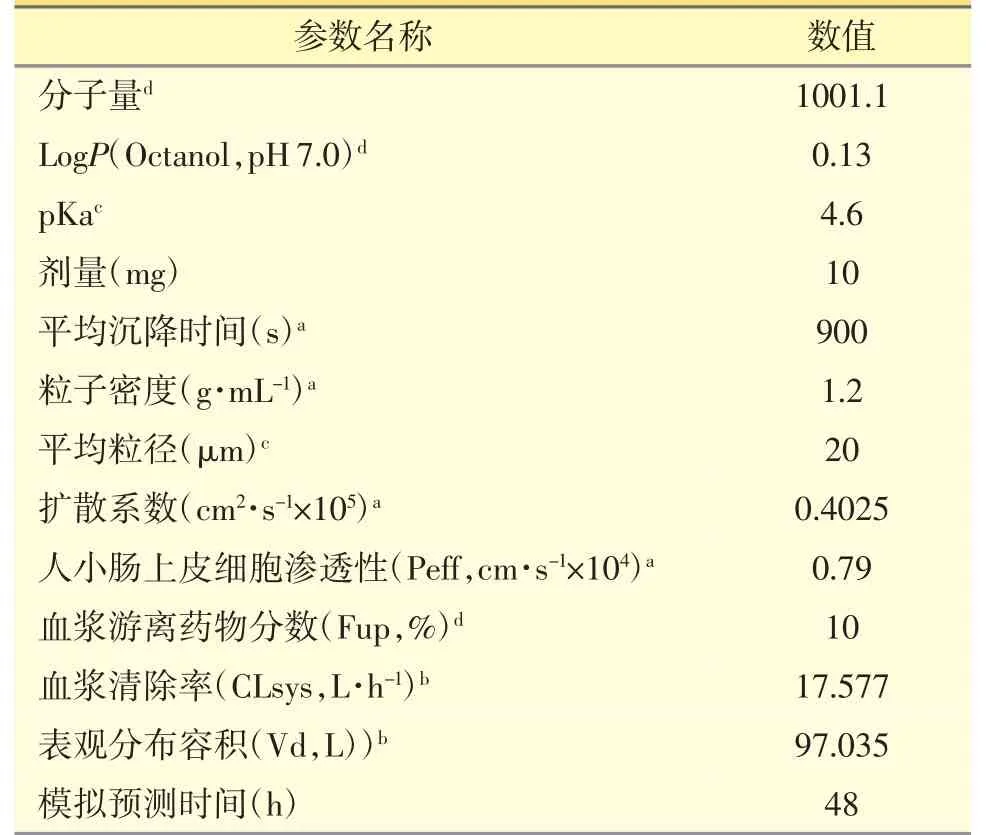
表1 模型建立參數收集
3 結果
3.1 pH-溶解度曲線的測定
瑞舒伐他汀鈣在不同pH 緩沖液中的溶解度曲線見圖2。隨著pH 增加,溶解度先上升后下降。藥物在各種pH 條件下的溶解度均大于0.041 7 mg·mL-1(以瑞舒伐他汀10 mg 計),滿足漏槽條件,各介質均可作為瑞舒伐他汀鈣片的溶出介質。
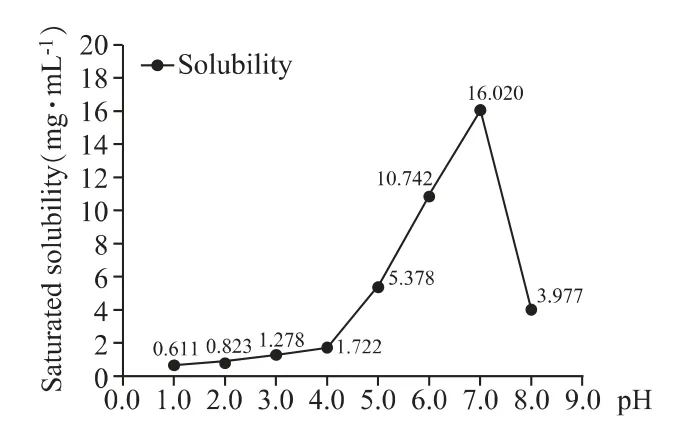
圖2 瑞舒伐他汀鈣在不同pH 緩沖液中的溶解度曲線
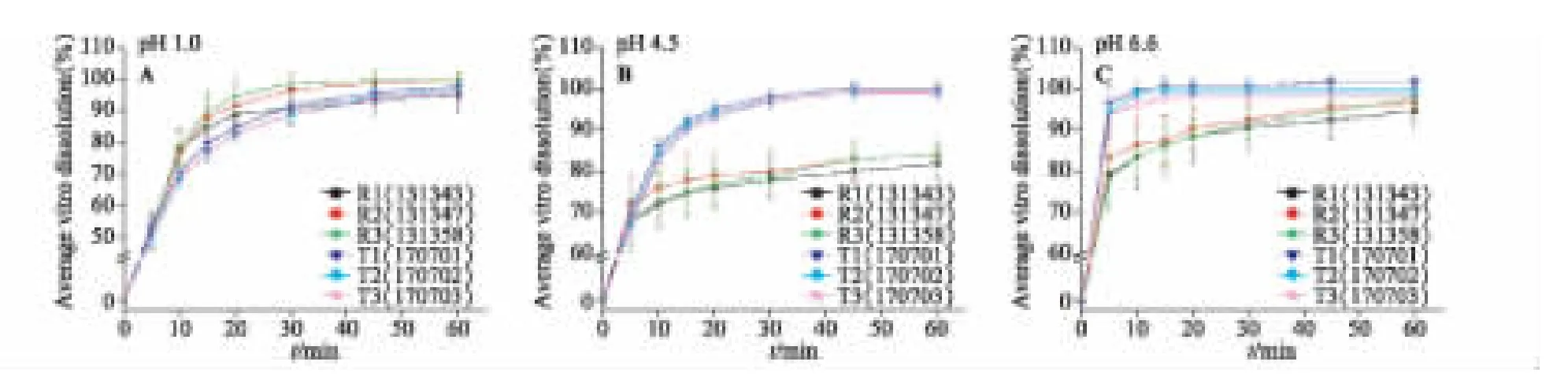
圖3 兩種瑞舒伐他汀鈣片在3 種溶出介質中的溶出曲線
3.2 體外溶出測試
仿制制劑(T)和參比制劑(R)在3 種溶出介質中的溶出曲線如圖3 所示。數據表示為±s(n=12)。
3.2.1 鹽酸(pH 1.0)溶液中的溶出曲線相似性評價3 批參比制劑在15 min 時的平均累積溶出量均大于85%,3 批仿制制劑在15 min 時的平均累積溶出量小于85%(圖3-A),因此計算f2因子評價仿制制劑與參比制劑體外溶出相似性。除仿制品批號170703 的f2因子為49,其他2 個仿制品批號的f2因子均大于50(見表2),認為仿制制劑與參比制劑在該介質中的體外溶出曲線基本相似。
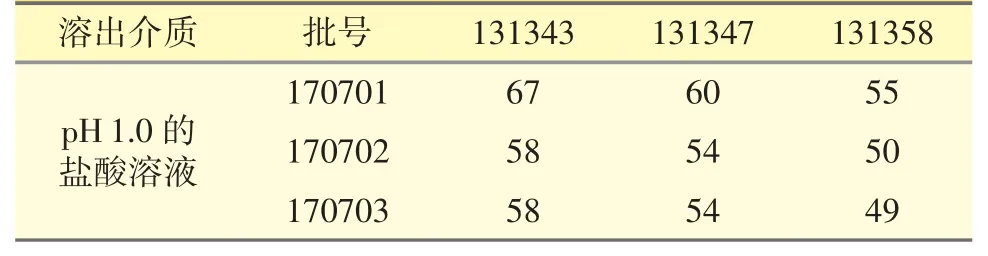
表2 在pH 1.0 溶出介質中的f2因子計算結果統計
3.2.2 醋酸鹽緩沖液(pH 4.5)中的溶出曲線相似性評價 3 批參比制劑在15 min 時的平均累積溶出量均小于85%,仿制制劑均不低于85%(圖3-B)。經計算f2因子均小于50(見表3),說明仿制制劑與參比制劑的體外溶出曲線不相似。
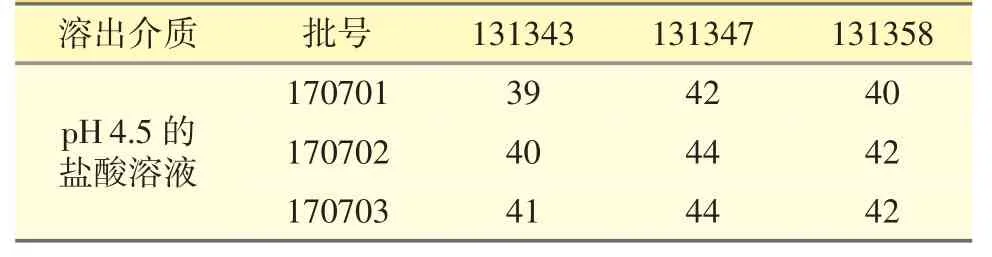
表3 在pH 4.5 的溶出介質中的f2因子計算結果統計
3.2.3 枸櫞酸鹽緩沖液(pH 6.6)中的溶出曲線相似性評價 雖然參比制劑的溶出速率較仿制制劑稍慢,但15 min 幾乎完全溶出(>85%)(見圖3-C)。仿制制劑與參比制劑的體外溶出曲線相似。
3.3 體內藥代動力學研究
28 例健康受試者單次口服瑞舒伐他汀鈣片10 mg,仿制制劑和參比制劑平均血藥濃度-時間曲線見圖4,兩者變化趨勢基本一致。生物等效性分析結果見表4,仿制制劑的相對生物利用度F 為95.65%±17.62%(AUC0-t)。Cmax的幾何均值比的90%CI 為84.09%~104.70%,AUC0-t的幾何均值比的90%CI 為88.32%~103.58%,AUC0-∞的幾何均值比的90%CI 為94.17%~105.28%,均在80%~125%的范圍內,兩制劑無統計學差異,具有生物等效性。
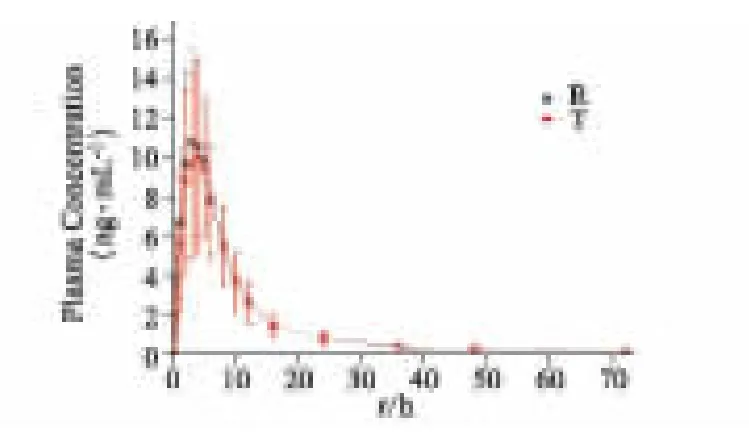
圖4 28 名健康志愿者單次口服瑞舒伐他汀鈣片受試制劑(T)和參比制劑(R)10 mg 后的平均藥物濃度-時間曲線(±s)
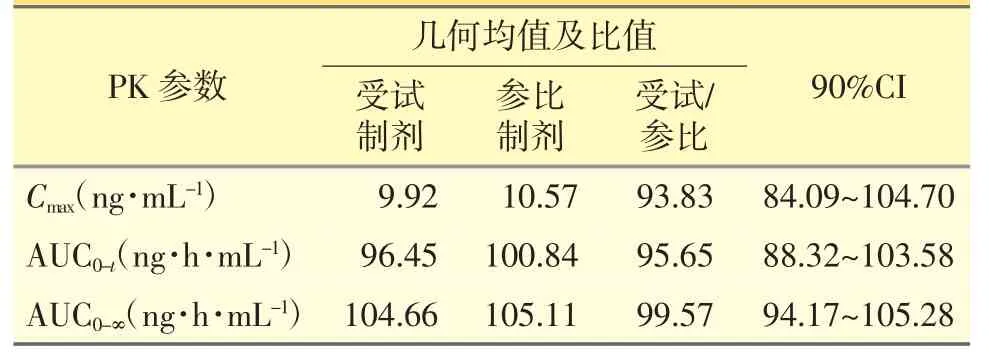
表4 生物等效性研究參數統計
3.4 群體藥代動力學模擬
圖5 顯示了參比制劑和仿制制劑在虛擬的28名健康成年中國人中的群體藥代動力學研究結果,點代表實測的平均血藥濃度,線代表預測的平均血藥濃度。兩制劑藥代動力學參數的預測值和實測值見表5。主要藥代動力學參數Cmax和AUC 的預測誤差(%PE)不大于10%;Tmax的%PE 稍高,但小于20%,且參比制劑說明書報告了單次口服10 mg 瑞舒伐他汀鈣片后Tmax的中位值為2.5~5 h,模擬值分別為3.24(R)和3.25(T),仍可接受[17]。
綜上,認為GastroPlusTM建立的群體藥代動力學模型較為合理的描述了單次口服瑞舒伐他汀鈣片的藥代動力學特征。虛擬BE 結果顯示Cmax的幾何均值比(T/R)的90%CI 為86.44%~112.44%,AUC0-t的幾何均值比的90%CI 為91.36%~118.80%,AUC0-∞的幾何均值比的90%CI 為91.35%~118.80%,均在80%~125%的范圍內,兩制劑具有生物等效性。
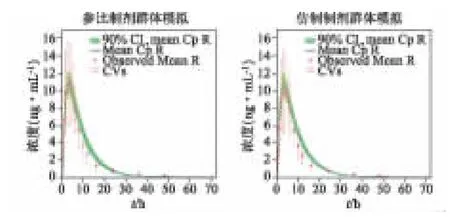
圖5 參比制劑(R)和仿制制劑(T)虛擬模擬28 個健康成年中國人PK 曲線
表5 口服不同瑞舒伐他汀鈣片藥代動力學參數結果(±s)
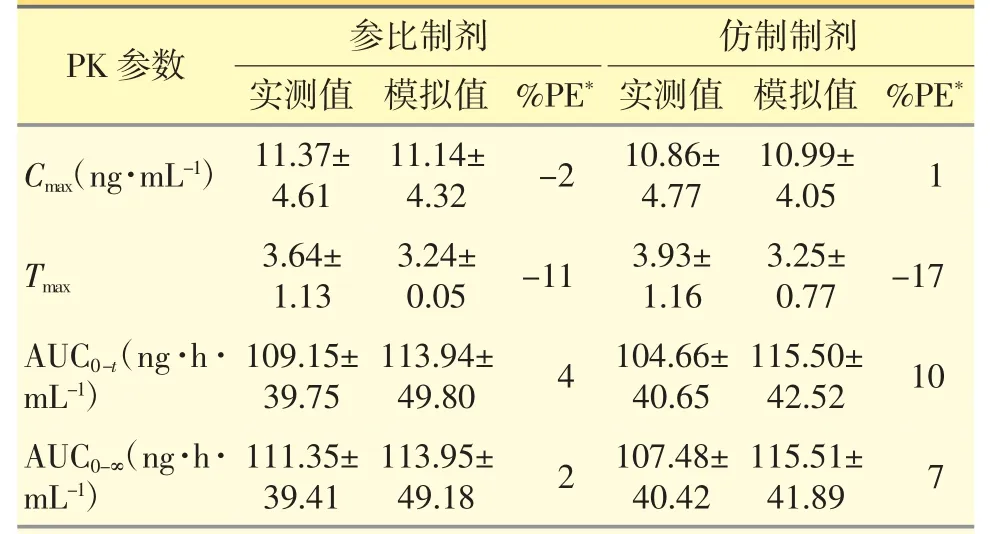
表5 口服不同瑞舒伐他汀鈣片藥代動力學參數結果(±s)
*%PE=(模擬值-實測值)/實測值×100%
4 討論
瑞舒伐他汀鈣在pH 1.0 鹽酸溶液中不穩定,降解產生雜質B、D 及少量未知雜質,在此介質中的溶出曲線,均以主峰和酸降解產物的峰面積和計算[18]。經試驗考察,雜質B 的相對校正因子為1.0,雜質D為0.9,在0.9~1.1 范圍內,且仿制藥和參比制劑降解程度差異不大(見表6)。因此,采用上述文獻方法計算瑞舒伐他汀鈣在pH 1.0 鹽酸溶液中的溶出曲線,更科學合理。在pH 4.5 醋酸鹽緩沖液中,仿制制劑與參比制劑的溶出曲線不相似,原因可能是參比制劑中含有堿性輔料磷酸鈣,對制劑溶出有所影響。虛擬BE 試驗和臨床BE 試驗結果均表明仿制制劑與參比制劑生物等效,且仿制制劑已通過一致性評價。綜上認為,仿制制劑在pH 4.5 的醋酸鹽緩沖液中的溶出速率與參比制劑不相似,對藥物的體內PK 影響不大,僅僅通過體外溶出曲線相似性評價不能準確反映瑞舒伐他汀鈣片的體內過程。
參比制劑在pH 1.0 的鹽酸溶液中的溶出速率快于仿制制劑,而在pH 4.5 和pH 6.6 的介質中的溶出速率慢于仿制制劑,可能是由于仿制制劑的包衣層與輔料及生產工藝與參比制劑不一致導致的。由于臨床BE 試驗結果顯示兩制劑各PK 參數不存在顯著差異,說明制劑經胃腸道到達吸收部位時,藥物已基本完全溶出,溶出速率的差異被均一化。
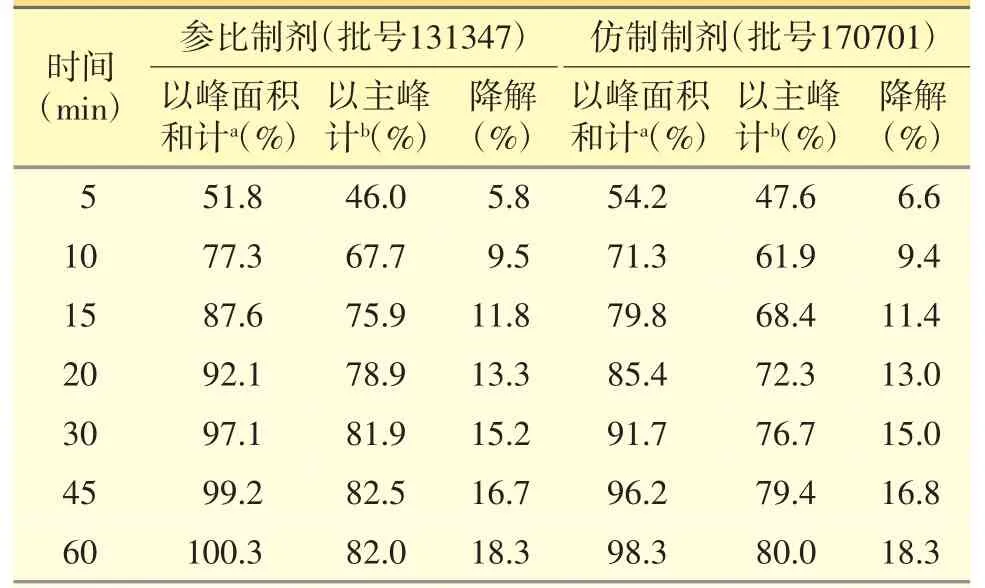
表6 兩制劑在pH 1.0 鹽酸溶液中降解情況統計
對比實測的和模擬的藥代動力學曲線,軟件在吸收相擬合良好;在消除相,模擬比實測的消除稍慢,可能是由于模型建立所用的清除率和分布容積等數據是基于白種人的靜脈滴注數據計算得到,與中國人存在差異導致的。盡管虛擬BE 和實際臨床試驗的藥動學參數存在一定差異,但結果均顯示仿制品與參比品生物等效。虛擬BE 試驗為仿制藥一致性評價工作的臨床前研究提供了一種新的思路,即體外-PK 建模-體內研究。為制劑處方篩選和BE臨床試驗設計提供指導,降低制劑生物不等效風險,縮短藥物的研發周期。GastroPlusTM等計算機模擬技術可用于仿制藥一致性評價研究中。