文蛤過氧化氫酶的生物信息學分析
張志東,張 雨,陳愛華*,吳楊平*,曹 奕,陳素華,田 鎮,2,李秋潔,2
(1. 江蘇省海洋水產研究所,江蘇 南通 226007;2. 上海海洋大學 水產與生命學院,上海 201306)
文蛤(Meretrixmeretrix)隸屬于軟體動物門(Mollusca)、瓣鰓綱(Lamellibrabchia)、簾蛤目(Veneroida)、簾蛤科(Veneridae)、文蛤屬(Meretrix),是我國重要的經濟貝類之一[1]。近年來,隨著海水養殖業的發展,文蛤養殖面臨著污染、疾病等問題的困擾,因此選育抗逆性強的文蛤良種是目前行之有效的手段之一。過氧化氫酶(CAT)在文蛤抗逆性方面具有重要的指示作用。機體在逆境中,會大量產生過氧化氫(H2O2),其具有強烈的氧化作用,對細胞產生毒害[2]。過氧化氫酶(Catalase, CAT)是一類廣泛存在于生物體內的活性酶,可與生物體內的過氧化氫特異性結合,使之分解為水和氧氣,維持機體氧化還原平衡,使機體免受氧化應激(Oxidative Stress,OS)的損傷[3]。十九世紀初,Thenard首次發現過氧化氫酶。到了20世紀,Oscar Loew將該酶正式命名為“Catalase”,即過氧化氫酶,又稱觸酶[4]。以前主要研究過氧化氫酶活性及作為生物抗逆性的標志物[5-7]。近年來,許多水生生物過氧化氫酶基因陸續被克隆出來[8-11],Wang等[12](2012)首次克隆出文蛤過氧化氫酶基因(MmeCAT),進一步推動了過氧化氫酶在分子生物學領域的研究。目前關于文蛤過氧化氫酶蛋白結構的研究尚未有報道,本研究在已公布的MmeCAT序列的基礎上,利用生物信息學方法對其表達產物理化性質、親水性、跨膜結構域、磷酸化位點、糖基化位點、信號肽、亞細胞定位、功能結構域、二級結構以及三級結構等進行預測,旨在為文蛤過氧化氫酶的結構與功能的研究提供理論基礎。
1 材料與方法
1.1 數據來源
文蛤MmeCAT基因來源于GenBank,其登錄號為JQ005875.1。對該基因完整編碼蛋白質序列進行 BLAST 分析;與其同源性較高的有織錦巴非蛤(Paphiatextile),登錄號為KF673103.1;河蜆(Corbiculafluminea),登錄號為KX211962.1;硬殼蛤(Mercenariasp.),登錄號為JN671460.1;合浦珠母貝(Pinctadafucata),登錄號為HQ703465.1;厚殼貽貝(Mytiluscoruscus),其登錄號為KX957929.1等。以上物種CAT基因均由NCBI網站(https: / /www.ncbi.nlm.nih.gov /)GenBank數據庫下載。
1.2 實驗方法
首先用BioEdit7.0軟件將文蛤CAT基因完整編碼蛋白序列翻譯成氨基酸序列待用。然后將氨基酸序列輸入ExPASy ProtParam在線工具(https://web.expasy.org/protparam/)分析該蛋白質的理化性質。理化性質包括氨基酸組成、分子式、相對分子質量、理論等電點、消光系數、半衰期、不穩定系數、脂肪系數等,并用Excel2007整理所得數據。通過ProtScale工具(https://web.expasy.org/protscale/)預測該蛋白質疏水性、親水性。通過TMHMM Server v 2.0(http://www.cbs.dtu.dk/services/TMHMM/)預測跨膜結構區域。通過NetPhos 3.1 Server在線工具(http://www.cbs.dtu.dk/services/NetPhos/)對該蛋白質的磷酸化位點進行預測。利用NetOGlyc 4.0 Server在線工具(http://www.cbs.dtu.dk/services/NetOGlyc/)對該蛋白質進行糖基化位點預測。通過SignalP 5.0 Server軟件判斷該蛋白質信號肽存在與否。通過PSORT Ⅱ Prediction在線軟件(https://psort.hgc.jp/form2.html)對該蛋白質進行亞細胞定位。使用BlastP對該蛋白質保守結構域進行分析。使用SOPMA在線工具(https://npsa-prabi.ibcp.fr)分析該蛋白質二級結構,并用SWISS-MODEL在線工具(https://www.swissmodel.expasy.org/)預測該蛋白質三級結構。運用STRING數據庫(https://string-db.org/),設置為高置信度0.7,不限制數量,構建與CAT相互作用的蛋白網絡。
2 結果與分析
2.1 文蛤過氧化氫酶理化性質分析
通過ExPASy ProtParam在線工具(https://web.expasy.org/protparam/)獲得文蛤過氧化氫酶的理化性質。文蛤過氧化氫酶由511個氨基酸組成,其中甘氨酸(Gly)有42個,含量最多占8.2%;色氨酸(Trp)和半胱氨酸(Cys)均有6個,含量最少占1.2%(見圖1)。相對分子質量為58 181.29 Da;理論等電點為8.05;帶負電荷氨基酸殘基數(Asp+Glu)為63個,帶正電荷氨基酸殘基數(Arg+Lys) 為65個;其分子式為C2588H3928O767N730S20;假設所有半胱氨酸全部形成胱氨酸,其消光系數為63 175 mol /L, 相應的吸光度為 1.086; 假設所有的半胱氨酸均未形成胱氨酸時,消光系數為 62 800 mol /L,相應的吸光度為 1.079;其半衰期為30 h,脂肪族氨基酸指數為57.28,不穩定系數為27.77(<40),可知文蛤過氧化氫酶為穩定蛋白質。
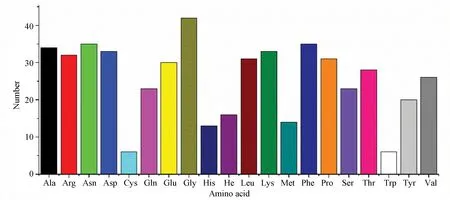
圖1 文蛤過氧化氫酶氨基酸組成Fig.1 Amino acid composition of catalase in M.meretrix
2.2 文蛤過氧化氫酶疏水性與親水性分析
通過ProtScale工具得到文蛤過氧化氫酶疏水性與親水性見圖2。圖2中的負值表示親水性,該值越小說明該蛋白質親水性越強;正值為疏水性,正值越大說明該蛋白質疏水性越強。文蛤過氧化氫酶第311位的精氨酸(Arg)分值最高為1.767 ;第 500位的纈氨酸(Val) 和 491 位的丙氨酸(Ala)分值最低,為-3.200 。親水性總平均值為-0.732,表明過氧化氫酶為親水性蛋白。

圖2 文蛤過氧化氫酶親水性與疏水性Fig.2 Hydrophilic and hydrophobic properties of catalase in M.meretrix
2.3 文蛤過氧化氫酶糖基化與磷酸化位點預測
通過NetOGlyc 4.0 Server與NetPhos 3.1 Server在線工具對該蛋白質進行糖基化和磷酸化位點預測。結果顯示文蛤過氧化氫酶糖基化位點有51個,磷酸化位點有71個。其中位于絲氨酸(Ser)殘基上的有23個,位于蘇氨酸(Thr)殘基上的有28個,位于酪氨酸(Tyr)殘基上的有20個(見圖3)。
2.4 文蛤過氧化氫酶跨膜區域與信號肽預測
運用TMHMM Server v 2.0軟件預測文蛤過氧化氫酶跨膜區域,結果顯示,該酶為膜外蛋白。通過SignalP 5.0 Server軟件判斷文蛤過氧化氫酶不存在信號肽。
2.5 文蛤過氧化氫酶亞細胞定位和保守結構域分析
通過PSORT Ⅱ Prediction在線軟件對文蛤過氧化氫酶進行亞細胞定位。結果表明:文蛤過氧化氫酶有69.6%可能存在于過氧化氫酶體中,有21.7%存在于細胞核中,存在于線粒體和細胞骨架的可能性均為4.3%,說明文蛤過氧化氫極可能存在于過氧化物酶體中。用Blastp在線工具比對文蛤過氧化氫酶蛋白質序列,結果顯示該蛋白質擁有血紅素結合的保守結構域(Heme binding pocket)、NADPH結合位點(NADPH binding site)以及四聚體界面(Tetramer interface)三個結構功能域,屬于典型單功能過氧化氫酶的第三分支(見圖4),可能屬于catalase like超家族中clade 3 分支的成員。
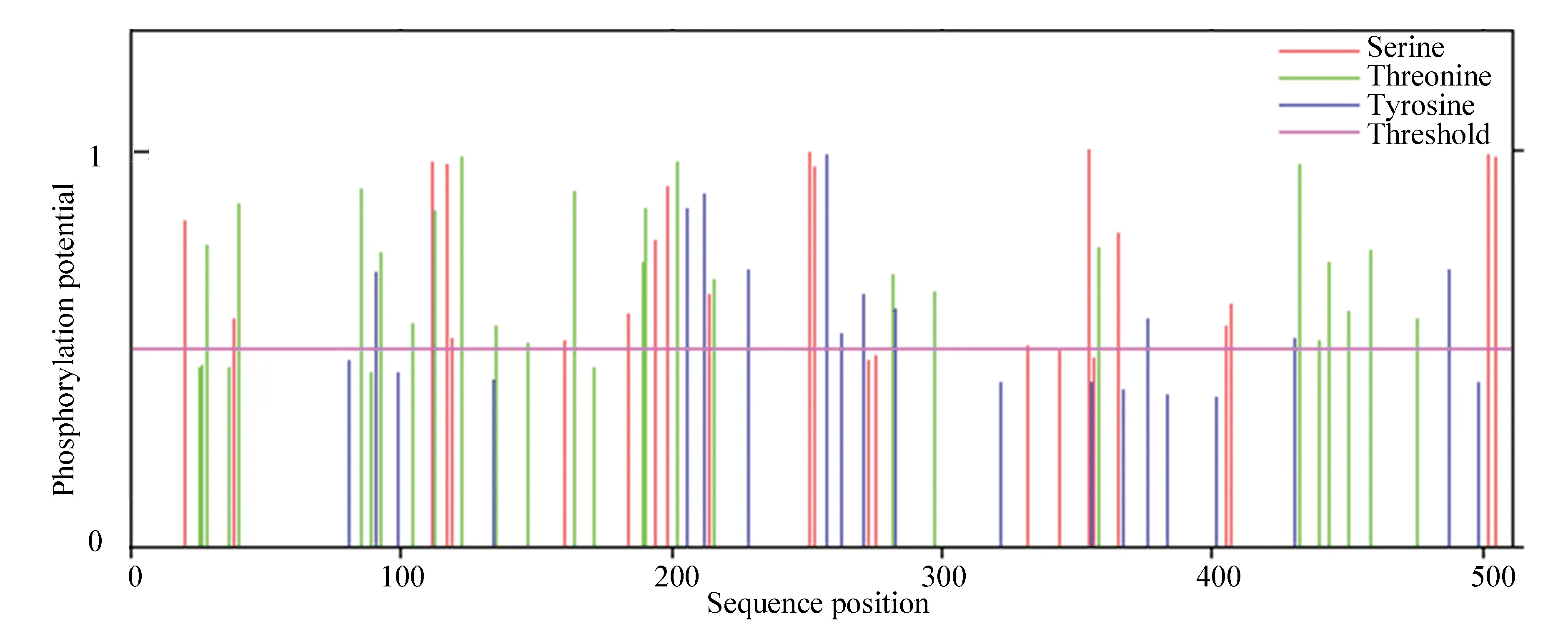
圖3 文蛤過氧化氫酶磷酸化位點預測Fig.3 Prediction of catalase phosphorylation sites in M.meretrix

圖4 文蛤過氧化氫酶保守結構域分析Fig.4 Conservative structure domain analysis of catalase in M.meretrix
2.6 文蛤過氧化氫酶二級結構和三級結構預測
使用SOPMA在線工具預測文蛤過氧化氫酶二級結構,結果表明無規卷曲(Random coil)和α-螺旋(Alpha helix)是其主要構成元件。其中無規卷曲由266個氨基酸構成,占總氨基酸的52.05%;α-螺旋由145個氨基酸構成,占總氨基酸的28.38%;78個氨基酸形成延伸鏈(Extended strand),占比為15.25%;β-轉角(Beta turn)由22個氨基酸構成,占比最小(4.31%)。通過SWISS-MODEL在線工具預測得出文蛤過氧化氫酶三級結構(見圖5),可見其扭曲和折疊較多,結構豐富,這對其生物學功能的發揮具有重要作用。
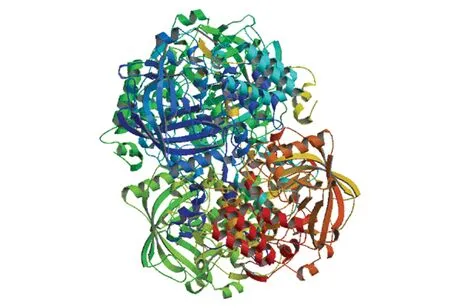
圖5 文蛤過氧化氫酶三級結構Fig.5 Three-dimensional model of catalase in M.meretrix
2.7 文蛤過氧化氫酶蛋白質相互作用分析
運用STRING數據庫(https://string-db.org/),設置為高置信度0.7,不限制數量,構建與CAT相互作用的蛋白網絡(見圖6)。結果發現:與CAT相互作用的蛋白質主要包括SOD1(Superoxide Dismutase 1 )、SOD2(Superoxide Dismutase 2 )、SOD3(Superoxide Dismutase 3 )、GSR(Glutathione Reductase)、AKT1(Protein Kinase B)、SCP2(Single Cell Protein 2)、HSD17B4(17β-Hydroxysteroid dehydrogenase Ⅳ)、ACOX1(Acyl Coenzyme A Oxidase 1)、HAO1(Hydroxyacid Oxidase 1)、DAO(Diamine Oxidase)。

圖6 CAT蛋白相互作用網絡Fig.6 Protein-protein interaction network for CAT
對以上互作蛋白的基因進行GO分析,結果表明:有4個互作基因表達產物具有超氧化物歧化酶活性,有6個基因參與表達氧化還原酶,有3個基因參與過氧化物代謝過程,3個基因參與去除超氧自由基,3個基因表達產物作為蛋白質復合體,還有3個基因表達產物可能是磷蛋白質,還有3個基因表達產物可能存在于細胞質中(見圖7)。KEGG分析表明:互作基因在過氧化物酶體的形成過程顯著富集,當文蛤受氧化應激時,ACOX、SCPX、CAT等基因有上調趨勢,PRDX1基因則有下調趨勢(見圖8)。

圖7 GO注釋結果Fig.7 Results of GO annotation
3 討論與結論
利用生物信息學的方法,對文蛤過氧化氫酶蛋白結構進行分析,結果顯示文蛤過氧化氫酶由511個氨基酸組成,相對分子質量為58 181.29 Da,為親水蛋白,與櫛孔扇貝(ChlamysFarreri)[13]、褶紋冠蚌(Cristariaplicata)[14]、盤鮑(Haliotisdiscusdiscus)[15]、仿刺參(Apostichopusjaponicus)[16]等過氧化氫酶的研究結果非常相似,這些酶的編碼蛋白序列都在 500~520 個氨基酸之間,說明了該酶在物種進化上具有高度的保守性。文蛤過氧化氫酶的主要二級結構是無規卷曲,屬于catalase like超家族。 根據GO分析、KEGG通路分析結果,結合亞細胞定位情況和結構分析結果,推測文蛤過氧化氫酶在文蛤細胞內主要參與過氧化物酶體的合成及抗氧化作用。根據文蛤過氧化氫酶互作蛋白的基因GO分析和KEGG通路分析結果可知,互作基因表達產物具有超氧化物歧化酶活性、參與去除超氧自由基、參與過氧化物代謝過程等生物過程。當文蛤受氧化應激時,CAT等基因顯著上調(見圖8),與蘇恩萍[17]等文蛤過氧化氫酶活力研究結果一致,該結果說明文蛤過氧化氫酶的活力不僅受外界環境的影響,同時也受基因的調控。有研究表明SOD和CAT是機體防御過氧化損害系統中的兩個關鍵酶,其能有效地消除活性氧,防止細胞膜系統過氧化作用的發生[3]。因此,CAT基因與互作蛋白中的SOD基因之間的調控關系值得深入研究。
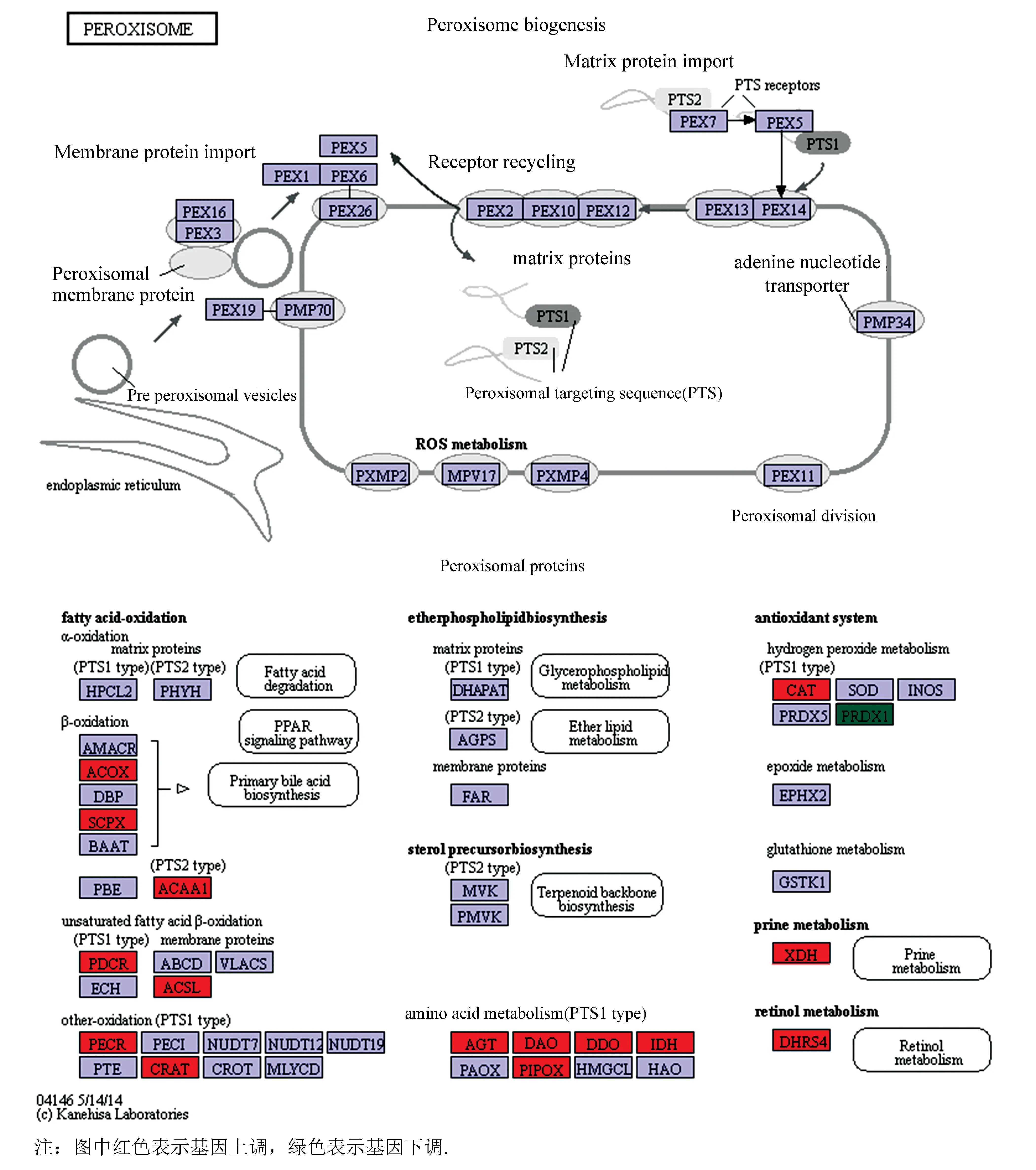
圖8 互作基因信號通路Fig.8 Interacting gene signaling pathways
對文蛤過氧化氫酶理化性質、親水性、磷酸化位點、糖基化位點、跨膜結構域、信號肽、亞細胞定位、二級結構、三級結構以及功能域等生物學信息進行了整理,為研究文蛤MmeCAT基因及其編碼產物的功能提供了更多的信息。文蛤過氧化氫酶屬穩定性蛋白,在生物進化上具有高度的保守性,其基因可以穩定遺傳,且具有使機體免受氧化應激的生物學功能[18]。因此,在今后文蛤抗逆性品種選育上,可將文蛤過氧化氫酶含量作為目標性狀之一。研究文蛤過氧化氫酶結構,有助于進一步研究文蛤的生物應激作用,同時為文蛤抗逆性品種選育提供理論基礎。

